Kratzwürmer
Die Kratzwürmer oder Kratzer (Acanthocephala; von griech. ἄκανθος akanthos = „Dorn“ und κεφαλή kephale = „Kopf“) sind eine Gruppe von Darmparasiten mit obligatorischem Wirtswechsel. Sie befallen als Zwischenwirte verschiedene wasserlebende und terrestrische Gliederfüßer, vor allem Insekten und Krebstiere, und als Endwirte Fische, Amphibien, Vögel und Säugetiere. Bis heute sind etwa 1100 Arten mit Körperlängen zwischen wenigen Millimetern und 70 Zentimetern beschrieben worden. Die Tiere sind in allen Entwicklungsstadien darmlos und nehmen ihre Nahrung über das Tegument auf, ein Kanalsystem in der Außenhaut. Zudem sind alle bekannten Arten getrenntgeschlechtlich. Namensgebend ist der hakenbewehrte Rüssel, mit dem sich die Tiere in der Darmwand der Wirte verankern.
| Kratzwürmer | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Pomphorhynchus im Rektum eines Blaufisches (Pomatomus saltatrix) | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Acanthocephala | ||||||||||
| Kohlreuther, 1771 | ||||||||||
| Klassen | ||||||||||
Kratzwürmer werden in der klassischen zoologischen Taxonomie als Tierstamm betrachtet, nach heutigem Kenntnisstand handelt es sich bei ihnen jedoch um abgeleitete Rädertierchen (Rotatoria).
Merkmale
Körperbau und äußere Anatomie

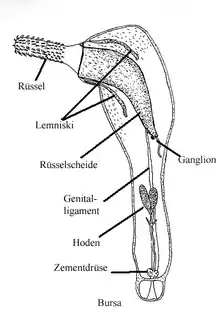
Die Kratzwürmer haben einen dreiteilig gegliederten Körper. Dabei ist der Rumpf (Metasoma), der die gesamten inneren Organe beherbergt, der größte Abschnitt, während der Hals und der Rüssel oder das Scolex (gemeinsam als Präsoma bezeichnet) nur einen kleinen Teil der Körperlänge ausmachen. Eine Bauch- und Rückenseite lässt sich bei den Kratzwürmern weder äußerlich noch anhand der Organlagen festlegen; die Lagebestimmung wurde bei ihnen aufgrund der Organe der nahe verwandten Bdelloida festgelegt, bei denen die Gonaden immer auf der Bauchseite (ventral) und das Gehirn immer auf der Rückenseite (dorsal) liegt. Die Anzahl und die Anordnung der Zellen während der Entwicklung ist bei den meisten Arten arttypisch und stabil (Eutelie), nur die Anzahl der Keimzellen nimmt ständig zu. Bei den meisten Arten sind die Weibchen deutlich länger und kräftiger gebaut als die Männchen.
Der Rüssel ist mit nach hinten gerichteten Haken bestückt, die der Anheftung im Darm des Wirtes dienen und denen die Tiere ihren wissenschaftlichen Namen Acanthocephala verdanken. Bei vielen Arten, vor allem bei Vertretern der Palaeacanthocephala und der Eoacanthocephala, sitzen auch am Hals, der den Übergang zwischen Rüssel und Rumpf darstellt, und am Vorderteil des Rumpfes Haken oder ungekrümmte Dornen. Der Rumpf ist meistens glattwandig oder gerunzelt; bei einigen Arten wie etwa Mediorhynchus taeniatus besitzt er eine nur äußerlich vorhandene Pseudosegmentierung, die ihnen das Aussehen eines segmentierten Wurmes verleiht.
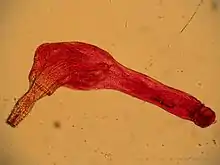
Das Tegument kann bei den sehr großen Arten bis zu zwei Millimeter dick werden und wird, ebenso wie viele andere Gewebe dieser Tiere, von einem Syncytium gebildet. Die Grundlage dieses Zellverbandes bilden bei den meisten Arten etwa 6 bis 20 Einzelzellen, deren angrenzende Zellmembranen sich auflösen und somit gruppenspezifisch ein Gewebe mit vielen kleinen oder deutlich weniger sehr großen Zellkernen bilden. Die Zellkerne vergrößern sich im Laufe der Entwicklung und werden durch ständige Mitosen polyploid, bei vielen Arten verästeln sie sich und erreichen Durchmesser von bis zu zwei Millimetern. Besonders bei großen Arten zerfallen die Zellkerne ohne mitotische Teilung in viele kleine Bruchstücke. In der Epidermis liegen zudem Kollagenfasern, die an der Außenseite vorwiegend parallel zur Körperrichtung und in den unteren Schichten ringförmig verlaufen und so die Epidermis stabilisieren. Der äußerste Bereich ist dichter als der innere, bildet jedoch keinen Panzer. Diese Schicht ist von zahlreichen Einstülpungen durchzogen, die ein komplexes Lakunensystem bilden, welches der Ernährung dient.
Organsysteme und innere Anatomie
Das Verdauungssystem ist bei den Kratzwürmern vollständig zurückgebildet und kommt auch bei den Larven nicht vor. Die Nahrungsaufnahme erfolgt stattdessen durch die Haut (siehe unten).
Unterhalb der Epidermis liegt eine Ringmuskel- und eine dünnere Längsmuskelschicht aus Muskeln, die zentral einen Hohlraum besitzen und deren Lumen untereinander und mit dem Lakunensystem verbunden sind. Auch diese Muskelgewebe bestehen aus verschmolzenen Zellen (Syncytium). Als Gegenpart bzw. Antagonist dieser Muskulatur dient das sogenannte Hydroskelett der Tiere; die flüssigkeitsgefüllte Leibeshöhle erzeugt einen Gegendruck zur Muskelanspannung und bewirkt so eine Streckung und Erweiterung in den nichtangespannten Körperpartien. Die Muskulatur der Rüsselscheide besteht dagegen aus kreuzweise übereinandergelagerten Muskelfasern. Vom Hals ragen zwei zapfenartige Auswüchse der Epidermis in das Metasoma und enden am Rumpf im vorderen Drittel. Diese so genannten Lemnisci sind von Muskulatur umgeben, die den Hals und den Rüssel zurückziehen kann (Hals- und Rüsselretraktoren) und somit als Antagonist der Rüsselmuskulatur dient. Die Lemnisci selbst spielen eine zentrale Rolle für die Hydraulik des Rüssels, der sich mit ihrer Hilfe drehen und im Darm des Wirtes verhaken kann.
Innerhalb der zweigeteilten Leibeshöhle befinden sich mehrere Hohlraumsysteme. So gibt es neben dem beschriebenen Lakunensystem ursprünglich zwei Ligamentsäcke mit mesodermaler Umhüllung im Rumpf sowie eine davon getrennte Höhle im Rüssel. Die Ligamentsäcke sind durch einen Ligamentstrang, wahrscheinlich ein Relikt des ursprünglichen Darms, teilweise getrennt. Die Ligamentsäcke lösen sich bei den Palaeacanthocephala im Adultstadium auf, sodass die Ligamenthöhlen und die Leibeshöhle miteinander verschmelzen.
Das Nervensystem der Kratzwürmer ist aufgrund der endoparasitischen Lebensweise sehr stark reduziert und dient vor allem der Innervation der Muskulatur. So besitzen sie ein zentrales Zerebralganglion an der Rückenseite der Rüsselscheide, welches bei den meisten Arten aus nur 73–86 Nervenzellen besteht. Von diesem zieht ein Paar Hauptnerven bauchwärts in den Rumpf. Die Männchen besitzen hier ein weiteres Ganglion aus etwa 30 Nervenzellen in der Penispapille. Als Sinnesorgane sind nur wenige Tastsensillen an der Rüsselspitze und am Hals nachgewiesen.
Auch die Exkretion erfolgt wie die Ernährung fast ausschließlich über die Epidermis, nur sehr große Arten aus der Familie der Oligacanthorhynchidae besitzen in zwei Büscheln angeordnete, einfach gebaute Protonephridien, mit denen sie Exkrete aus der Leibeshöhle filtern und über die Kloake ausführen. Diese Protonephridien sind neben den Spermien die einzigen Organe der Kratzwürmer, die Kinozilien besitzen. Die Geschlechtsorgane liegen im hinteren, bauchwärts gerichteten Teil des unteren Ligamentsacks. Die Männchen besitzen ein bis zwei Paar Hoden sowie eine artspezifische Anzahl von so genannten Zementdrüsen – Klebedrüsen, die bei der Kopulation eingesetzt werden. Beide münden über die Penispapille in der Bursa copulatrix. Die Weibchen besitzen keine Ovarien. Diese sind in kleine Ballen aufgelöst, die im Ligamentsack und bei den Palaeacanthocephala in der Leibeshöhle frei flottieren. Die Ovarialballen bestehen jeweils aus zwei Syncitien, wobei das innere die Eier bildet, während das äußere die Ernährung des Ballens gewährleistet.[1]
Karyotyp
Die Anzahl der Chromosomen der Kratzwürmer ist bei allen Arten sehr gering und liegt meistens bei etwa sechs oder acht Chromosomen insgesamt. Bei einigen Arten, etwa dem Riesenkratzer, gibt es zudem unterschiedliche Geschlechtschromosomen, sodass beim Männchen der heterozygote Typ XY und beim Weibchen der homozygote Typ XX vorliegt. Bei vielen anderen Arten gibt es dagegen nur gleichförmige Geschlechtschromosomen, bei ihnen fehlt dem Männchen ein X-Chromosom und es besitzt entsprechend den Typ X0 und hat ein Chromosom weniger als das Weibchen. Bei Acanthocephalus ranae liegt bei beiden Geschlechtern der Chromosomentyp XY vor.[2]
Anatomie der Entwicklungsstadien
Bei den Kratzwürmern werden drei Entwicklungsstadien unterschieden (Acanthor, Acanthella und Cystacanthus), die je nach Quelle als eigenständige Larven oder als Subformen der jeweils nachfolgenden Entwicklungsstufe betrachtet werden. Als eindeutige Larve gilt in diesem Kontext häufig nur der Acanthor, während die Acanthella sowie der Cystacanthus häufig als Subadulte angesehen werden.
Acanthor
Der Acanthor ist die früheste Larvenform der Kratzwürmer. Er ist bei der Eiablage des adulten Weibchens bereits voll entwickelt und verlässt den Darm des Wirtes in einer mehrschichtigen Eischale. Diese wird erst verlassen, wenn sich der Acanthor im Darm des Zwischenwirts befindet, wo er sich in die Darmwand einbohrt. Die Eischale besteht dabei aus vier lichtundurchlässigen Schichten, die jeweils durch Zwischenschichten voneinander getrennt sind. Die Schichten unterscheiden sich innerhalb der Kratzwürmer in ihrem Aufbau und stellen ein wichtiges Merkmal für die systematische Einordnung der Arten dar. So enthalten bei allen Kratzwürmern die beiden äußeren Eischalen ausgehärtetes Keratin und sind teilweise durch Keratinspangen miteinander verbunden. Innerhalb der Archiacanthocephala enthält auch die dritte Schicht noch Keratin, während dies bei den Palaeacanthocephala und Eoacanthocephala fehlt. Außerdem beinhaltet die innerste Eischale der Archiacanthocephala und Palaeacanthocephala Chitin, welches den Eoacanthocephala fehlt. Vor allem die äußeren Schichten bieten dem Acanthor Schutz im Verdauungstrakt der Zwischenwirte und quellen durch den Einfluss von Verdauungsenzymen auf und platzen, sodass der Acanthor im Darm freigesetzt wird.
Der Acanthor besteht in der vollständig ausdifferenzierten Form im Wesentlichen aus drei unterschiedlichen Syncytien, dem vorderen, dem zentralen und dem epidermalen Syncytium. Wie die adulten Tiere besitzen sie keinen Darm, dieser wird auch in der Embryonalentwicklung nicht angelegt. Das vordere Syncytium (frontal syncytium) beinhaltet viele elektronendichte Vesikel sowie größere Vesikel, die eine schleimähnliche Substanz enthalten, deren Zweck bislang ungeklärt ist. Das zentrale Syncytium (central syncytium) beinhaltet vor allem kondensierte und unkondensierte Zellkerne und ist häufig mit zehn subepidermalen und zwei Retraktor-Muskelsträngen verbunden, die die Bewegung und Verformung des Acanthors ermöglichen und wahrscheinlich aus dem zentralen Syncytium gebildet werden. Den Hauptteil des Körpers bildet das epidermale Syncytium (epidermal syncytium). Dieses bildet die epidermale Umhüllung der Larve mit einem untereinander verbundenen Lakunensystem sowie den größten Teil der Körpermasse. In ihm sind ebenfalls Zellkerne sowie verschiedene, teils mit schleimähnlichen Substanzen gefüllte, Vesikel enthalten. Auf der Epidermis bilden sich artspezifisch kleinere Körperstacheln im hinteren Bereich sowie kräftigere Haken im vorderen Bereich aus, die zum Eindringen in die Darmwand des Zwischenwirts benötigt werden.
Die Inhaltsstoffe der verschiedenen Vesikel im frontalen und epidermalen Syncytium sind bislang nur sehr rudimentär erforscht. Man nimmt an, dass sie beim Eindringen in den Darm sowie bei der Inaktivierung der Immunabwehr im Zwischenwirt eine zentrale Rolle spielen. So gibt der Acanthor beispielsweise Chitinasen (Enzyme zum Abbau von Chitin) ab.[3]
Acanthella
Sobald der Acanthor das Darmlumen verlassen und sich in die Darmwand und später in die Leibeshöhle des Zwischenwirtes eingebohrt hat, beginnt die Larve sich umzuorganisieren und eine Acanthella zu bilden. Dabei sind sämtliche Prozesse der Organogenese bis zur Bildung des Cystacanthus kontinuierlich. Mit der Umorganisation verlagert sich die Hauptachse des Körpers um 90° und die äußere Umhüllung des Acanthor dehnt sich, um zum Tegument der Acanthella zu werden. Aus der Außenmembran des Teguments wachsen filamentöse Auswüchse, die eine schwammähnliche Umhüllung der Larve bilden und dabei auch Blutzellen (Hämocyten) des Zwischenwirtes einschließen können. Sie teilt sich im weiteren Verlauf in eine innere und eine äußere Umhüllung und löst sich von der Epidermis der Larve, wodurch zwischen beiden ein im Lichtmikroskop granulär erscheinender, wahrscheinlich flüssigkeitsgefüllter Zwischenraum entsteht.
Das zentrale Syncytium teilt sich auf und bildet die Entwicklungskerne der späteren Organe, die nun nach und nach ausdifferenzieren. In der späten Acanthella bildet sich der Rüssel, der später häufig mit dem gesamten Vorderende in die Rüsselscheide eingezogen wird, wodurch die Larve ein zystenähnliches Aussehen erhält. Der Übergang zur infektiösen Larve, dem Cystacanthus, schließt sich an.[4]
Cystacanthus
Der Cystacanthus ist die infektiöse Form der Acanthella, wobei sich der Name auf die zystenartige Form dieses Stadiums bei den größeren Arten der Kratzwürmer, vor allem beim Riesenkratzer, bezieht. Bei den meisten Kratzwürmern sind die infektiösen Stadien allerdings gebogen und damit „wurstförmig,“ wodurch sie den ausgewachsenen Tieren mit eingezogenem Rüssel entsprechen und demnach häufig als Subadulte angesehen werden. Die Geschlechtsorgane sind bei ihnen meist schon sehr weit ausgebildet, jedoch durch einen deutlichen Abstand von der massiven Körperwand der Tiere getrennt. Die Poren und Lakunen der Epidermis sind weitestgehend verschlossen und es wird keine Nahrung aufgenommen, ansonsten gibt es jedoch keine anatomischen Unterschiede zu den Adulttieren.[5]
Verbreitung und Wirtsspektrum
Kratzwürmer sind weltweit in ihren marin, limnisch wie auch terrestrisch lebenden Wirtstieren zu finden. Dabei gibt es eine Reihe von Arten, die sich auf einzelne Wirtsorganismen spezialisiert haben und entsprechend auch nur in deren Verbreitungsgebiet vorkommen. So existieren beispielsweise Arten, die nur in australischen Beuteltieren oder in antarktischen Robben parasitieren. Sehr spezifische und räumlich begrenzte Arten werden auch heute noch neu beschrieben, darunter etwa die erst 2007 beschriebene Acanthocephalus reunionensis in Süßwasseraalen auf der Insel Réunion im Indischen Ozean[6] oder Pomphorhynchus moyanoi aus Süßwasserfischen in Zentralchile.[7]
Viele Arten, vor allem Parasiten von Fischen, besitzen jedoch ein relativ unspezifisches Wirtspektrum und können entsprechend bei vielen Tierarten und in einem großen Gebiet nachgewiesen werden. Einzelne Arten parasitieren in kosmopolitischen Nutztieren wie dem Hausschwein oder dem Nutzgeflügel oder in weltweit verbreiteten Kulturfolgern wie der Wanderratte und sind entsprechend ebenfalls weltweit anzutreffen.
Lebensweise
Verankerung im Wirt
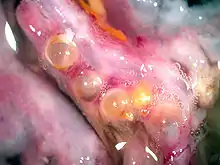
Innerhalb der Kratzwürmer unterscheidet man parasitologisch zwischen Arten, die sich nur in der Schleimhaut des Darmlumens verankern und solchen, die zur Verankerung den Darm des Endwirtes mit ihrem Rüssel durchdringen (perforieren).
Nicht perforierende Arten besitzen im Regelfall einen sehr kurzen Rüssel und eine entsprechend ebenfalls nur kurze Rüsselscheide. Sie verhaken sich innerhalb der Darmzotten und dringen mit dem Rüssel nicht bis in die Muskelschicht des Darmes ein. Im Regelfall ist bei ihnen weniger als die Hälfte des Rüssels von Darmgewebe des Wirts umgeben. Dies kann durch den Darmaufbau des Wirtes bedingt sein: So besitzen etwa Forellenfische eine Kompaktschicht oder der Flussbarsch eine Kollagenschicht, die die Darmwand verstärken und so eine Perforation durch Arten ohne entsprechende kollagenabbauende Enzyme nicht ermöglichen, aber als Widerlager für die Rüsselhaken dienen. Zu diesen Arten gehören unter anderen die Fischkratzer Acanthocephalus lucii und Echinorhynchus truttae, die auch in kleineren Fischarten ohne eine verstärkende Schicht keine Penetration vornehmen, sowie die meisten in terrestrischen Wirbeltieren lebenden Archiacanthocephala einschließlich des potentiellen Humanparasiten Moniliformis moniliformis. Einige dieser Arten können sich auch wieder aus der Darmwand lösen und die Position verändern sowie potentiell auch im Adultstadium von einem Tier auf einen größeren Räuber übertragen werden, wie dies für Neoechinorhynchus rutili mehrfach nachgewiesen ist. Bei hohem Wurmbefall im Darm kommt es vor, dass sich auch typischerweise perforierende Arten nur in den inneren Schichten des Darms verhaken und so das Potential zur Positionsveränderung behalten.
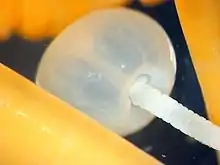
Diesen Arten stehen perforierende Arten gegenüber, die einen langen Halsbereich und Rüssel besitzen und meistens auch einen Bulbus, eine blasenartige Verdickung ausbilden, die der endgültigen Verankerung hinter der Darmwand dient. Dieser Bulbus kann sich wie bei den Pomphyrhynchus-Arten an der Rüsselspitze oder wie bei Eocollis arcanus am Vorderende des Rumpfes befinden. Bei der Perforation kann artspezifisch das rasche Eindringen des bezahnten Rüssels in die Darmwand durch die eiweiß- und kollagenabbauende Wirkung von Enzymen ähnlich dem Trypsin unterstützt werden, die im Bereich des Rüssels in das Darmgewebe abgegeben werden und dieses hier auflösen. Perforierende Arten verlassen die Position, an der sie sich eingehakt haben, nicht mehr und können auch nicht mit dem Darmstrom verdriftet werden. Bei Arten wie Pomphyrhynchus laevi, Eocollis arcanus oder Acanthocephalus anguillae, die typischerweise perforierend sind, kann es bei sehr kleinen Parasiten oder bei ungeeigneten Wirten sogar vorkommen, dass der Darm mit dem gesamten Körper durchdrungen wird und sich die Würmer außerhalb des Darms im Bauchfell befinden und dort absterben. Zu den perforierenden Kratzern gehört auch der Riesenkratzer, der bei Menschen und Schweinen den Darm ebenfalls vollständig durchdringen kann und nachfolgend im Bauchfell abstirbt.
Ernährung

Die Nahrungsaufnahme der Kratzwürmer erfolgt ausschließlich über die Epidermis, wodurch die Würmer auf eine parenterale Ernährung durch ihren Wirt angewiesen sind. Zu diesem Zweck befindet sich im Inneren des epidermalen Syncytiums ein umfangreiches Lakunensystem mit ringförmigen Hauptkanälen, die durch Querkanäle verbunden sind. Es ist mit den äußeren Einstülpungen der Epidermis sowie mit der hohlen Hautmuskulatur unterhalb der Epidermis verbunden, hat jedoch keine Eröffnung in die Leibeshöhle. Umgeben ist die Epidermis mit einer etwa einen Mikrometer dicken Glykokalyx, mit deren Hilfe Nährstoffe, vor allem Proteine und Monosaccharide, aus dem Darminhalt des Wirts angebunden, aufgenommen und in das Lakunensystem eingebracht werden. Die Flüssigkeit des Systems wird durch Kontraktionen des Tieres in Bewegung gehalten, wodurch eine Verteilung im Körper gewährleistet ist.
Das Lakunensystem des Rumpfs und das des Rüssels sind voneinander getrennt. Auch in der Rüsselscheide findet eine entsprechende Nahrungsaufnahme statt. Hier sammeln sich Zellen und Flüssigkeiten, die durch die Verwundung des Darmes durch den Parasiten frei werden. Der Kratzer nimmt auf diesem Weg vor allem Lipide in Form von Triglyceriden sowie Vitamin A auf, die bei vielen Fischen und Vögeln in der Darmwand eingelagert sind. Für diese Lipidaufnahme spielt vor allem das Apikalorgan an der Rüsselspitze bzw. in der Rüsselscheide eine wichtige Rolle, die bislang nicht vollständig aufgeklärt werden konnte.
Fortpflanzung und Entwicklung
Alle Kratzwürmer sind getrenntgeschlechtlich, es gibt also männliche und weibliche Tiere. Eine Parthenogenese wie bei den nahe verwandten Bdelloida oder eine ungeschlechtliche Vermehrung kommt bei ihnen nicht vor. Bei der Begattung umgreift das Männchen mit der Bursa copulatrix das Hinterende des Weibchens und stülpt diese dann ein, wodurch das weibliche Hinterende mit der Geschlechtsöffnung in die Bursa gezogen wird. Danach presst es die in der Bursa liegende Penispapille in die Vagina des Weibchens und gibt die Spermien in diese ab. Diese sind fadenförmig (filiform) mit einer Länge von 20 bis 80 Mikrometern und freischwimmend, sie weisen weder Mitochondrien noch ein Akrosom auf. Sie bewegen sich aktiv zu den Ovarialballen der Weibchen und befruchten dort die noch im Ballen befindlichen Eier.
Die befruchtete Eizelle (Zygote) beginnt nach der Verschmelzung der Zellkerne des Spermiums und des Eies mit einer Furchung von zwei sich bildenden und fusionierenden Polkörpern, die ähnlich einer Spiralfurchung mit einer Aufteilung in Mikromere und Makromere beginnt. Um die frühe Zygote bildet sich eine Befruchtungsmembran. Die Zellmembranen der entstehenden Zellen lösen sich sehr früh auf und bilden so die Syncytien, aus denen der spätere Körper des Acanthor besteht. Das Ei wird im Verlauf der Embryonalentwicklung spindelförmig und um den Embryo lagern sich ausgehend von einer einfachen Umhüllung mehrere Eischalen, die verhärten. Während dieser Entwicklung verlässt das Ei den Ovarialballen und flottiert nun frei im Ligamentsack der Mutter.
Über einen Sortiermechanismus an der Uterusglocke werden die fertig entwickelten Eier aus der Körperflüssigkeit aussortiert und abgelegt. Dafür saugt die Uterusglocke, die sich am Eingang des Uterus im ventralen Ligamentsack befindet, alle Eier ein und drückt sie in eine Sortiervorrichtung, bei der die dünnen, spindelförmigen Eier in den Uterus gepresst und die plumperen, noch nicht fertig entwickelten Eier, in den dorsalen Ligamentsack zurückgeführt werden. Über diese Pumpfunktion wird die in den Ligamentsäcken befindliche Flüssigkeit in eine dauerhafte Strömung gebracht, durch die die Eier vom hinteren Teil des dorsalen Sacks in den Vorderkörper und danach wieder in den ventralen Sack gelangen. Die im Uterus befindlichen Eier werden in den Darm des Wirtes abgegeben und gelangen mit dessen Kot ins Freie. Dabei legen die Kratzwürmer als Parasiten eine sehr große Menge Eier ab. Beim Riesenkratzer handelt es sich dabei um täglich rund 80.000 Eier, um die Verluste auszugleichen, die in der späteren Entwicklung zwangsläufig entstehen.
Ein Teil der Eier wird von den Zwischenwirten im freien Wasser oder im Boden aufgenommen, wobei in den Eischalen vieler Kratzwürmer Zucker oder andere Stoffe enthalten sind, die die Attraktivität erhöhen. Im Darm des Zwischenwirts verlässt der Acanthor die Eischale, nachdem diese durch den Einfluss der Verdauungsenzyme aufgequollen und brüchig geworden ist und bohrt sich in die Darmwand sowie einige Wochen später in die Leibeshöhle der Tiere hinein. Das Immunsystem des Zwischenwirts reagiert auf den Eindringling, indem die Hämocyten eine dünne Zystenhülle um die Larve bilden. Innerhalb der Zyste entwickelt sich der Acanthor zur Acanthella und bildet den ausstülpbaren Rüssel und weitere anatomische Besonderheiten des Tieres aus. Die Acanthella wird abschließend zum Dauerstadium, der infektiösen Larve oder Cystacanthus, die über einen langen Zeitraum infektiös bleibt.
Erst wenn ein Endwirt den Zwischenwirt und mit ihm den infektiösen Cystacanthus aufnimmt, kann die Entwicklung zum Abschluss gebracht werden. Im Darm des neuen Wirts befreit sich der Cystacanthus aus der Zystenhülle und heftet sich mit Hilfe seines hakenbewehrten Rüssels in der Darmwand fest. Handelt es sich nicht um den endgültigen Wirt, sondern einen Fehl- oder Wartewirt, bohrt sich der Cystacanthus erneut durch den Darm und enzystiert dort abermals. Beim Endwirt entwickelt er sich dagegen zum vollausgebildeten Adultwurm und bleibt im Darm, wo er sich ernährt und Nachkommen bildet.
Evolution und Systematik
Da die Kratzwürmer als Endoparasiten in anderen Tieren leben und zudem keinerlei fossilisierbare Hartteile besitzen, sind sie als Fossilien nicht nachgewiesen. Auch bei den nahe verwandten Taxa gibt es keinen Fossilbeleg, sodass über das evolutive Alter dieser Gruppen nur spekuliert werden kann.
Äußere Systematik

Die Kratzwürmer bilden mit sehr hoher Wahrscheinlichkeit eine natürliche Gruppe, ein so genanntes Monophylum, welche einem gemeinsamen Vorfahren entstammt und keine weiteren Tiergruppen enthält. Über verschiedene molekularbiologische Untersuchungen sowie morphologische Vergleiche wurde plausibel nachgewiesen, dass ihre nächsten Verwandten die ebenfalls freilebenden Bdelloida darstellen, die in der klassischen Systematik zu den Rädertierchen (Rotatoria) gezählt werden.[8][9]
Anatomisch wird diese These unterstützt. Begründet wird die Zuordnung vor allem durch die bei beiden Gruppen vorkommende Zellkonstanz (Eutelie), den syncytialen Aufbau der Epidermis mit für beide Gruppen typischen Einsenkungen, den Lemniski, die nur bei Kratzwürmern und verschiedenen Rädertierchen vorkommen, dem ultrastrukturellen Feinbau des Rüsselretraktors und dem Bau und Verlauf des Ligamentstrangs, der dem rückgebildeten Darm von verschiedenen Rädertierchen entspricht.
Aufgrund dieser Ergebnisse stellen die Rädertierchen in der klassischen Zusammenstellung keine natürliche Gruppierung dar und müssten um die Kratzwürmer ergänzt werden. In dem Fall ist die aktuelle Einteilung beider Gruppen als Stamm in der klassischen Taxonomie nicht länger vertretbar, sie wird in neueren Publikationen nicht mehr verwendet. Die gemeinsame Gruppe aus Kratzwürmern und Rädertierchen wird als Taxon oft Syndermata benannt.
Innere Systematik
Hauptartikel: Systematik der Kratzwürmer
Als Indizien für die Monophylie der Kratzwürmer können eine Reihe von nur ihnen gemeinsamen Merkmalen, so genannten Apomorphien, benannt werden. Hierzu zählen unter anderen die sehr spezifische Epidermis mit dem nur bei den Kratzwürmern existierenden Lakunensystem zur Ernährung der Tiere, der ausstülpbare Rüssel mit den Haken, die Ligamentsäcke sowie die sehr spezielle Ausbildung der weiblichen Geschlechtsorgane mit der spezialisierten Uterusglocke.
Die Kratzwürmer enthalten drei als Klassen eingestufte Taxa, die sich vor allem in ihrer Größe und dem Wirtsspektrum sowie einigen morphologischen Merkmalen unterscheiden. Hierbei spielen insbesondere die Ausgestaltung des Ligamentsackes, die Lage der Hauptkanäle des Lakunensystems sowie die Anzahl der Zementdrüsen beim Männchen eine wesentliche Rolle, außerdem werden der Aufbau der Eischalen, die Merkmale des Lebenszyklus (Zwischen- und Endwirte) sowie molekularbiologische Merkmale für die Einteilung zugrunde gelegt.[10][11] All diese Merkmale legen nahe, dass es sich bei den drei Klassen um monophyletische Gruppen handelt:
Bedeutung für den Menschen
Als Parasit des Menschen
Als Parasit für den Menschen kommt den Kratzwürmern nur eine sehr unbedeutende Rolle zu. Der Mensch kommt zwar prinzipiell als Endwirt für den Riesenkratzer sowie für einige kleinere Arten in Frage, die Infektion ist allerdings extrem unwahrscheinlich und damit sehr selten. So wäre der normale Weg, sich mit dem Cystacanthus des Riesenkratzers anzustecken, der Verzehr einer infizierten Käferlarve. Aus dem Iran wurde 2007 beispielsweise der Fall eines Kleinkindes bekannt, das sich mit dem Kratzer Moniliformis moniliformis infizierte, nachdem es Dreck sowie eine Schabe in den Mund genommen hatte.[12]
Nach Mehlhorn & Piekarski 2002 können in Ländern, in denen Insekten als Nahrung genutzt werden, die Infektionen mit Riesenkratzern regional sehr hoch sein. So soll es in manchen Regionen Chinas mehr Darmoperationen zur Entfernung von Riesenkratzern als zur Behandlung von Blinddarmentzündungen geben.[2]
Wirtschaftliche Bedeutung als Haus- und Nutztierparasit
Die Macracanthorhynchose des Hausschweines ist vor allem in Ländern und Regionen anzutreffen, in denen Schweine in offener Weidehaltung gehalten werden. In den meisten Regionen Mitteleuropas, in denen Schweinehaltung heute als intensive Stallhaltung betrieben wird, kommt sie dagegen nicht vor. International ist die Macracanthorhynchose eine relativ häufig anzutreffende Parasitose.
Acanthocephalosen spielen dagegen in der Wassergeflügelzucht und der Fischzucht sowie dem Fischfang eine sehr große Rolle, da Kratzwürmer bei diesen Tieren sehr häufig vorkommen können. Einzelne Enten können dabei von bis zu 150 Würmern befallen sein; Ein solcher Befall führt zu starken Verletzungen der Darmschleimhaut und resultiert in Durchfall und massiven Darmblutungen.
In der Fischzucht führt ein starker Befall mit Kratzern zu Wachstumsstörungen und anderen Beschwerden der Zuchttiere. Kratzwürmer mit weit in die Muskelschicht eindringendem Rüssel können bereits an der Darmaußenseite durch die Bindegewebskapseln erkannt werden. Bei starkem Befall kommt es bei einigen Fischen zu einem Hervortreten der Augen, so vor allem bei Forellenfischen mit starkem Befall mit Echinorhynchis truttae. Im Fall einer akuten Bauchfellentzündung ist eine Behandlung nicht mehr möglich.
In zoologischen Gärten kam es vor allem in den 1960er bis 1980er Jahren sehr häufig zu Infektionen von Primaten durch Kratzwürmer, vor allem durch Moniliformis moniliformis und Prosthenorchis elegans. Dabei spielte der Übertragungsweg über Schaben eine große Rolle, die in den Gehegen der Tiere sehr häufig zu finden sind. Über strengere Hygienevorschriften ist diese Häufung seit den 1990er Jahren stark zurückgegangen, aber auch heute noch sterben regelmäßig Primaten an einer durch Kratzer hervorgerufenen Bauchfellentzündung.[2]
Behandlung und Prävention
Eine gezielte Behandlung durch chemische Präparate beim Riesenkratzer ist kaum etabliert und im Regelfall auch nicht notwendig, da dieser weder wirtschaftliche noch veterinärmedizinische Konsequenzen hat. Im Fall eines starken Befalls bei Jungschweinen können verschiedene Wirkstoffe eingesetzt werden, darunter vor allem Mehrfachbehandlungen mit makrocyclischen Laktonen wie Ivermectin, bei dem für eine siebentägige Behandlung ein Abgang von 86 bis 100 % der Kratzwürmer nachgewiesen ist. Als präventive Maßnahmen können vor allem die Reduzierung der Zwischenwirte sowie die Verlagerung der Haltung von der Weidehaltung auf die Stallhaltung benannt werden; beide haben dazu geführt, dass in Mitteleuropa der Befall mit dem Riesenkratzer stark zurückgegangen ist und heute als nicht mehr existent angesehen wird.
Bei Geflügel werden Mittel wie Fenbendazol als wirksam eingestuft, die ebenfalls vor allem eine Lösung der Kratzer bewirken sollen. Auch hier ist die Stallhaltung und die kontrollierte Wassergabe eine effektive Prävention.
Die Diagnose der Acanthocephalose der Fische erfolgt bei den befallenen Fischen im Regelfall erst nach deren Tötung durch eine gründliche Inspektion des Darmes. Bei Massenbefall in der Teichwirtschaft werden vor allem in der Forellenzucht Medikamente in das Trockenfutter gemischt, die die Kratzwürmer austreiben sollen. Dabei handelt es sich um Di-n-butylzinnoxid, welches über mehrere Tage über das Futter gegeben wird. Präventiv können befallene Fische abgefischt werden, um den Parasitenbefall zu mindern. Außerdem werden sehr stark befallene Gewässer trockengelegt und gekalkt, um die Zwischenwirte und damit die Larven der Parasiten abzutöten.
Bleianzeiger im Wasser
Durch ihre parasitische Lebensweise in Fischen akkumulieren Kratzwürmer und andere Endoparasiten limnischer und mariner Fische vor allem Schwermetalle sehr viel intensiver als ihre Wirte. Aus diesem Grunde werden die in den Fischen lebenden Kratzwürmer vor allem als Anzeiger für den Bleigehalt in Gewässern untersucht.[13]
Einzelnachweise
Die Informationen dieses Artikels entstammen zum größten Teil den unter Literatur angegebenen Quellen, darüber hinaus werden folgende Quellen zitiert:
- Der gesamte Abschnitt basiert vor allem auf Lorenzen 1996 sowie dem Artikel Acanthocephala in Mehlhorn 2001
- nach Mehlhorn & Piekarski 2002
- Der gesamte Abschnitt basiert vor allem auf dem Artikel Acanthor in Mehlhorn 2001
- Der gesamte Abschnitt basiert vor allem auf dem Artikel Acanthella in Mehlhorn 2001
- Der gesamte Abschnitt basiert vor allem auf dem Artikel Cystacanth in Mehlhorn 2001
- L.R. Smales, P. Sasal, H. Taraschewski: Acanthocephalus reunionensis n sp (Acanthocephala: Echinorhynchidae), a parasite of Anguilla species (Anguillidae) from Reunion Island. Parasite 14 (2), 2007: S. 131–134 (Abstract)
- V.L: Olmos, E.M. Habit: A new species of Pomphorhynchus (Acanthocephala: Palaeacanthocephala) in freshwater fishes from central Chile. Journal of Parasitology 93 (1), 2007: S. 179–183 (Abstract)
- James R. Garey, Thomas J. Near, Michael R. Nonnemacher1, Steven A. Nadler: Molecular evidence for Acanthocephala as a subtaxon of Rotifera. Journal of Molecular Evolution 43 (3), 1996; S. 287–292 (doi:10.1007/BF02338837)
- Martín García-Varela, Gerardo Pérez-Ponce de León, Patricia de la Torre, Michael P. Cummings, S.S.S. Sarma, Juan P. Laclette: Phylogenetic Relationships of Acanthocephala Based on Analysis of 18S Ribosomal RNA Gene Sequences. Journal of Molecular Evolution 50 (6), 2000; S. 532–540 (doi:10.1007/s002390010056)
- Thomas J. Near: Acanthocephalan Phylogeny and the Evolution of Parasitism. Integrative and Comparative Biology 42, 2002; S. 668–677. (Volltext; PDF; 236 kB)
- Phylogenetic Relationships of the Acanthocephala Inferred from 18S Ribosomal DNA Sequences. Molecular Phylogenetics and Evolution 10 (3), 1998; S. 287–298. (Volltext (Memento des Originals vom 23. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.)
- F. Berenji, A. Fata, Z. Hosseininejad: A case of Moniliformis moniliformis (Acanthocephala) infection in Iran. Korean Journal of Parasitology 45 (2), 2007: S. 145–148 (Abstract)
- Experimental Studies on Lead Accumulation in the Eel-Specific Endoparasites Anguillicola crassus (Nematoda) and Paratenuisentis ambiguus (Acanthocephala) as Compared with their Host, Anguilla anguilla. Archives of Environmental Contamination and Toxicology 37 (2), 1999; S. 190–195 (doi:10.1007/s002449900505)
Literatur
- Holger Herlyn: Zur Ultrastruktur, Morphologie und Phylogenie der Acanthocephala, Logos Verlag, Berlin 2000, ISBN 3-89722-439-9.
- Sievert Lorenzen: Acanthocephala, Kratzer in: Wilfried Westheide, Reinhard Rieger: Spezielle Zoologie. Teil 1: Einzeller und wirbellose Tiere. Gustav Fischer Verlag, Stuttgart und Jena 1996; S. 723–728, ISBN 3-437-20515-3.
- Heinz Mehlhorn: Grundriss der Parasitenkunde Spektrum Akademischer Verlag, Berlin, Heidelberg 2002; S. 277–284, ISBN 3-8274-1158-0.
- Artikel Acanthocephala, Acanthella, Acanthor und Cystacanth in: Heinz Mehlhorn: Encyclopedic Reference of Parasitology. Biology, Structure, Function Springer Verlag, Berlin, Heidelberg, New York 2001, ISBN 3-540-66239-1.
- Artikel Acanthocephalacidal Drugs und Acanthocephalan Infections in: Heinz Mehlhorn: Encyclopedic Reference of Parasitology. Diseases, Treatment, Therapy Springer Verlag, Berlin, Heidelberg, New York 2001; S. 1–13, ISBN 3-540-66239-1.
- Warwick L. Nicholas: The Biology of Acanthocephala. Advances in Parasitology 11, 1973; S. 671–706.
- Horst Taraschewski: Host-Parasite Interactions in Acanthocephala: a Morphological Approach. Advances in Parasitology 46, 2000; S. 1–179.