Metastase
Als Metastase (altgriechisch μετάστασις metástasis, „Wanderung, Verlagerung“)[1][2] wird in der Medizin die Absiedelung eines krankhaften Geschehens in einem vom Ursprungsherd der Krankheit entfernten Körperteil bezeichnet.[3] Meistens erfolgt eine solche Verschleppung, etwa von Tumorzellen („Geschwulstkeimen“), über das Blut oder die Lymphe im Zusammenhang mit einer Krebserkrankung.
- In der Onkologie wird die Absiedelung eines bösartigen soliden Tumors in entferntem Gewebe als Metastase (auch Geschwulstmetastase) bezeichnet. Man spricht auch von einer Tochtergeschwulst oder Filia, Plural Filiae (lat. filia bedeutet „Tochter“). Bei bösartigen Erkrankungen des Blutes und Lymphsystems (Maligne Lymphome) spricht man nicht von Metastasen, da die Krebszellen aus Immunzellen hervorgehen, die kein Gewebe bilden und von Natur aus mobil sind. Man bezeichnet daher die verschiedenen Ansammlungen von Lymphom-Zellen als Manifestationen, weil sich die Krebserkrankung dort zeigt.
- Seltener wird die Bezeichnung Metastase auch für die septische Streuung von Krankheitserregern benutzt, also für die Absiedelung von einem Infektionsherd bei einer Infektionserkrankung. Beispiel: die Streuung einer Endokarditis in zahlreiche Organe.
| Klassifikation nach ICD-10 | |
|---|---|
| C77 | Sekundäre und nicht näher bezeichnete bösartige Neubildung der Lymphknoten |
| C78 | Sekundäre bösartige Neubildung der Atmungs- und Verdauungsorgane |
| C79 | Sekundäre bösartige Neubildung an sonstigen Lokalisationen |
| ICD-10 online (WHO-Version 2019) | |
Hier wird nur der Begriff Metastase im engeren Sinne von Geschwulstmetastase behandelt.
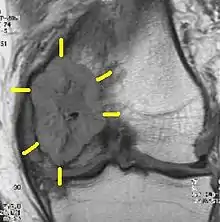
Bedeutung
Die Fähigkeit eines Tumors zur Metastasierung (Bildung von Metastasen) verschlechtert die Heilungschancen einer Krebserkrankung erheblich. Schon sehr kleine Tumoren können metastasieren, z. B. ein Brustkrebs von einem Zentimeter Durchmesser in 20 % aller Fälle. Durchschnittlich werden bei 30 % aller Patienten mit Malignomen Metastasen schon bei der Erstdiagnose festgestellt. Bei weiteren 30 % findet man sie erst im weiteren Behandlungsverlauf. Bei Vorliegen von sichtbaren Fernmetastasen sind in der Regel zahlreiche Mikrometastasen vorhanden, was die Prognose erheblich verschlechtert.
Entstehung
Metastasen entstehen, indem sich Krebszellen vom ursprünglichen Tumor ablösen, mit dem Blut oder mit der Lymphe wandern und sich in anderen Körperteilen wieder ansiedeln und vermehren. Je nach dem Ausbreitungsweg heißen sie hämatogene (Blut) oder lymphogene (Lymphe) Metastasen. Ob Krebszellen metastasieren, hängt nach neuesten Forschungsergebnissen von ihrer Fähigkeit ab, embryonale Transkriptionsfaktoren einzuleiten.[4]
Invasion
Voraussetzung für die Metastasierung ist, dass der Krebs invasiv wächst, d. h. in angrenzende Strukturen hinein mit Durchbruch in Blut- oder Lymphgefäße. Gutartige Tumoren metastasieren definitionsgemäß niemals. Aber auch nicht jeder invasiv wachsende Tumor verursacht Metastasen. Wenn ein solcher Tumor keine Metastasen bildet, bezeichnet man ihn als semimaligne („halb bösartig“). Dies ist beispielsweise bei Basalzellenkrebs der Fall.
Solange ein Tumor keine Metastasen bildet, bezieht sich der Begriff Invasion auf sein Wachstum in umgebendes Gewebe hinein. Normalerweise wird in diesem Sinne zwischen Invasion und Metastasierung (Metastasenbildung) unterschieden. Man kann aber auch das Eindringen der Metastasen in andere Regionen des Körpers als Invasion bezeichnen und den Begriff in diesem Sinne weiter fassen.
Die Fähigkeit, körpereigene Sperren wie die Basalmembran oder die Blut-Hirn-Schranke zu durchdringen, ein Blut- oder Lymphgefäß aktiv aufzusuchen (Chemotaxis), in das Gefäß einzudringen, sich während der Wanderung im Blut gegen das körpereigene Immunsystem zu wehren, andernorts das Gefäß zu verlassen und sich schließlich zu vermehren, wird als Invasivität bezeichnet. Sie ist eine aktive Leistung maligner Krebszellen, und zwar abhängig von den jeweiligen genetischen Besonderheiten des individuellen Tumors. Nur etwa 0,01 % aller im Blut zirkulierenden Krebszellen schaffen es schließlich, eine metastatische Kolonie zu bilden.[5]
Die biochemischen Vorgänge, die bestimmte Zellen zur Metastasierung befähigen und andere nicht, sind Gegenstand intensiver Forschung. Es konnte z. B. gezeigt werden, dass die verminderte Expression von Cadherinen („Klebemolekülen“) auf ihrer Zellmembran die Tumorzellen beweglicher macht. Für die Anheftung der Zellen im Zielgebiet sollen andere Membranstrukturen, die sogenannten Integrine, eine Rolle spielen. Es sind bereits Onkogene und Tumorsuppressorgene identifiziert worden, deren Expression die Metastasierungstendenz erhöhen bzw. senken kann.
Darüber hinaus zeigen erste Untersuchungen, dass die in Palmöl enthaltene Palmitinsäure die Metastasierung fördern kann. Auch besitzen metastasierte Krebszellen spezielle Fettrezeptoren, um sich abseits des Tumors mit Nahrung versorgen zu können. Dies konnte für Eierstock-, Blasen – und Lungenkrebs nachgewiesen werden. Es sind jedoch noch klinische Studien nötig, um letztendlich sagen zu können, dass auch eine palmitinsäurearme Ernährung den Metastasierungsprozess verlangsamt.[6][7][8]
Passiv (etwa durch Biopsienadeln) abgelöste und verschleppte Tumorzellen verursachen nur sehr selten Metastasen.
Im Blut zirkulierende Krebszellen
Neuere Diagnoseverfahren wie die Liquid Biopsy belegen die Wichtigkeit der zirkulierenden Tumorzellen epithelialen Ursprungs (CETC, circulating epithelial tumor cells). In der adjuvanten Situation, das heißt nach der operativen Entfernung des Primärtumors, werden verschiedene Chemotherapieverfahren eingesetzt, um die restlichen im Körper verbliebenen und im Blut zirkulierenden Tumorzellen zu vernichten. Im Jahr 2005 zeigten Gianni Bonadonna und Kollegen, dass ca. 50 % der Chemotherapien zu keinen wesentlich erhöhten Lebensverlängerungen bei den Patienten geführt haben.[9] Dieses Ergebnis kann darauf zurückgeführt werden, dass bei der Auswahl der Chemotherapeutika auf eine Biopsie des Primärtumors zurückgegriffen wird. Einige Wissenschaftler nehmen mittlerweile an, dass die Auswahl der nach den S3-Leitlinien zur Verfügung stehenden Therapeutika mittels Chemosensitivitätstests (In-vitro-Bluttests, bei denen die Absterberate der Tumorzellen unter Zugabe der Therapeutika in einer Blutprobe vor Verabreichung getestet werden) die Wirkungswahrscheinlichkeit der Therapeutika stark verbessern könnte.[10]
Organotropie
Der erste Zielort für Metastasen liegt in der Regel stromabwärts, also für Tumoren der Körperwand und Extremitäten in der Lunge und im Gehirn, für Tumoren des Darmes in der Leber (denn das vom Darm kommende Blut fließt zunächst in die Leber und dann erst zum Herzen zurück). Die Lymphgefäße führen zu Lymphknoten, die meist in räumlicher Nähe zum Tumor liegen, für den Brustkrebs z. B. in der Achselhöhle. Es ist aber durchaus möglich, dass ein erster Zielort übersprungen wird. Manche Tumorarten metastasieren in ganz spezifische Organe, etwa Lungenkrebs in die Nebennieren, offenbar infolge von Oberflächeneigenschaften der Krebszellen. Dieser Zielmechanismus (Organotropie, homing tumors) ist noch nicht völlig verstanden.
Knochenabbau und Angiogenese
Bei osteoklastischen Knochenmetastasen beeinflussen die Tumorzellen die körpereigenen Osteoklasten so, dass diese vermehrt Knochenhartsubstanz abbauen, um das weitere Wachstum der Metastase zu ermöglichen.[11] Nach heutigem Wissensstand sind metastasierende Krebszellen im Gegensatz zu anderen Zellen außerdem dazu in der Lage, umgebende Blutgefäße zum Aussprossen zu veranlassen (Angiogenese). Nur deswegen kann die neue Metastase mit Blut versorgt werden. Tumoren ohne angiogenetische Fähigkeit werden nicht größer als 0,3 mm.[12]
Einteilung von Metastasen
Man unterscheidet gemäß der TNM-Klassifikation lokale Metastasen, regionäre Metastasen und Fernmetastasen:
- Lokale Metastasen entstehen in unmittelbarer Nähe des Primärtumors durch Verschleppung von bösartigen Tumorzellen in das umgebende Gewebe, auch über Organgrenzen hinweg. Solche durch direkten Kontakt mit dem Tumor entstehenden Metastasen werden auch als Kontakt- oder Abklatschmetastasen bezeichnet. Diese Verschleppung kann auch über Stichkanäle oder Schnitte in Tumorgewebe begünstigt werden, man spricht dann von Impfmetastasen.
- Regionäre Metastasen entstehen in der Regel, wenn Tumorzellverbände in die Lymphgefäße abschilfern und sich in den organ- und lagespezifischen Lymphknoten festsetzen. Die Erfassung von regionären Lymphknotenmetastasen erfolgt in der TNM-Klassifikation durch die N-Kategorie. Bei regionären Lymphknotenmetastasen spricht man auch von lymphogenen Metastasen.
- Fernmetastasen entstehen analog dazu, wenn Tumorzellverbände in Venen abschilfern und in entfernten Organen absiedeln oder durch Abtropfung oder Abklatschung von Tumorzellen in Körperhöhlen. Klassisches Beispiel für eine Abtropfmetastase ist der Krukenberg-Tumor eines Siegelringkarzinoms des Magens mit zumeist beidseitigen Fernmetastasen an den Ovarien. Fernmetastasen über den Blutweg werden hämatogene Metastasen genannt. Die Erfassung von Fernmetastasen erfolgt in der TNM-Klassifikationen durch die M-Kategorie.
Je nach Lokalisation und histologischem Typ metastasieren maligne Tumoren in unterschiedlichem Maße lymphogen und hämatogen. Lymphogene Metastasierung kann durch den Wachstumsfaktor VEGF-C vermittelt werden[13]. Auch die Lokalisation von Fernmetastasen ist in großem Maße abhängig von Histologie und Lokalisation des Primärtumors. Nach dem gegenwärtigen Kenntnisstand können Fernmetastasen selbst keine Metastasen bilden. Sie entstehen offensichtlich ausschließlich aus Zellen des Primärtumors.[14][15][16]
Ist ein ganzes Organ, beziehungsweise eine Körperhöhle diffus von Tumorzellen durchsetzt, bezeichnet man dies als Karzinose (oder Karzinomatose). Beispiel: Bauchfellkarzinose bei Darmkrebs.
Lokalisation von Fernmetastasen
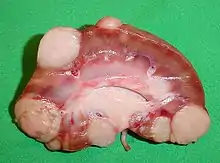
Verschiedene Organe haben verschiedene bevorzugte Lokalisationen der Fernmetastasen. In der Regel wird dabei der Pfortader- vom Cava-Typ unterschieden.
- Zum Pfortadertyp zählen die malignen Tumoren der Organe des Verdauungstrakts (untere Speiseröhre, Magen, Bauchspeicheldrüse, Dünn- und Dickdarm, oberer Mastdarm), welche bevorzugt in die Leber metastasieren, weil ihr venöses Blut über die Pfortader erst in die Leber und dann in die Vena cava inferior gelangt. Alternativ können lymphogene und Abklatschmetastasen am Peritoneum vorkommen. Das Maximalbild zahlreicher Peritonealmetastasen wird Peritonealkarzinose genannt. Streng genommen handelt es sich dabei nur um Metastasen eines Karzinoms, die allerdings die weitaus größte Gruppe maligner gastrointestinaler Tumoren ausmachen. Beim Pfortadertyp können Metastasen auch in denselben Organen vorkommen wie beim Cava-Typ (siehe unten). Es handelt sich dann in der Regel um sekundäre Metastasen, die von einer Lebermetastase ausgehen und nicht vom Primärtumor.
- Die meisten anderen Krebsarten gehören zum Cava-Typ. Sie metastasieren am ehesten in Skelett, Gehirn und Lunge, aber auch in die Leber und Milz.
Einige Tumoren haben ihren ersten Metastasierungsort typischerweise im Knochen, so Prostata (Lendenwirbel- und Beckenbereich), Brustdrüse (Wirbelsäule), Nieren.
Verschiedene Tumoren metastasieren auch häufig in die Haut, es handelt sich dabei vor allem um Metastasen des malignen Melanoms sowie anderer Hauttumoren. Auch Lymphome befallen häufig die Haut, allerdings bezeichnet man diesen Befall durch eine Systemerkrankung nicht als Metastase.
Fast niemals von Metastasen betroffen sind Herz[17], Milz[18] und Nieren.[19] Das ist eine erstaunliche Tatsache, weil diese Organe einen hohen Blutdurchfluss haben. Warum sie seltener befallen werden, ist nicht sicher geklärt. Ebenfalls eher selten sind Metastasen in anderen Organen wie Bauchspeicheldrüse, Magen, Darm (außer durch lokales Wachstum), Schilddrüse, Thymus und Nebenniere.
Untersuchungsmethoden
Bei Krebserkrankungen werden neben dem Primärtumor in der Regel die Lymphknoten der Abflussbahn und „suspekte“ Lymphknoten aus der vorhergehenden Diagnostik (körperliche Untersuchung, Computertomografie, Magnetresonanztomografie) mit entnommen und histopathologisch auf regionäre Metastasen untersucht. Bei unklarer Lymphabflussbahn, z. B. bei Hauttumoren, wird über das Einspritzen radioaktiv markierter Farbe der Sentinel-Knoten („Wächterknoten“) mittels Geigerzähler und Farbmarkierung operativ aufgesucht. Lymphknotenmetastasen verschlechtern die Prognose und führen bei kurativem Ansatz zu einer aggressiveren Therapie.
Zur Lokalisation von Fernmetastasen werden bei gesichertem Primärtumor im Sinne eines Stagings routinemäßig folgende Untersuchungen veranlasst:
- Skelettszintigrafie zum Auffinden von osteoklastischen oder osteoblastischen Knochenmetastasen. Osteoklastische Metastasen zerstören Knochengewebe, osteoblastische regen über Zytokine ein lokales Knochenwachstum an (z. B. bei Prostatakarzinomen und Osteosarkomen).
- Computertomografie oder Magnetresonanztomografie der Bauch-, Thorax- und Schädelhöhle zum Auffinden von Leber-, Peritoneal-, Lungen- und Hirnmetastasen. Bei gastrointestinalen Tumoren wird dabei gleichzeitig der Befall lokoregionärer Lymphknoten im Bauchraum, bei Lungenkrebs der lokoregionären Lymphknoten im Brustraum untersucht.
- Lebersonografie zur Suche nach Lebermetastasen.
Bei HNO-Tumoren gehört daneben zur Metastasensuche die Panendoskopie. Bei gynäkologischen und urologischen Tumoren ist ein lokoregionäres Tumorwachstum in umliegende Organe besonders häufig, deshalb ist die wichtigste Staginguntersuchung die Computertomografie des kleinen Beckens.
Siehe auch
Literatur
- Pschyrembel (Medizinisches Wörterbuch): Stichworte Metastase und Metastasierung.
Weblinks
- Bildbeispiel einer Metastase in der Brustwirbelsäule
- Bildbeispiel einer Metastasenleber
- Wie Tumoren Metastasen den Boden bereiten. wissenschaft.de; Beitrag über einen Nature-Artikel (Band 438, S. 820vo, 2005)
- Rainer Flöhl: Ein Dogma der Krebsmedizin fällt. FAZ.net, 7. Februar 2009
Einzelnachweise
- Metastase. Duden online
- Jutta Kollesch, Diethard Nickel: Antike Heilkunst. Ausgewählte Texte aus dem medizinischen Schrifttum der Griechen und Römer. Philipp Reclam jun., Leipzig 1979 (= Reclams Universal-Bibliothek. Band 771); 6. Auflage ebenda 1989, ISBN 3-379-00411-1, S. 11, Anm. 11 (zu Rufus von Ephesos: Die Fragen des Arztes an den Kranken).
- Otto Dornblüth: Wörterbuch der klinischen Kunstausdrücke. 1. Auflage, Verlag von Veit & Comp., Leipzig 1894, S. 79 f.
- Katherine Bourzac Die Entstehung von Krebs ist kein Mysterium mehr. Technology Review Online (Deutschland), Interview mit Robert Weinberg; abgerufen am 23. November 2007.
- Tumor-Host and Tumor-Stromal Interactions.
- Palmitic acid promotes cancer metastasis and leaves a more aggressive “memory” in tumour cells. Abgerufen am 12. November 2021 (englisch).
- Gloria Pascual, Diana Domínguez, Marc Elosúa-Bayes, Felipe Beckedorff, Carmelo Laudanna: Dietary palmitic acid promotes a prometastatic memory via Schwann cells. In: Nature. 10. November 2021, ISSN 1476-4687, S. 1–6, doi:10.1038/s41586-021-04075-0 (nature.com [abgerufen am 12. November 2021]).
- https://www.dw.com/de/palm%C3%B6l-f%C3%B6rdert-die-ausbreitung-von-krebs/a-59790030?maca=de-rss-de-wissenschaft-4019-xml-mrss
- G. Bonadonna, A. Moliterni u. a.: 30 years’ follow up of randomised studies of adjuvant CMF in operable breast cancer: cohort study. In: BMJ (Clinical research ed.). Band 330, Nummer 7485, Januar 2005, S. 217, ISSN 1756-1833. doi:10.1136/bmj.38314.622095.8F. PMID 15649903. PMC 546063 (freier Volltext).
- K. Hekimian, S. Meisezahl u. a.: Epithelial cell dissemination and readhesion: analysis of factors contributing to metastasis formation in breast cancer. In: ISRN oncology. Band 2012, 2012, S. 601810, ISSN 2090-567X. doi:10.5402/2012/601810. PMID 22530147. PMC 3317055 (freier Volltext).
- P. Köhler: Strahlentherapie von Knochenmetastasen. (Memento vom 31. März 2010 im Internet Archive) (PDF; 606 kB) 4, 2005, abgerufen am 17. Juni 2011.
- L. A. Liotta, E. C. Kohn: Cancer Medicine. 6. Ausgabe, Kapitel 8: Invasion and Metastases.
- E. V. Sugarbaker, A. M. Cohen, A. S. Ketcham: Do metastases metastasize? In: Nature Medicine. Band 7, Nummer 2, 2001, S. 192–198, ISSN 1078-8956. PMID 11175850.
- D. Hölzel, R. Eckel u. a.: Distant metastases do not metastasize. In: Cancer Metastasis Reviews. Band 29, Nummer 4, Dezember 2010, S. 737–750, ISSN 1573-7233. doi:10.1007/s10555-010-9260-1. PMID 20878451. (Review).
- E. V. Sugarbaker, A. M. Cohen, A. S. Ketcham: Do metastases metastasize? In: Annals of Surgery. Band 174, Nummer 2, August 1971, S. 161–166, ISSN 0003-4932. PMID 5560840. PMC 1397464 (freier Volltext).
- C. R. Tait, D. Dodwell, K. Horgan: Do metastases metastasize? In: The Journal of Pathology. Band 203, Nummer 1, Mai 2004, S. 515–518, ISSN 0022-3417. doi:10.1002/path.1544. PMID 15095473. (Review).
- D. Giuffrida, H. Gharib: Cardiac metastasis from primary anaplastic thyroid carcinoma: report of three cases and a review of the literature. In: Endocrine-Related Cancer Band 8, Nummer 1, März 2001, S. 71–73, ISSN 1351-0088. PMID 11350728. (Review).
- V. Genç, M. Akbari, A. S. Karaca, A. Çakmak, u. a.: Why is isolated spleen metastasis a rare entity? In: The Turkish journal of gastroenterology: the official journal of Turkish Society of Gastroenterology Band 21, Nummer 4, Dezember 2010, S. 452–453, ISSN 1300-4948. PMID 21332003.
- M. Aron, M. Nair, A. K. Hemal: Renal metastasis from primary hepatocellular carcinoma. A case report and review of the literature. In: Urologia internationalis Band 73, Nummer 1, 2004, S. 89–91, ISSN 0042-1138. doi:10.1159/000078812. PMID 15263801. (Review).