Phenothiazine
Als Phenothiazine wird eine Untergruppe der Thiazine bezeichnet, bei welcher der zentrale, Stickstoff- und Schwefel-haltige Thiazin-Ring zwei anellierte Benzol-Ringe trägt. Viele werden als Arzneistoffe, Farbstoffe, und Insektizide eingesetzt.[1] Die medikamentös wirksamen Phenothiazine besitzen strukturchemische Gemeinsamkeiten mit dem ersten überhaupt entdeckten Neuroleptikum – dem Chlorpromazin. Alle Phenothiazine besitzen ein räumlich annähernd planares Dreiringsystem, das genau genommen für sich allein (ohne Substituenten) den Namen Phenothiazin trägt.
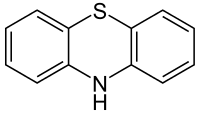
In der Chemie und Pharmakologie gehören alle daraus durch Abwandlung einzelner Molekülteile (v. a. mittels Substitution) abgeleiteten Derivate zur Gruppe der Phenothiazine.
Eigenschaften und Einteilung
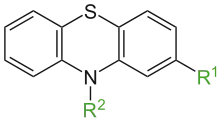
Phenothiazine sind oxidationsempfindliche, wenig wasserlösliche Substanzen, die sich unter Einwirkung von Luft und Licht – gefördert durch Schwermetall-Ionen – leicht in Lösung unter Verfärbung zersetzen.[1] Die neben (unsubstituiertem) Phenothiazin zur Gruppe der Phenothiazine zählenden substituierten Derivate können nach Strukturmerkmalen weiter unterteilt werden in solche vom Chlorpromazin-, Pecazin- und Perphenazin-Typ; außerdem stehen die Azaphenothiazine sowie die Thioxanthene den Phenothiazinen nahe:
Chlorpromazin-Typ
Hierzu gehören die Stoffe mit offener Seitenkette an R2:
Die Vertreter des Chlorpromazintyps sind eher schwach antipsychotisch wirksam (nieder- bis mittelpotente Neuroleptika).
Pecazin-Typ
Hierzu gehören Substanzen mit Piperidinylalkyl-Seitenkette an R2.
In Deutschland ist nur noch das schwach potente Thioridazin im Handel. Der Hersteller Novartis nahm dieses Neuroleptikum Ende Juni 2005 weltweit vom Markt, weil das Risiko für schwerwiegende unerwünschte Wirkungen stärker als bei anderen Neuroleptika schien.[2]
Perphenazin-Typ
Dies sind Phenothiazine mit einer Piperazinylalkyl-Seitenkette an R2:
- Perazin,
- Perphenazin, und
- Fluphenazin.
Sie wirken im Vergleich mit Chlorpromazin mindestens gleich stark, eher stärker antipsychotisch.
Azaphenothiazine
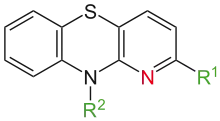
Diese besitzen ein Aza-analoges Ringsystem und wirken gleichartig wie die vorgenannten Stoffe. Einziger Vertreter dieser Subgruppe ist das Prothipendyl.
Thioxanthene
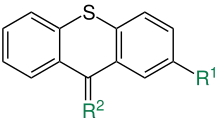
Sie sind den eigentlichen Phenothiazinen ebenfalls sehr ähnlich, nur wird deren Drei-Ring-Grundgerüst durch Thioxanthen gebildet.
Wichtige Vertreter sind
Sie unterscheiden sich gleichfalls an R2:
Chlorprothixen hat eine offene, Flupentixol und Zuclopenthixol haben eine Piperazinylalkyl-Seitenkette.
Herstellung
Unsubstituiertes Phenothiazin wird technisch durch katalysierte Umsetzung von Diphenylamin mit 2 Äquivalenten Schwefel als Oxidationsmittel in der Schmelze hergestellt. Dabei entsteht Phenothiazin und als Reduktionsprodukt Schwefelwasserstoff, welches gasförmig abgeführt wird. Das verbleibende Phenothiazin wird durch Vakuumdestillation gereinigt.
- (C6H5)2NH + 2 S → C12H9NS + H2S
Seine Derivate lassen sich auf ähnlichem Wege aus p-Diaminen oder Aminothiophenolen und Schwefel darstellen.[3][4]
Anwendungsgebiete
Sie werden medizinisch eingesetzt als
- Neuroleptika (Mittel gegen Psychosen)
- Sedativa (Beruhigungsmittel)
- Antihistaminika (Mittel gegen allergische Reaktionen)
- Antiemetika/Antivertiginosa (Mittel gegen Brechreiz und Schwindel)
Die meisten Phenothiazin-Präparate kommen in der Psychiatrie bei der Behandlung von Schizophrenien (d. h. als Neuroleptika) zum Einsatz. Das niederpotente Promethazin wird häufig gegen Angst- und Erregungszustände verwendet und hat sich dafür seit Jahrzehnten bewährt.
Wirkung
Die Phenothiazine insgesamt wirken unspezifischer, mit einem breiteren Spektrum als die Butyrophenone oder andere Klassen von Neuroleptika. Sie blockieren oft eine ganze Reihe von Rezeptoren für Neurotransmitter, unter anderem D2-, α1-, 5HT2A-, H1- und M1-Rezeptoren,[5] wodurch
- Sedation und antipsychotische Wirkung,
- antiemetische,
- lokalanästhetische,
- ganglienblockierende,
- anti-adrenerge,
- anticholinerge und
- antihistaminische
Effekte entstehen können.
Unerwünschte Wirkungen
Die Nebenwirkungen der Phenothiazine ergeben sich aus dem vergleichsweise breiten Wirkspektrum (siehe bei Wirkung).
Die hochpotenten Stoffe können durch ihre Dopamin-Rezeptor-Blockade ähnliche Motorikstörungen auslösen wie die starken Butyrophenone: Diese extrapyramidal-motorischen Störungen (EPMS) umfassen Früh- und Spätdyskinesien, Akathisien und parkinsonähnliche Symptome.
Einige Phenothiazine (v. a. des Chlorpromazin-Typs) können Störungen der Wärmeregulation verursachen.
Einige Phenothiazine können ein Long-QT-Syndrom verursachen und damit zu tödlichen Herzrhythmusstörungen führen.
Geschichte
Die Geschichte der Phenothiazine geht zurück bis an die Anfänge der organischen Chemie in der Mitte des 19. Jahrhunderts. 1865 stellte August Kekulé die Theorie auf, dass die Kohlenstoff-Atome in organischen Substanzen in Ringsystemen (Benzolring) auftreten. Praktische Bedeutung hatte diese Erkenntnis vor allem in der Farbenindustrie. 1876 wurden die beiden Farbstoffe Methylenblau und Thionin (Lauths Violett) hergestellt, die beide die Phenothiazinstruktur enthalten. In den nächsten Jahren wurde Methylenblau als Mittel gegen Malaria, Kopfschmerzen oder Depressionen versucht, konnte sich jedoch nicht durchsetzen. In der ersten Hälfte des 20. Jahrhunderts wurde es still um die Phenothiazine. In der Tiermedizin wurden sie als Wurmmittel eingesetzt, für den Menschen galten sie in höheren Dosierungen als zu toxisch. Erst in den 1940er Jahren begann sich die medizinische Forschung wieder vermehrt den Phenothiazinen zuzuwenden. Die französische Pharmafirma Rhône-Poulenc entdeckte Phenothiazine mit antihistaminischen Eigenschaften. Dies führte 1950 zur Synthese von Neuroleptika (Chlorpromazin).[6]
Siehe auch
Butyrophenone, Diphenylbutylpiperidine, Benzamide, Atypische Neuroleptika
Einzelnachweise
- Wissenschaft-Online-Lexika: Phenothiazine im Lexikon der Chemie.
- THIORIDAZINE - Withdrawn due to poor benefit/risk profile, WHO Pharmaceuticals Newsletter 2005, No. 01, abgerufen am 20. November 2016.
- Otto Lange: Die Schwefelfarbstoffe ihre Herstellung und Verwendung. Springer-Verlag, 2013, ISBN 978-3-662-34052-3, S. 22 (eingeschränkte Vorschau in der Google-Buchsuche).
- Clemens Lamberth, Jürgen Dinges: Bioactive Heterocyclic Compound Classes Pharmaceuticals. John Wiley & Sons, 2012, ISBN 3-527-66447-5, S. 51 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. Schmidt (Hrsg.), begründet von C.-J. Estler: Pharmakologie und Toxikologie. Schattauer, Stuttgart und New York 2007, S. 225.
- H. Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Verlag für Wissenschaft und Bildung, Berlin 1992, S. 73–77.