Pyrrol
Pyrrol (systematischer Name nach IUPAC: Azol) ist eine organische Verbindung aus der Gruppe der Heteroaromaten und Stammsystem der Pyrrole (Azole). Aus Pyrrolringen sind beispielsweise die Porphyrine, darunter Porphin, Häm und Chlorophyll, das Vitamin B12 und deren Abbauprodukte, die Gallenfarbstoffe (Bilirubin, Urobilin) aufgebaut. Der Ursprung des Namens kommt aus dem Griechischen (pyrros = feuerrot).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
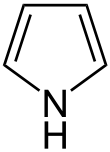 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyrrol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H5N | |||||||||||||||
| Kurzbeschreibung |
farblose, brennend schmeckende Flüssigkeit mit chloroformähnlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 67,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,97 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
131 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,5082[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
63,1 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte und Eigenschaften
Pyrrol wurde 1834 von F. F. Runge im Steinkohlenteer aufgefunden und isoliert. Später fand man es auch im Knochenteer und im Knochenöl.
In reinem Zustand ist Pyrrol eine farblose Flüssigkeit von chloroformähnlichem Geruch, die sich an der Luft mit der Zeit braun verfärbt und verharzt. Pyrroldämpfe färben einen mit Salzsäure befeuchteten Fichtenspan rot. Dies ist eine qualitative Nachweisreaktion für Pyrrol und war der historische Grund für die Benennung.
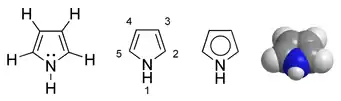
Pyrrol (genauer: 1H-Pyrrol) ist im Vergleich zu den übrigen Aminen nur sehr schwach basisch (pKb 13,6), weil das freie Elektronenpaar an der Ausbildung des aromatischen π-Elektronensextetts beteiligt ist und folglich bei Protonierung am Stickstoffatom die Aromatizität aufgehoben wird.
Dagegen kann die NH-Gruppe ohne Verlust der Aromatizität deprotoniert werden. Beispielsweise reagiert Pyrrol mit metallischem Kalium unter Wasserstoffentwicklung zu Pyrrolkalium (Kaliumpyrrolid):
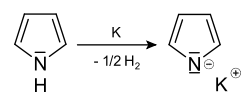
Herstellung
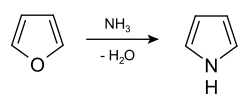
Industriell wird Pyrrol aus Furan und Ammoniak synthetisiert:
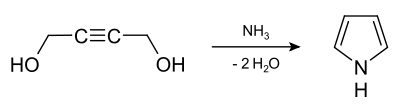
Weiterhin kann es aus Butin-1,4-diol durch Erhitzen mit Ammoniak unter Druck gewonnen werden:
Substituierte Pyrrole gewinnt man über die knorrsche Pyrrolsynthese oder über die Paal-Knorr-Synthese aus substituierten 1,4-Diketonen, die z. B. durch oxidative Dimerisierung von β-Ketoestern mit Iod erzeugt werden.
Derivate
- Tetrapyrrol
- Polypyrrol
- Jodol (Tetraiodpyrrol, C4I4NH) entsteht bei Behandlung von Pyrrol mit Kaliumiodid und bildet ein amorphes, graubraunes, geruchloses Pulver. Es ist löslich in warmem Alkohol, Äther und fetten Ölen, nicht in Wasser und zersetzt sich am Licht und bei einer Temperatur von 140 °C. Es wurde als Ersatz des Iodoforms in der Wundbehandlung empfohlen, wobei namentlich seine Geruchlosigkeit in Betracht kommt.[4] 1885 erstmals von Kalle oHG in Wiesbaden-Biebrich kommerziell hergestellt.[5]
Literatur
- V. v. Richter: Organische Chemie. Verlag Friedrich Cohen, Bonn 1913, Bd. II, S. 722 (Entdeckung)
- Beyer/Walter: Lehrbuch der organischen Chemie. 19. Auflage. Hirzel Verlag, Stuttgart 1981, S. 668 ff. (Nachweisreaktion, Synthesen, Reaktionen)
- Eicher/Hauptmann: Heterocyclic Chemistry. 2. Auflage. WILEY-VCH GmbH, Weinheim 2003, S. 86–98 (Struktur, physikalische Eigenschaften, spektroskopische Eigenschaften; chemische Eigenschaften, Synthesen; wichtige Derivate, Naturstoffe, Medikamente; Nutzen als Reagenz, Baustein, Auxiliar in der org. Synthese)
Einzelnachweise
- Eintrag zu Pyrrol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Pyrrol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Substanzbeschreibung Jodol, Herstellung (Memento vom 11. Dezember 2015 im Internet Archive) (PDF-Datei; 366 kB).
- Kalle Betriebsbeschreibung von 1952, Seite 8.