Natriumnitrit
Natriumnitrit, NaNO2, ist das Natriumsalz der Salpetrigen Säure HNO2.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
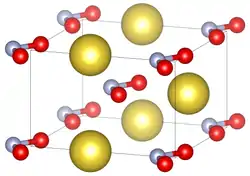 | ||||||||||||||||
| _ Na+ _ N3+ _ O2− | ||||||||||||||||
| Kristallsystem |
Orthorhombisch | |||||||||||||||
| Raumgruppe |
Im2m (Nr. 44, Stellung 3) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumnitrit | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | NaNO2 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[4] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
V03AB08 | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 68,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,17 g·cm−3[4] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
ab 320 °C (Zersetzung)[4] | |||||||||||||||
| Löslichkeit |
gut in Wasser (820 g·l−1 bei 20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen und Herstellung
In der Natur kommen Nitrite nicht in mineralischer Form vor.[7] Sie sind Zwischenstufen im Stickstoffkreislauf in biologischen Systemen. Sie entstehen sowohl bei der Nitrifikation (Stickstoffbindung) als auch bei der Denitrifikation (Stickstoff-Freisetzung).
Technisch wird Natriumnitrit durch Einwirkung von Stickoxiden auf Natriumhydroxidlösung gewonnen.[7] Anfang des 20. Jahrhunderts erfolgte die Reduktion von Natriumnitrat noch mittels Blei, Eisen, Zink, Mangandioxid, Koks, Schwefeldioxid oder Calciumcarbid, wobei die Umsetzung von geschmolzenen Natriumnitrat mit Blei bei 400 °C die gebräuchlichste war.[7] Aufgrund des niedrigen Preises von Natriumhydroxid wird diese Herstellungsmöglichkeit jedoch nur selten angewendet. Im Labor kann die Reduktion von Natriumnitrat mittels Blei oder anderer Reduktionsmittel noch angewendet werden.
Eigenschaften
Natriumnitrit bildet farblose bis leicht gelbliche Kristalle, die bei 271 °C schmelzen. Die Verbindung kristallisiert bei Raumtemperatur orthorhombisch in der Raumgruppe Im2m (Raumgruppen-Nr. 44, Stellung 3) mit zwei Formeleinheiten in der Elementarzelle. Ab 165 °C geht sie in eine andere orthorhombische Kristallstruktur mit der Raumgruppe Immm (Nr. 71) über und daneben existieren noch weitere Hochdruckmodifikationen.[8] Natriumnitrit löst sich in Wasser unter starker Abkühlung. Die Lösungswärme beträgt bei 25 °C 13,9 kJ·mol−1.[7] Unterhalb von −5 °C existiert ein stabiles Hemihydrat NaNO2·0,5H2O.[7] Die wässrige Lösung reagiert alkalisch. Das Salz löst sich auch in flüssigem Ammoniak. Hier wird unterhalb von −64 °C ein stabiles Ammoniaksolvat NaNO2·0,5NH3 gebildet.[7] Die Löslichkeit in 95%igem Ethanol ist mit 1,4 % nur gering.[7] Oberhalb von Temperaturen von 330 °C erfolgt eine Zersetzung zu Natriumoxid, Stickstoffmonoxid und Stickstoffdioxid.[7]
Wenn die resultierenden Stickoxide nicht abgeführt werden können, reagieren sie mit unumgesetzten Natriumnitrit zu Natriumnitrat und Stickstoffmonoxid bzw. Stickstoff.[7]
Die Endprodukte der Zersetzung im Temperaturbereich zwischen 330 °C und 400 °C sind Natriumnitrat, Natriumoxid und Stickstoff. Oberhalb von 600 °C zerfällt Natriumnitrat in Natriumnitrit und Sauerstoff, so dass die Endprodukte der Natriumnitritzersetzung bei dieser Temperatur Natriumoxid, Stickstoff und Sauerstoff sind.[7]
Wässrige Lösungen von Natriumnitrit reduzieren starke Oxidationsmittel wie Kaliumpermanganat. In saurer Lösung wird Kaliumiodid zu Iod oxidiert. Ebenso erfolgt mit Ammoniumsalzen die Bildung von Stickstoff. Harnstoff und Amidoschwefelsäure werden ebenfalls unter Stickstoffbildung oxidiert.[7]
In wasserfreier Schmelze werden bei 210–220 °C mit einem Überschuss an Natriumnitrit mit Harnstoff Natriumcarbonat und Stickstoff gebildet. Die stöchiometrische Mischung ergibt unter denselben Bedingungen Natriumcyanat und Stickstoff.[7]
Die Verbindung bildet mit Natriumnitrat ein eutektisches System, mit einem eutektischen Schmelzpunkt bei 227 °C bei einem Gehalt an Natriumnitrat von 37,5 Mol%.[7]
Natriumnitrit ist brandfördernd (vor allem bei höheren Temperaturen) und reagiert heftig mit Aluminium (vor allem Pulver), trockenen Ammoniumverbindungen (wie beispielsweise Ammoniumsulfat), Cyaniden und vielen organischen Verbindungen. Es ist ein Reduktionsmittel und wird an der Luft langsam zu Natriumnitrat NaNO3 oxidiert.
Natriumnitrit ist giftig (tödliche Dosis etwa 4 g); im Allgemeinen können Nitrite mit bestimmten Aminen bei geeigneten Bedingungen zu krebserregenden Nitrosaminen reagieren. Nitrit kann mit Eisen(II)-sulfat durch Braunfärbung nachgewiesen werden.
Verwendung
Bestandteil von Pökelsalz
Unter bestimmten Auflagen ist Natriumnitrit als Lebensmittelzusatzstoff E 250 in der Funktion eines Konservierungsmittels zugelassen.[9] Im Gemisch mit Natriumchlorid verleiht es als Nitritpökelsalz (Natriumchlorid mit 0,4 bis 0,5 % Natriumnitrit) dem Fleisch durch Bildung von Nitrosomyoglobin eine bleibende rote Farbe und verhindert das Wachstum von Bakterien (Pökeln).
Zulässigkeit
Seit den 1980er Jahren darf der Natriumnitritgehalt von Pökelsalz 0,5 % nicht überschreiten. Natriumnitrit darf nur mit Kochsalz oder Kochsalzersatz gemischt in den Handel gelangen.[10][11]
Gesundheitliche Auswirkungen
In den 1920er Jahren wurden die ersten Vergiftungen durch Pökelsalze mit Natriumnitritgehalten über 5 % berichtet.[10] Eine Dosierung oberhalb von etwa 0,5 g führt zu Vergiftungen.[12] In den 1970er Jahren wurde entdeckt, dass die Nitrosamine, die aus Natriumnitrit entstehen, krebserzeugend sind.[10] Auch die zulässigen Beimischungen gelten als geringfügig krebserzeugend. Nitrosamine entstehen beispielsweise beim Grillen oder Braten von gepökeltem Fleisch; gepökeltes Fleisch sollte daher möglichst nicht gegrillt oder gebraten werden.[12]
Nitrite haben eine blutdrucksenkende und gefäßerweiternde Wirkung.[12] Säuglinge unter sechs Monaten sind wegen fehlenden Enzymen besonders empfindlich für die Auswirkungen von Nitriten auf das Hämoglobin im Blut; Nitrite aus nitratreichem Wasser oder Gemüse können daher bei Säuglingen zu innerem Ersticken führen.[12]
Natriumnitrit wird bei der Behandlung von Cyanidvergiftungen eingesetzt. Es verstärkt die Bildung von Methämoglobin, welches das toxische Cyanid bindet und Cyanomethämoglobin erzeugt. Dieses kann durch das Verabreichen von Natriumthiosulfat in Methämoglobin und das weniger toxische Thiocyanid umgewandelt werden. Das verbleibende Methämoglobin wird durch die Gabe von Methylenblau in Oxyhämoglobin umgewandelt.[13]
Reagenz in der chemischen Industrie
In der chemischen und pharmazeutischen Industrie dient es zur Synthese von Diazoniumverbindungen für Azofarbstoffe sowie Nitroso- und Isonitrosoverbindungen und als Zusatzstoff in Galvanikbädern und Rostschutzmitteln.
Giftköder
In Australien und den Vereinigten Staaten wurden Giftköder auf der Basis von Natriumnitrit entwickelt,[14] die laut Patent gegen Allesfresser[15][16] eingesetzt werden können. Bisher wurden diese Köder, die bei einer Aufnahmemenge von 135 mg Natriumnitrit/kg zu einem schnellen Erstickungstod führen,[15][16] gegen Wildschweine, verwilderte Hausschweine und – in Neuseeland – gegen Possums mit Erfolg eingesetzt.
Einzelnachweise
- T. Gohda, M. Ichikawa, T. Gustafsson, I. Olovsson: The Refinement of the Structure of Ferroelectric Sodium Nitrite. In: Journal of the Korean Physical Society. Band 29, November 1996, S. 551–554 (Online [PDF; 268 kB; abgerufen am 20. Februar 2019]).
- Eintrag zu E 250: Sodium nitrite in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu SODIUM NITRITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Natriumnitrit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Sodium nitrite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Natriumnitrit (PDF) bei Merck, abgerufen am 18. Januar 2011.
- W. Laue, M. Thiemann, E. Scheibler, K.W. Wiegand: Nitrates and Nitrites, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a17_265.
- E. Yu Tonkov: High Pressure Phase Transformations Handbook 1. CRC Press, 1992, ISBN 978-2-88124-758-3, S. 569 (eingeschränkte Vorschau in der Google-Buchsuche).
- ZZulV: Anlage 5 (zu § 5 Abs. 1 und § 7) Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind
- Universität Bayreuth: Wurst und Chemie: Pökeln
- Verordnung über die Zulassung von Zusatzstoffen zu Lebensmitteln zu technologischen Zwecken (Zusatzstoff-Zulassungsverordnung - ZZulV), Ausfertigungsdatum: 29. Januar 1998
- zusatzstoffe-online.de: Natriumnitrit.
- Dr Steven I Baskin PharmD, Dr Arthur M Horowitz PhD, Mr Eric W Nealley BA: The Antidotal Action of Sodium Nitrite and Sodium Thiosulfate Against Cyanide Poisoning. Hrsg.: ACCP Journals. April 1992.
- Animal Control Technologies (Australia) Pty Ltd: HOGGONE(R).
- Patentanmeldung US2010150978: Nitrite salts as poisons in baits for omnivores. Angemeldet am 28. Februar 2008, veröffentlicht am 17. Juni 2010, Anmelder: Invasive Animals Ltd., Erfinder: Linton Drew Staples, Steven Lapidge, Brendan Cowled, Simon Humphrys.
- Patentanmeldung US2014255460: Nitrite salts as poisons in baits for omnivores. Angemeldet am 4. März 2014, veröffentlicht am 11. November 2014, Anmelder: Invasive Animals Ltd., Erfinder: Linton Drew Staples, Steven Lapidge, Brendan Cowled, Simon Humphrys.


