N-Bromsuccinimid
N-Bromsuccinimid, meist kurz als NBS bezeichnet, ist das am Stickstoff bromierte Imid der Bernsteinsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
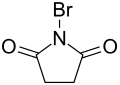 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Bromsuccinimid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4BrNO2 | |||||||||||||||
| Kurzbeschreibung |
farblose, orthorhombische Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 177,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,10 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−335,9 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
NBS kann durch Behandlung von Succinimid mit elementarem Brom in Gegenwart von Natronlauge bei 0 °C hergestellt werden.
Eigenschaften
NBS ist in Wasser wenig, aber in den meisten organischen Lösungsmitteln gut löslich. Einige Lösungsmittel, wie Tetrahydrofuran, N,N-Dimethylformamid, N,N-Dimethylacetamid, N,N-Dimethylpropionamid, N-Methyl-2-pyrrolidon und Ethylacetat sind gegenüber NBS nicht inert und gehen bei erhöhter Temperatur exotherme Reaktionen ein.[5] NBS ist nicht stabil und sollte unter Lichtausschluss bei 2–8 °C gelagert werden. Bei starker mechanischer und/oder thermischer Beanspruchung kann NBS explosionsartig in Brom und nitrose Gase zerfallen.
Aufgrund der relativ zum Brom höheren Elektronegativität des Stickstoffs, noch verstärkt durch die beiden nebenstehenden Carbonylgruppen, ist die N-Br-Bindung polarisiert. Dabei ist das Brom Träger einer partiell positiven Ladung und kann leicht abgespalten werden. Daher wird NBS in der organischen Chemie vielseitig verwendet.
Verwendung
In der Fachliteratur werden im Wesentlichen drei Anwendungen beschrieben:
- Regioselektive Bromierung
NBS reagiert im Licht mit allylischen und benzylischen Protonen unter Substitution. Diese Reaktion ist als Wohl-Ziegler-Reaktion bekannt. Elementares Brom reagiert hingegen unter Addition mit den zugehörigen Alkenen oder unter Kernsubstitution mit den Aromaten.
- Oxidation
NBS in wässrigem Dioxan ist ein außerordentlich selektives Oxidationsmittel. Im Gegensatz zu Reagenzien wie dem Cornforth-Reagenz (PDC) und Pyridiniumchlorochromat (PCC) werden sekundäre Alkohole bevorzugt vor primären Alkoholen in sehr guten Ausbeuten oxidiert.
- Bromhydrin-Bildung
Alkene reagieren in wässrigem Dimethylsulfoxid (DMSO) mit NBS unter Bildung von Bromhydrinen (Dalton-Reaktion). Diese sind wichtige Edukte für die Bildung von Epoxiden. In wasserfreiem DMSO erhält man hingegen Bromketone. Aus Enolethern entstehen α-Bromcarbonsäureester, die Edukte für die wichtige Reformatzki-Reaktion sein können.
In der Literatur werden zahlreiche andere Verwendungen beschrieben.
Literatur
- S. C. Virgil: Übersicht. In: Leo A. Paquette (Hrsg.): Encyclopedia of Reagents for Organic Synthesis. Band 1: A - Bru. Wiley, New York 1995, S. 768.
- V. Canibano u. a.: Mild Regioselective Halogenation of Activated Pyridines with N-Bromosuccinimide. In: Synthesis. Nr. 14, 2001, S. 2175. doi:10.1055/s-2001-18070
- Übersicht: Jeffrey B. Arterburn: Selective oxidation of secondary alcohols. In: Tetrahedron. Band 57, Nr. 49, Dezember 2001, S. 9765–9788, doi:10.1016/S0040-4020(01)01009-2.
- A. Kamal, G. Chouhan: Mild and efficient chemoselective protection of aldehydes as dithioacetals employing Nbromosuccinimide. In: Synlett. Nr. 3, 2002, S. 474. doi:10.1055/s-2002-20469
- Louis Frederick Fieser, Mary Fieser: Reagents for Organic Synthesis. Band 12, New York 1986, ISBN 0-471-83469-6, S. 79.
Einzelnachweise
- Eintrag zu N-Bromsuccinimid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Mai 2014.
- Eintrag zu N-Bromsuccinimid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Registrierungsdossier zu N-bromosuccinimide (Abschnitt Vapour pressure) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Juni 2017.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Sumio Shimizu, Yoshiaki Imamura, Tatsuo Ueki: Incompatibilities between N‑Bromosuccinimide and Solvents. In: Org. Process Res. Dev. Band 18, 2014, S. 354–358, doi:10.1021/op400360k.



