Reserpinsäure
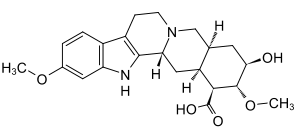
Bei der Reserpinsäure handelt es sich um ein Indolalkaloid aus der Reihe der Epialloyohimbane. Die Struktur wurde 1954 im Rahmen intensiver Beschäftigung mit den Rauvolfia-Alkaloiden aufgeklärt.[5] Erst 1982 wurde Reserpinsäure aus pflanzlichem Material aus Rauvolfia vomitoria isoliert.[1] Davor war sie lediglich als Metabolit des arzneilich genutzten Reserpin bekannt gewesen, aus dem sie durch Hydrolyse der beiden Esterbindungen entsteht und dessen Grundgerüst sie bildet. Reserpinsäure gilt – wie auch die sonstigen Abbauprodukte von Reserpin – als im Wesentlichen pharmakologisch inaktiv,[6][7] wenngleich es Hinweise darauf gibt, dass sie wie dieses – jedoch in äußerst geringem Umfang – an vesikuläre Monoamintransporter bindet und damit die Aufnahme von Katecholaminen in Speichergranula stört.[4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Reserpinsäure | ||||||||||||
| Andere Namen |
Reserpsäure | ||||||||||||
| Summenformel | C22H28N2O5 | ||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 400,6 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Reaktionen
Reserpinsäure bildet das Grundgerüst von Reserpin. Aufgrund dieser strukturellen Ähnlichkeit lassen sich aus ihren Reaktionen Rückschlüsse auf die Reserpin-Struktur ziehen. Vor allem zwei Reaktionen trugen zu deren Aufklärung und Zuordnung zu den Epialloyohimbanen bei:
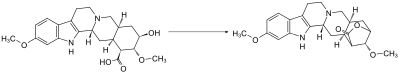
Lactonbildung
Da die Carboxygruppe am C-16 und die Hydroxygruppe am C-18 der Reserpinsäure leicht miteinander reagieren und dabei unter Wasserabspaltung ein Lacton ausbilden, müssen beide auf derselben Seite des Rings liegen.[8]
Quaternisierung
Wird die C-16-ständige Carboxygruppe zuerst mit Lithiumalanat zu einem primären Alkohol reduziert und dieser Alkohol in einem zweiten Schritt mit Tosylchlorid kondensiert, geht das C-22 (das Kohlenstoffatom der reduzierten ehemaligen Carboxygruppe) spontan eine Bindung mit dem Stickstoffatom in Position 4 ein, wodurch dieses eine positive Ladung bekommt. Zusammen mit dem abgehenden Tosylat-Anion ergibt das entstandene quartäre Ammoniumion ein Salz.
Damit der Angriff des partiell positiv geladenen C-22 auf das freie Elektronenpaar des N-4 in dieser Form gelingt, müssen die an die Kohlenstoffatome 15 und 20 gebundenen Wasserstoffatome in α-, das an C-3 gebundene in β-Stellung stehen.[8]
Einzelnachweise
- Malik, Afza: Reserpic Acid, Gallic Acid, and Flavonoids from Rauwolfia vomitoria. In: Journal of Natural Products (1983), Vol. 46, S. 939–941. doi:10.1021/np50030a024
- Eintrag zu Reserpic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 28. Oktober 2016.
- Datenblatt Reserpinsäure (PDF) bei Carl Roth, abgerufen am 28. Oktober 2016.
- Chaplin, Cohen, Huettl, Kennedy, Njus, Temperley: Reserpic Acid as an Inhibitor of Norepinephrine Transport into Chromaffin Vesicle Ghosts. (PDF; 539 kB) In: The Journal of Biological Chemistry (1985), Vol. 260, S. 10981–10985.
- Huebner, MacPhillamy, André, Schlittler: Rauwolfia Alkaloids. XV. The Constitution of Reserpic Acid: Position of Substituents in Ring E. In: Journal of the American Chemical Society (1955), Vol. 77, S. 472–475.
- Cohen: Reserpine. In: Sadée (Hrsg.): Drug Level Monitoring. John Wiley & Sons, New York/Chichester/Brisbane/Toronto, 1980. ISBN 0-471-04881-X. S. 415–417.
- Hänsel, Sticher: Pharmakognosie – Phytopharmazie. Springer, Heidelberg, 2007. ISBN 3-540-26508-2. S. 1421.
- Auterhoff: Lehrbuch der Pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft, Stuttgart, 1983. ISBN 3-8047-0714-9. S. 399.

