Dicyclohexylcarbodiimid
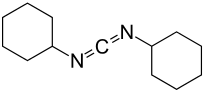
N,N′-Dicyclohexylcarbodiimid (abgekürzt DCC, auch N,N′-Dicyclohexylmethandiimin) ist eine reaktive organische Verbindung aus der Gruppe der Carbodiimide, die häufig in der Synthesechemie eingesetzt wird. Bei Standardbedingungen ist DCC ein farbloser Feststoff mit schwachem, charakteristischem Geruch.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N,N′-Dicyclohexylcarbodiimid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C13H22N2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 206,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
0,95 g·cm−3 (40 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung
Eine Darstellung geht vom Dicyclohexylthioharnstoff aus, wobei durch die Umsetzung mit Quecksilber(II)-oxid über einen Schwefel-Sauerstoff-Austausch intermediär das entsprechende Harnstoffderivat und nach anschließender Dehydratisierung die Zielverbindung entsteht.[5]
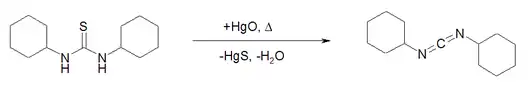
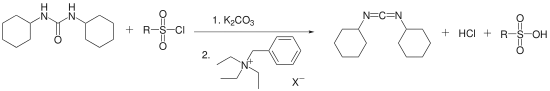
Bei einem ähnlichen Syntheseweg wird Dicyclohexylharnstoff in Gegenwart von einem Sulfonsäurechlorid (z. B. TsCl) und Kaliumcarbonat als Base[6] oder Triphenylphosphin und Triethylamin als Base[7] dehydratisiert.
Eigenschaften
Dicyclohexylcarbodiimid ist ein niedrig schmelzender Feststoff mit einem Schmelzpunkt bei 34–35 °C.[8] Bei kälteren Umgebungstemperaturen kann der Stoff auch flüssig als unterkühlte Schmelze vorliegen. Da die Verbindung bei höheren Temperaturen zur Polymerisation und Zersetzung neigt, kann eine Destillation nur unter reduziertem Druck erfolgen. Der Siedepunkt liegt bei einem Druck von 15 mbar bei 148–152 °C.[8] Der Flammpunkt ist mit 113 °C relativ hoch.[8] Die Verbindung ist thermisch instabil. Eine DSC-Messung zeigt ab 254 °C eine exotherme Zersetzungsreaktion mit einer Wärmetönung von −269 kJ·kg−1 bzw. −55,5 kJ·mol−1.[9]
Verwendung
DCC findet vor allem bei der Synthese organischer Ester und Amide Verwendung. Insbesondere bei sterisch anspruchsvollen Edukten kommt es zu deutlichen Ausbeutesteigerungen.[10] Des Weiteren ermöglicht es – im Gegensatz zur Fischer-Veresterung – Veresterungen und Amidierungen unter sehr milden Bedingungen, was für säurelabile Edukte wie tert-Butylalkohol von Interesse ist. Deswegen kommt DCC auch eine bedeutende Rolle in der in-vitro-Peptidsynthese und bei der Einführung von Schutzgruppen zu.
Veresterungen und Amidierungen mit DCC
Carboxygruppen addieren rasch an eine C=N-Doppelbindung des DCC, wobei der entsprechende O-Acylisoharnstoff gebildet wird. Dieser Ester ist sehr reaktiv (vergleichbar mit einem Säureanhydrid), so dass er leicht von Aminen zum Amid umgesetzt wird. Für die Reaktion mit Alkoholen wird zusätzlich ein Acylgruppen-Überträger wie DMAP benötigt und man spricht von einer Steglich-Veresterung.[11] In der Summe wird das aus der Kondensation der Säure mit dem Alkohol/Amin resultierende Wasser vom DCC aufgenommen und dieses dadurch zum N,N′-Dicyclohexylharnstoff umgesetzt.
Bei Veresterungen tritt als Konkurrenzreaktion häufig eine 1,3-Umlagerung auf, in welcher der O-Acylisoharnstoff irreversibel zum N-Acylharnstoff reagiert. Sowohl Acylgruppen-Überträger[12] als auch Säurekatalyse[13][14][15] können diese Reaktion unterdrücken, beides ist jedoch noch Gegenstand aktueller Forschung. Weitere Probleme dieser Reaktionen resultieren insbesondere bei der Produktreinigung aus dem anfallenden N,N′-Dicyclohexylharnstoff bzw. durch ebenfalls gebildete Säureanhydride.
DCC-aktivierte Veresterungen werden in der Regel bei 0 bis 25 °C und in trockenem (DCC ist wasserempfindlich) Dichlormethan durchgeführt, da hiermit in der Vergangenheit die besten Ausbeuten erzielt wurden. Auch ist das sich bildende Harnstoffderivat in Dichlormethan unlöslich und fällt somit aus der Reaktionslösung aus.
Als Alternative zu DCC wurden andere Carbodiimide[14] sowie das Standard-Schutzgruppenreagenz Di-tert-butyldicarbonat (Boc2O) vorgeschlagen.[16]
Sicherheitshinweise
DCC kann bereits bei Hautkontakt giftig wirken, aber auch schwere Reizungen der Atemwege oder Augenschädigungen hervorrufen. DCC wirkt sensibilisierend.
Einzelnachweise
- Datenblatt Dicyclohexylcarbodiimid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Dicyclohexylcarbodiimid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Günter Losse, Werner Zönnchen: Die Formylgruppe, eine oxydativ entfernbare Schutzgruppe für Peptidsynthesen. In: Justus Liebigs Annalen der Chemie. 636, 1960, S. 140–143, doi:10.1002/jlac.19606360113.
- Eintrag zu Dicyclohexylcarbodiimide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- S. Hauptmann, J. Graefe, H. Remane: Lehrbuch der organischen Chemie, Deutscher Verlag für Grundstoffindustrie, Leipzig 1976, S. 433.
- Z.M. Jászay; I. Petneházy; L. Töke; B. Szajáni: Preparation of Carbodiimides Using Phase-Transfer Catalysis. In: Synthesis 1987, 520–523. doi:10.1055/s-1987-27992.
- R. Appel; R. Kleinstück; K.-D. Ziehn: Über die gemeinsame Einwirkung von Phosphinen und Tetrachlorkohlenstoff auf Ammoniak (Derivate), IV Notiz über eine neue Carbodiimid-Synthese. In: Chem. Ber. 104 (1971) 1335–1336. doi:10.1002/cber.19711040438.
- Sorbe: Sicherheitstechnische Kenndaten chemischer Stoffe. 130. Ergänzungslieferung 6/2009, ecomed-Verlag.
- Sperry, J.B.; Minteer, C.J.; Tao, J.; Johnson, R.; Duzguner, R.; Hawksworth, M.; Oke, S.; Richardson, P.F.; Barnhart, R.; Bill, D.R.; Giusto, R.A.; Weaver, J.D.: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing in Org. Process Res. Dev. 22 (2018) 1262–1275, doi:10.1021/acs.oprd.8b00193.
- Harold Wiener, Chaim Gilon: An improved method for the catalytic preparation of t-butyl esters of carboxylic and fatty acids. In: Journal of Molecular Catalysis. 37, 1986, S. 45–52, doi:10.1016/0304-5102(86)85136-7.
- Bernhard Neises, Wolfgang Steglich: Simple Method for the Esterification of Carboxylic Acids. In: Angewandte Chemie International Edition in English. 17, 1978, S. 522–524, doi:10.1002/anie.197805221.
- Eric F. V. Scriven: 4-Dialkylaminopyridines: super acylation and alkylation catalysts. In: Chemical Society Reviews. 12, 1983, S. 129, doi:10.1039/CS9831200129.
- K. Holmberg, B. Hansen: Ester Synthesis with Dicyclohexylcarbodiimide Improved by Acid Catalysts. In: Acta Chem. Scand. 1979, B33, 410–412, doi:10.3891/acta.chem.scand.33b-0410, PDF.
- Jeffrey S. Moore, Samuel I. Stupp: Room temperature polyesterification. In: Macromolecules. 23, 1990, S. 65–70, doi:10.1021/ma00203a013.
- E. P. Boden, G. E. Keck: Proton-transfer steps in Steglich esterification: a very practical new method for macrolactonization in J. Org. Chem. 1985, 50, 2394–2395, doi:10.1021/jo00213a044.
- Lukas J. Gooßen, Arno Döhring: A Convenient Protocol for the Esterification of Carboxylic Acids with Alcohols in the Presence of di-t-Butyl Dicarbonate. In: Synlett. 2004, S. 0263, doi:10.1055/s-2003-44986.

