Propionyl-CoA-Carboxylase
Die Propionyl-CoA-Carboxylase (abgekürzt PCCase oder PCC) ist ein Enzym, das zur Klasse der Ligasen zählt und in den Mitochondrien von Tieren, Pflanzen und Pilzen vorkommt, aber auch in Bakterien gefunden wird. Sie katalysiert die Umwandlung von Propionyl-CoA zu D-Methylmalonyl-CoA und spielt damit eine wichtige Rolle im Aminosäuren- und Fettstoffwechsel. Zur Funktion benötigt die Propionyl-CoA-Carboxylase das Vitamin Biotin als Kofaktor. Defekte in den Untereinheiten können zu seltenen erblichen Stoffwechselerkrankungen führen.[1]
| Propionyl-CoA-Carboxylase, α-Untereinheit | ||
|---|---|---|
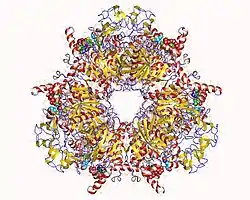 | ||
| Propionyl-CoA-carboxylase hetero12mer, Methylorubrum extorquens nach PDB 6ybp | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 703 Aminosäuren (Mensch) | |
| Kofaktor | Biotin | |
| Bezeichner | ||
| Gen-Name | PCCA | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 6.4.1.3, Ligase | |
| Reaktionsart | Carboxylierung | |
| Substrat | Propionyl-CoA + HCO3− + ATP | |
| Produkte | D-Methylmalonyl-CoA + ADP + Pi | |
| Vorkommen | ||
| Homologie-Familie | PCCA | |
| Übergeordnetes Taxon | Lebewesen | |
| Propionyl-CoA-Carboxylase, β-Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 539 Aminosäuren (Mensch) | |
| Bezeichner | ||
| Gen-Name | PCCB | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 6.4.1.3, Ligase | |
| Reaktionsart | Carboxylierung | |
| Substrat | Propionyl-CoA + HCO3− + ATP | |
| Produkte | D-Methylmalonyl-CoA + ADP + Pi | |
| Vorkommen | ||
| Homologie-Familie | accD/PCCB | |
| Übergeordnetes Taxon | Lebewesen | |
Struktur
Die Propionyl-CoA-Carboxylase setzt sich aus zwei verschiedenen Proteinen zusammen, der α- und der β-Untereinheit, die jeweils mehrfach vorkommen. So handelt es sich beim menschlichen Enzym um ein Dodecamer, in dem sechs α- und sechs β-Untereinheiten miteinander kombiniert sind.[1]
Die größere α-Untereinheit beherbergt das als prosthetische Gruppe fungierende Biotin-Molekül, außerdem die Andockstelle für ATP und die Domäne, an der Biotin carboxyliert wird. Dagegen enthält die kleinere β-Untereinheit die Carboxytransferase-Domäne, an der die Carboxygruppe von Biotin weiter auf Propionyl-CoA übertragen wird.[2][3]
Funktion
Die Propionyl-CoA-Carboxylase spielt eine wichtige Rolle beim Abbau der Aminosäuren Isoleucin, Valin, Methionin und Threonin, ungeradzahliger und verzweigter Fettsäuren sowie der Seitenkette des Cholesterins, aber auch bei der Verwertung der von manchen Darmbakterien durch Propionsäuregärung gebildeten Propionsäure. Das dabei anfallende Propionyl-CoA wird unter ATP-Verbrauch in D-Methylmalonyl-CoA umgewandelt, das nach zwei weiteren Umformungen als Succinyl-CoA in den Citratzyklus eingeht (anaplerotische Reaktion).[4][5]
Der Ablauf der enzymatischen Reaktion ähnelt sehr dem Mechanismus, den man auch von der Pyruvat-Carboxylase, der Methylcrotonoyl-CoA-Carboxylase und der Acetyl-CoA-Carboxylase kennt: Am ersten aktiven Zentrum wird Hydrogencarbonat unter Verbrauch von ATP aktiviert und dann vorübergehend Biotin damit carboxyliert. Das Biotinmolekül ist seinerseits über einen Lysinrest mit dem Protein verbunden und kann deshalb wie an einem langen Arm zwischen den beiden aktiven Zentren des Enzyms hin- und herpendeln. Am zweiten aktiven Zentrum gibt Biotin die Carboxygruppe dann wieder ab an das jeweilige Substrat, in diesem Fall an Propionyl-CoA.[4]
Genetik
Das Gen für die α-Untereinheit (PCCA) codiert beim Menschen auf Chromosom 13 im Bereich q32, dagegen findet sich das Gen für die β-Untereinheit (PCCB) auf Chromosom 3 im Bereich q21–q22.[6][7]
Von beiden Untereinheiten sind etliche Mutationen bekannt, die zu der seltenen, autosomal rezessiv vererbten Stoffwechselkrankheit Propionyl-CoA-Carboxylase-Mangel führen.[8][9] Lediglich bei den Inuit auf Grönland ist ein vergleichsweise häufiges Auftreten bekannt, da hier ungefähr 5 % aller Menschen ein defektes PCCB-Gen besitzen. Man nimmt an, dass es sich dabei um eine so genannte Gründermutation (engl. founder mutation) handelt.[10]
Einzelnachweise
- Enzymdatenbank BRENDA, Eintrag EC 6.4.1.3
- Proteindatenbank UniProt P05165
- Proteindatenbank UniProt P05166
- J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 697f, 741ff; ISBN 978-3-8274-1800-5
- D. Doenecke, J. Koolman, G. Fuchs, W. Gerok: Karlsons Biochemie und Pathobiochemie. 15. Auflage. Georg Thieme Verlag, Stuttgart 2005; S. 281, 328f, 468, 655 ISBN 978-3-13-357815-8
- Gendatenbank der HUGO, Eintrag PCCA
- Gendatenbank der HUGO, Eintrag PCCB
- PCCA. In: Online Mendelian Inheritance in Man. (englisch)
- PCCB. In: Online Mendelian Inheritance in Man. (englisch)
- K. Ravn et al.: High incidence of propionic acidemia in greenland is due to a prevalent mutation, 1540insCCC, in the gene for the beta-subunit of propionyl CoA carboxylase. In: Am. J. Hum. Genet. 67(1); July 2000: S. 203–6. PMID 10820128 doi:10.1086/302971 (Volltext)