Ozonolyse
Die Ozonolyse, auch Harries-Reaktion, ist eine Reaktion aus dem Bereich der Organischen Chemie. Der Name leitet sich aus dem verwendeten Ozon (O3) und dem ausschlaggebenden Reaktionsschritt ab: der Zerstörung/Auflösung (Lyse) einer Kohlenstoff-Kohlenstoff-Doppelbindung. Dieses Verfahren wurde von Carl Dietrich Harries 1904 entdeckt[1] und 1905 publiziert.[2][3]
Ein Resultat der Ozonolyse ist die Ozonrissbildung in Elastomeren und Kautschuken, die durch Verwendung von Ozonschutzmittel verhindert werden soll.
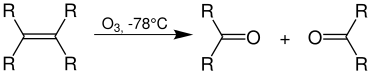
R ist ein Organylrest (z. B. Alkylrest) oder ein Wasserstoffatom. Je nach Aufarbeitung erhält man aus dem Alken als Produkte Carbonylverbindungen (insbesondere Ketone, Aldehyde), Alkohole oder Carbonsäuren. Durch die Analyse der Produkte sind Rückschlüsse über die Struktur des Ausgangsstoffes möglich. Auf diese Art wurde früher – ohne moderne Methoden wie NMR-Spektroskopie – Strukturaufklärung betrieben.
Andere Oxidationsverfahren für Doppelbindungen arbeiten mit Osmiumtetroxid, Kaliumpermanganat oder Chromverbindungen. Im Gegensatz zu diesen Methoden wird bei der Ozonolyse nicht nur die π-Bindung, sondern zusätzlich auch noch die σ-Bindung gebrochen.
Der dreistufige Mechanismus der Ozonolyse wurde 1949 durch Rudolf Criegee aufgeklärt, dessen Namen deshalb auch manchmal mit der Ozonolyse verbunden wird.
Reaktionsbedingungen und Mechanismus
.svg.png.webp)
Diese Reaktion funktioniert besonders gut bei tiefen Temperaturen. Häufig verwendete Lösungsmittel sind Methanol, Ethylacetat und Dichlormethan.
Mechanistisch wird im ersten Schritt das polare Ozon über eine 1,3-dipolare Cycloaddition an das Alken addiert. Es bildet sich dabei das so genannte Primärozonid (auch Molozonid genannt). Dieses zerfällt durch Bruch der C-C-Bindung und einer der beiden O-O-Bindungen im Ozon (Cycloreversion) in eine Carbonylverbindung und ein Carbonyloxid, das außerordentlich instabil ist und nur intermediär auftritt. Diese bilden wieder durch 1,3-dipolare Cycloaddition das so genannte Sekundärozonid.[4]
Durch unterschiedliche Aufarbeitung der Ozonolyse können unterschiedliche Produkte erhalten werden: Durch einfache Hydrolyse des Sekundärozonids bilden sich primär die beiden Carbonylverbindungen. Da so aber gleichzeitig Wasserstoffperoxid gebildet wird, kann dieses die Produkte unter Umständen weiter oxidieren.
Unter bestimmten Bedingungen kommt es bei der Ozonierung nicht zur Bildung von Primärozoniden, sondern von Epoxiden, insbesondere dann, wenn an der Doppelbindung sperrige Substituenten vorhanden sind. Diese Epoxide können sich zu Aldehyden umlagern, die durch weitere Oxidation zu Carbonsäuren mit einem unveränderten Kohlenstoffgerüst führen.
Präparativ kann man entweder unter oxidativen oder unter reduktiven Bedingungen aufarbeiten. Auch der Erhalt der Oxidationsstufe der beiden Primärprodukte ist denkbar. Mit Natriumborhydrid oder Lithiumaluminiumhydrid erhält man primäre bzw. sekundäre Alkohole, mit Dimethylsulfid, Triphenylphosphin oder Zink (unter sauren Bedingungen) Aldehyde bzw. Ketone, mit Wasserstoffperoxid Carbonsäuren bzw. Ketone.
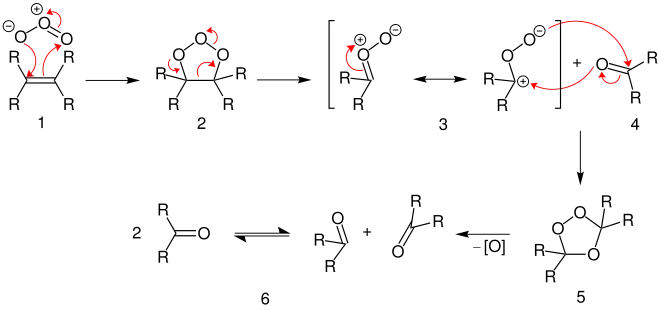
Ein Alken [R = Organylrest (z. B. Alkylrest)] 1 reagiert mit Ozon unter Bildung eines Primärozonids 2. Dieses zerfällt in eine Carbonylverbindung 4 und ein Carbonyloxid 3. Diese bilden unter Cycloaddition ein Sekundärozonid 5. Unter reduzierenden Bedingungen mit z. B. Dimethylsulfid entstehen zwei Ketone 6. Würde man einen/alle Organylreste [R] durch Wasserstoff ersetzen, so entstünden zusätzlich/ausschließlich Aldehyde. Unter Verwendung von Chrom(IV)-oxid oder H2O2 und NaOH entstehen statt den Ketonen zwei Carbonsäuren. Unter Verwendung von NaBH4 entstehen zwei Alkohole.
Literatur
- Rudolf Criegee: Die Ozonolyse. In: Chemie in unserer Zeit. Band 7, Nr. 3, 1973, S. 75–81, doi:10.1002/ciuz.19730070303.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Springer-Verlag, 2009, ISBN 3-8274-1579-9, S. 761 f.
Weblinks
- organische-chemie.ch: Ozonolyse
Einzelnachweise
- Brockhaus ABC Chemie. VEB F. A. Brockhaus, Leipzig 1965, S. 524.
- C. Harries: Ueber die Einwirkung des Ozons auf organische Verbindungen. In: Justus Liebigs Annalen der Chemie. 343, Nr. 2–3, 1905, S. 311–344, doi:10.1002/jlac.19053430209.
- Mordecai B. Rubin: The History of Ozone Part III. C. D. Harries and the Introduction of Ozone into Organic Chemistry. In: Helvetica chimica acta. 86, Nr. 4, 2003, S. 930–940 (classes.yale.edu PDF).
- Rudolf Criegee: Mechanismus der Ozonolyse. In: Angewandte Chemie 87, Nr. 21, 1975, S. 765–771, doi:10.1002/ange.19750872104.