Äpfelsäure
Äpfelsäure (2-Hydroxybernsteinsäure, seltener auch Apfelsäure) ist eine chemische Verbindung aus den Gruppen der Dicarbonsäuren und Hydroxycarbonsäuren, die als rechtsdrehende D- und als linksdrehende L-Äpfelsäure vorkommt. Die L-Form ist ein Zwischenprodukt im Citratzyklus. In der Natur ist L-Äpfelsäure meist in unreifen Früchten wie Äpfeln, Quitten, Weintrauben, Berberitzenbeeren, Vogelbeeren und Stachelbeeren enthalten. Die Ester und Salze der Äpfelsäure heißen Malate (von lateinisch malum = Apfel, nicht zu verwechseln mit Maleaten, den Estern und Salzen der Maleinsäure).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
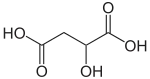 | |||||||||||||||||||
| Strukturformel von Äpfelsäure ohne Angabe zur Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Äpfelsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H6O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 134,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[3] | ||||||||||||||||||
| Dichte |
1,60 g·cm−3 (20 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung bei 140 °C [L-Äpfelsäure][3] | ||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Isomere
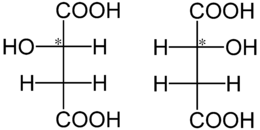
Die Äpfelsäure besitzt ein Stereozentrum, somit ist sie optisch aktiv und es existieren zwei Enantiomere: L-Äpfelsäure [Synonym: (S)-Äpfelsäure] und die spiegelbildlich aufgebaute D-Äpfelsäure [Synonym: (R)-Äpfelsäure]. Ein 1:1-Gemisch aus D- und L-Form wird als Racemat oder DL-Äpfelsäure bezeichnet.
| Isomere von Äpfelsäure | ||
| Name | L-(−)-Äpfelsäure | D-(+)-Äpfelsäure |
| Andere Namen | (S)-2-Hydroxybernsteinsäure | (R)-2-Hydroxybernsteinsäure |
| Strukturformel | 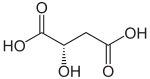 |
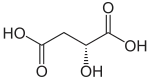 |
| CAS-Nummer | 97-67-6 | 636-61-3 |
| 6915-15-7 (unspez.) | ||
| EG-Nummer | 202-601-5 | 211-262-2 |
| 230-022-8 (unspez.) | ||
| ECHA-Infocard | 100.002.365 | 100.010.239 |
| 100.027.293 (unspez.) | ||
| PubChem | 222656 | 92824 |
| 525 (unspez.) | ||
| Wikidata | Q27104150 | Q27104149 |
| Q190143 (unspez.) | ||
Geschichte

L-Äpfelsäure wurde erstmals 1785 von Carl Wilhelm Scheele aus Apfelsaft isoliert und beschrieben. Antoine Lavoisier schlug 1787 den Namen acide malique vor, abgeleitet vom lateinischen Wort für Apfel (mālum).[7] Paul Walden konnte durch Synthese von L-Äpfelsäure und D-Äpfelsäure die Chiralität und die Konfigurationsumkehr am Kohlenstoffatom beweisen.
Eigenschaften
Der Flammpunkt von DL-Äpfelsäure liegt bei 203 °C, die Zersetzungstemperatur bei 140 °C und die Zündtemperatur bei 349 °C.[3] Bei schnellem Erhitzen von Äpfelsäure auf 250 °C spaltet sie 2 Moleküle Wasser ab und geht in Maleinsäureanhydrid über. Dieses ergibt mit Wasser Maleinsäure.[8]
Wie alle Enantiomere besitzen die L-Äpfelsäure und die D-Äpfelsäure, mit Ausnahme der Richtung des Drehwerts α, die gleichen physikalischen Eigenschaften. Bei DL-Äpfelsäure, dem Racemat, unterscheiden sich die physikalischen Eigenschaften, z. B. Schmelzpunkt, allerdings deutlich von denen der reinen Enantiomere L-Äpfelsäure und D-Äpfelsäure.
Verwendung
Als Lebensmittelzusatzstoff (E 296) dürfen sowohl die L-Form als auch die D-Form oder das Racemat verwendet werden. D-Äpfelsäure kann beim Menschen durch Enzyme in L-Äpfelsäure umgewandelt werden.[9] In der Praxis ist ihre Verwendung aufgrund des relativ hohen Preises eher gering. Stattdessen werden meist günstigere Alternativen wie Citronensäure (E 330), Weinsäure (E 334) oder auch Phosphorsäure (E 338) verwendet. Als Zusatzstoff in Kartoffelchips werden Natriummalat (E 350), Kaliummalat (E 351) und Calciummalat (E 352) verwendet. In der Medizin wird Kaliummalat bei Hypokaliämie als Infusionslösung eingesetzt, falls Kaliumchlorid wegen gleichzeitig bestehender Hyperchlorämie nicht eingesetzt werden kann.
Herstellung
Die L-Äpfelsäure und ihre Salze (Malate) werden nach einem biotechnologischen Verfahren, katalysiert durch das Enzym Fumarat-Hydratase, aus Fumarsäure (E 297) beziehungsweise als Stoffwechselprodukt von Bakterien und Pilzen (z. B. Brevibacterium, Corynebacterium, Escherichia, Microbacterium, Proteus, Pichia) gewonnen.[10] Die enantiospezifische Anlagerung von Wasser an Maleinsäure wird durch die Maleat-Hydratase katalysiert und führt zu D-Äpfelsäure.[10] Racemische Äpfelsäure kann durch die Bildung diastereomerer Salze mit einem geeigneten enantiomerenreinen chiralen Amin in L-Äpfelsäure und D-Äpfelsäure gespalten werden.
Weinbau
L-Äpfelsäure ist auch in Weintrauben enthalten. Ein niedriger Äpfelsäuregehalt gilt als Reifeparameter. Beim Ausbau des Weins kann gezielt oder auch spontan eine malolaktische Gärung eingeleitet werden. Milchsäurebakterien Oenococcus oeni verstoffwechseln unter Abgabe von CO2 und sonstigen Nebenprodukten die deutlich saurer schmeckende Äpfelsäure in die weniger sauer schmeckende Milchsäure.
Biologische Funktion
Äpfelsäure kommt im Stoffwechsel von allen Zellen vor. Der Transport vom Cytosol ins Mitochondrium erfolgt über den Malat-Aspartat-Shuttle.
Die Äpfelsäure ist für den sauren Geschmack von Äpfeln verantwortlich, wobei viele andere Pflanzen ebenfalls Äpfelsäure enthalten. Wenn die Frucht reift, nimmt ihr Gehalt ab, wobei gleichzeitig der Zuckergehalt ansteigt. Dieser Effekt ist für die Fortpflanzung des Apfelbaums von essentieller Bedeutung, da der hohe Gehalt an Äpfelsäure in den Früchten verhindert, dass Tiere diese fressen und damit die noch unreifen Samen verteilen.[11]
Bei Pflanzen, welche einen Crassulaceen-Säurestoffwechsel (CAM) aufweisen, wird nachts Kohlenstoffdioxid durch Atemporen des Blatts aufgenommen und durch das Enzym PEP-Carboxylase fixiert. Durch eine weitere Reaktionskette entsteht dabei Malat. Malat ist das Salz der Äpfelsäure und wird nachts in den Vakuolen von CAM-Pflanzen in Form der Säure gespeichert. Am Tag wird CO2 wieder aus Äpfelsäure freigesetzt und direkt dem Calvin-Zyklus zugeführt. CAM-Pflanzen haben durch die zeitliche Trennung der Reaktion, auch diurnaler Säurerhythmus genannt, den Vorteil, ihre Stomata tagsüber zu schließen. Verdunstungsverlusten kann so entgegengewirkt werden.[5]
Weblinks
Einzelnachweise
- Eintrag zu E 296: Malic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 6. August 2020.
- Eintrag zu MALIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. August 2020.
- Eintrag zu Äpfelsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- The Merck Index, 9. Auflage, 1976, ISBN 0-911910-26-3, S. 741.
- Eintrag zu CAM-Pflanzen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juli 2011.
- Eintrag zu Malic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 1. Dezember 2019.
- William B. Jensen: The Origin of the Names Malic, Maleic, and Malonic Acid, in: J. Chem. Educ., 2007, 84, S. 924. doi:10.1021/ed084p924.
- Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. 356, S. Hirzel Verlag 1998 ISBN 3-7776-0808-4.
- zusatzstoffe-online.de: Apfelsäure
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, 2006, ISBN 3-906390-29-2, S. 362–370.
- Chemie Oberstufe – Organische Chemie. 1. Auflage, Cornelsen-Verlag, Berlin 2010, ISBN 978-3-06-011177-0.
