Klebsiella aerogenes
Klebsiella aerogenes ist ein gramnegatives Bakterium aus der Familie der Enterobacteriaceae. Bis 2017 wurde es unter der Bezeichnung Enterobacter aerogenes Hormaeche & Edwards 1960 geführt, obwohl schon seit den 1970er Jahren berechtigte Zweifel an der Zugehörigkeit zur Gattung Enterobacter bestanden. Ein weiteres Synonym ist Klebsiella mobilis. Klebsiella aerogenes kann sich mit Hilfe von Flagellen aktiv bewegen, sie ist motil. Diese Eigenschaft ist nicht typisch für die Gattung Klebsiella. Das Bakterium ist nah verwandt mit Klebsiella pneumoniae und Enterobacter cloacae, was sich auch in vielen ähnlichen Merkmalen zeigt, die die Unterscheidung schwierig machen. Es kommt in fast allen Lebensräumen, einschließlich des Darms von Menschen und Tieren vor.
| Klebsiella aerogenes | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
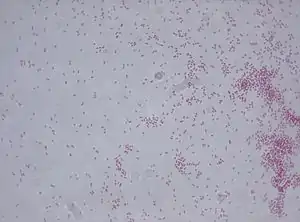
Mikroskopisches Bild von Klebsiella aerogenes nach Gram-Färbung | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Klebsiella aerogenes | ||||||||||||
| (Hormaeche & Edwards 1960) Tindall et al. 2017 comb. nov. |
Von medizinischer Bedeutung ist die Antibiotikaresistenz, die einerseits natürlicherweise vorhanden ist, andererseits durch den horizontalen Gentransfer zwischen verschiedenen gramnegativen Bakterienarten verursacht wird, was zu einer erworbenen Antibiotikaresistenz führt. Daran sind Plasmide beteiligt, dies sind kleine, ringförmige DNA-Moleküle, auf denen die genetische Information für die Resistenz verschlüsselt ist. Klebsiella aerogenes kann bei Patienten mit einem bereits geschwächten Immunsystem Infektionen verursachen. Als Erreger von im Krankenhaus erworbenen Infektionen – nosokomialen Infektionen – ist sie damit von zunehmender Bedeutung, vor allem wenn es sich um multiresistente Bakterienstämme handelt. Jedoch ist die Bedeutung als Krankheitserreger nicht mit der von Klebsiella pneumoniae vergleichbar. Das Genom des Bakterienstammes Klebsiella aerogenes KCTC 2190 wurde im Jahr 2012 vollständig sequenziert.
Merkmale
Erscheinungsbild
Klebsiella aerogenes weist kleine, stäbchenförmige Zellen auf, diese werden in der Gram-Färbung rosa bis rot angefärbt, sie sind gramnegativ. Eine Besonderheit ist, dass sie peritrich begeißelt sind, also durch Flagellen aktiv beweglich (motil) sind. Dieses Merkmal ist nicht typisch für die Gattung Klebsiella, sondern für Vertreter der verwandten Gattung Enterobacter.[1] Auf einem Nährboden gewachsene Bakterienkolonien weisen keine besondere Färbung auf.[2]
Wachstum und Stoffwechsel
Wie bei den Vertretern der Enterobacteriaceae üblich, verlaufen der Katalase-Test positiv und der Oxidase-Test negativ.[3] Klebsiella aerogenes ist fakultativ anaerob, d. h. sie kann mit oder ohne Sauerstoff wachsen. Als typische Gärung wird die 2,3-Butandiol-Gärung zur Energiegewinnung durchgeführt.[1][4] Weitere Informationen sind im Abschnitt Biochemische Nachweise zu finden. Für die Kultivierung sind einfache Nährmedien geeignet,[1] die Bakterien lassen sich beispielsweise auf Casein-Soja-Pepton-Agar (CASO-Agar) anzüchten.[5] Häufig werden Selektivnährmedien verwendet, die zur Isolierung und Unterscheidung von Vertretern der Enterobakterien geeignet sind, beispielsweise MacConkey-Agar und Eosin-Methylen-Blau-Agar (EMB).[2] Klebsiella aerogenes ist mesophil, optimales Wachstum erfolgt bei einer Temperatur von 30 °C, nach Inkubation über ein bis zwei Tage sind Kolonien sichtbar.[5]
Chemotaxonomische Merkmale
Klebsiella aerogenes weist in ihren Membranlipiden neben gesättigten und einfach ungesättigten Fettsäuren ebenfalls Fettsäuren mit einer Hydroxygruppe sowie Omega-alicyclische (ω-alicyclische) Fettsäuren auf, hierbei wird der griechische Kleinbuchstabe ω als Lokant verwendet. Omega-alicyclische Fettsäuren finden sich in größeren Mengen bei Vertretern der Bakteriengattung Alicyclobacillus. In größeren Anteilen (Prozentgehalt der Membranlipide) findet man bei K. aerogenes die gesättigte Palmitinsäure C16:0 zu 30,7 % und Myristinsäure C14:0 zu 9,4 %; die einfach ungesättigten Omega-n-Fettsäuren (in diesem Fall Omega-7-Fettsäuren) Vaccensäure C18:1 (ω−7) zu 22,0 % und Palmitoleinsäure C16:1 (ω−7) zu 16,5 %; die 3-Hydroxy-tetradecansäure C14:0 3-OH zu 8,7 % sowie eine ω-alicyclische Fettsäure C17:0 zu 8,2 %. Hierbei kann es sich um Omega-Cyclohexylundecansäure (ω-Cyclohexan C17:0) handeln, die Anzahl der C-Atome in der Ringstruktur wurde nicht angegeben.[6] Frühere Untersuchungen aus den 1960er Jahren an dem damals noch als „Aerobacter aerogenes“ bezeichneten Bakterium ergaben das Vorhandensein größerer Mengen (25 %) einer Fettsäure mit einem Cyclopropanring in der Kohlenstoffkette und insgesamt 17 C-Atomen, von der vermutet wurde, dass es sich um cis-9,10-Methylenhexadecansäure handelt. Sie ist homolog zu der Lactobacillsäure (cis-11,12-Methylenoctadecansäure) die ebenfalls einen Cyclopropanring und insgesamt 19 C-Atome aufweist, auch diese Fettsäure ist zu 6 % enthalten.[7] In einer weiteren Untersuchung von 1968 wurde der Anteil dieser beiden Fettsäuren allerdings als geringer angegeben (10 % bzw. 1 %).[8]
Genetik
Bereits in den 1970er Jahren wurde mit Hilfe der DNA-Hybridisierung gezeigt, dass die Bakterienart näher mit Klebsiella pneumoniae (etwa 55 % strukturelle Verwandtschaft) als mit Enterobacter cloacae (etwa 45 %) verwandt ist.[2] Der GC-Gehalt, also der Anteil der Nukleinbasen Guanin und Cytosin in der Bakterien-DNA, liegt beim Bakterienstamm KCTC 2190 (aus der Stammsammlung Korean Collection for Type Cultures) bei 54,8 Molprozent.[6] KCTC 2190 war der erste Stamm der damals noch als Enterobacter aerogenes bezeichneten Spezies, dessen Genom im Jahr 2012 vollständig sequenziert wurde.[4] Es handelt sich um den Typusstamm, der aus Sputum isoliert wurde.[5] Das Genom liegt als ringförmigen Bakterienchromosom vor und weist eine Größe von 5.280 Kilobasenpaaren (kb) auf, was in etwa mit der Genomgröße von Escherichia coli vergleichbar ist. Es sind 4.912 codierende Gene vorhanden, bei 3.824 davon handelt es sich um vermutete Gene im Hinblick auf die Annotation für Proteine. Außerdem wurden 84 tRNAs und 25 rRNAs identifiziert.[4] Seitdem wurden 150 Genome (bezogen auf das zirkuläre Bakterienchromosom) dieser Spezies sequenziert, außerdem 13 verschiedene Plasmide (Stand 2018).[9]
Plasmide tragen häufig die genetische Information für eine Antibiotikaresistenz (siehe unten) des Bakteriums, die Genprodukte sind Enzyme, die eine bestimmte chemische Struktur eines Antibiotikums verändern und dadurch die Wirkung des Arzneistoffes verhindern. Beispiele dafür sind die plasmidcodierte Penicillinase oder die plasmidcodierte Extended Spectrum β-Lactamase (ESBL).[2] Die Besonderheit von Plasmiden ist, dass sie durch horizontalen Gentransfer zwischen verschiedenen Bakterienarten ausgetauscht werden und somit die Antibiotikaresistenz „übertragen“ wird. Dies wird u. a. bei gramnegativen Bakterien, wie bei Vertretern der Gattung Klebsiella, Escherichia und Enterobacter beobachtet. In einem Fall aus Italien konnte dies 2016 quasi in vivo dokumentiert werden: Ein Patient auf der Intensivstation eines Krankenhauses in Rom wurde regelmäßig auf Carbapenem-resistente Enterobacteriaceae (CRE) untersucht. Er hatte sich nach einer neurochirurgischen Operation mit multiresistenten Klebsiella pneumoniae infiziert, was zu einer Sepsis und später zu einem Abszess in der Leistenregion führte, dort war ein Dialysekatheter zur Hämodialyse („Blutwäsche“) angebracht worden. Alle vom Patienten stammenden K. pneumoniae-Isolate waren resistent gegen Carbapeneme. Im Abszess wurde kurze Zeit später auch K. aerogenes gefunden, allerdings empfindlich (sensitiv) gegenüber den Carbapenemen. In der nächsten, drei Wochen später entnommenen Probe wurde ein Carbapenem-resistenter K. aerogenes-Stamm identifiziert. Die anschließende genetische Untersuchung mittels PCR (Polymerase-Kettenreaktion) und anderer Verfahren zeigte, dass die beiden resistenten Bakterienstämme jeweils ein Plasmid mit dem IncFIIK-Replikon und dem blaKPC-3-Gen aufwiesen. Das zuletzt genannte Gen codiert für die als KPC-3 bezeichnete Carbapenemase, die nach K. pneumoniae benannt wurde, aber nicht auf diese Bakterienart beschränkt ist. Die Plasmide von jeweils einem resistenten K. pneumoniae- und K. aerogenes-Isolat wurden nach Transformation mittels PCR als ein bereits bekanntes Plasmid (pK-pQIL IncFIIK) identifiziert, sie waren zu 100 % identisch mit diesem. Die Plasmide wurden außerdem durch Analyse des Restriktionsfragmentlängenpolymorphismus (RFLP) verglichen, wobei die Längen der Restriktionsfragmente nicht unterscheidbar waren. Somit ist davon auszugehen, dass das Plasmid von K. pneumoniae auf K. aerogenes übertragen wurde, während die Bakterien den Patienten besiedelten bzw. infizierten.[10]
Pathogenität
K. aerogenes wird durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 2 zugeordnet. Die Eintragung erfolgt als Enterobacter aerogenes = Klebsiella mobilis. Die Bemerkung ht zeigt an, dass das Bakterium pathogen für Mensch und Wirbeltiere ist, jedoch in der Regel keine Übertragung zwischen beiden Wirtsgruppen erfolgt.[11]
In der Fachliteratur werden oftmals gemeinsame Aussagen für E. cloacae und E. aerogenes gemacht, als die Vertreter der Gattung Enterobacter, die beim Menschen Infektionen verursachen können.[12] Nach Überführung der zuletzt genannten Bakterienart in die Gattung Klebsiella (2017) wird es in der medizinischen Fachwelt vermutlich einige Zeit dauern, bis dies zur Kenntnis genommen wird, ähnlich wie bei der Zuordnung von E. sakazakii zur Gattung Cronobacter als Cronobacter sakazakii (2008). Im Vergleich zu K. pneumoniae ist die Pathogenität von K. aerogenes geringer ausgeprägt, was u. a. an der verbreiteten Multiresistenz von K. pneumoniae liegt,[10] für diese Art sind im Krankenhaus erworbene Lungenentzündungen (nosokomiale Pneumonien) typisch. Weiterhin verfügt K. pneumoniae über mehr Virulenzfaktoren.[12] In der Literatur beschriebene Infektionen durch K. aerogenes (bzw. E. aerogenes) sind ebenfalls häufig nosokomial,[12] meist handelt es sich um Bakteriämien. K. aerogenes produziert Hämagglutinine, die bei Erythrozyten zu einer sichtbaren Verklumpung (Agglutination) führen.[2]
Biochemische Nachweise
Die nahe Verwandtschaft von K. aerogenes mit K. pneumoniae und E. cloacae zeigt sich auch in biochemischen Merkmalen, wie beispielsweise den vorhandenen Enzymen und den daraus resultierenden Stoffwechseleigenschaften. Darauf basierende Untersuchungen in den 1970er Jahren führten bereits zu dem Vorschlag, E. aerogenes in die Gattung Klebsiella zu stellen.[3] Diese biochemischen Merkmale können in einer Bunten Reihe zur Identifizierung von K. aerogenes verwendet werden bzw. zur Unterscheidung von anderen Arten, vorausgesetzt es finden sich genügend Unterscheidungsmerkmale. Eine systematische Untersuchung von Vertretern der Enterobacteriaceae wurde 1985 veröffentlicht.[13] Einige Ergebnisse dieser beiden Untersuchungen sind in der folgenden Tabelle aufgeführt:
| Testmethode, Merkmal | Klebsiella aerogenes | Klebsiella pneumoniae | Enterobacter cloacae |
|---|---|---|---|
| Motilität bei 36 °C | + (1) | – (1) | + |
| Indolbildung | – | – | – |
| Methylrotprobe | – | – | – |
| Acetoinbildung (VP-Test) | + | + | + |
| Citratverwertung | + | + | + |
| H2S-Bildung | – | – | – |
| Urease | – | + | d (1) |
| Hydrolyse von Gelatine | – | – | – |
| Äskulinspaltung | + | + | d |
| Gasbildung aus Glucose (2) | + | + | + |
| Säurebildung aus Arabinose | + | + | + |
| Säurebildung aus Glucose | + | + | + |
| Säurebildung aus Rhamnose | + | + | + |
| Säurebildung aus Xylose | + | + | + |
| Säurebildung aus Cellobiose | + | + | + |
| Säurebildung aus Lactose | + | + | d |
| ONPG-Test (3) | + | + | + |
| Säurebildung aus Maltose | + | + | + |
| Säurebildung aus Saccharose | + | + | + |
| Säurebildung aus Adonitol | + | + | d |
| Säurebildung aus Dulcitol | – | d | d |
| Säurebildung aus Glycerol | + | + | d |
| Säurebildung aus Inositol | + | + | – |
| Säurebildung aus Mannitol | + | + | + |
| Säurebildung aus Sorbitol | + | + | + |
| Arginindihydrolase (ADH) | – | – | + |
| Lysindecarboxylase (LDC) | + | + | – |
| Ornithindecarboxylase (ODC) | + | – | + |
Anmerkungen:
- + steht für ein positives, – für ein negatives Ergebnis, die Angabe d (für different) bedeutet „variabel“, d. h., dass es sowohl Stämme gibt, die ein positives Ergebnis hervorrufen können, wie auch Stämme, die dies nicht tun; oder die positive Reaktion ist zu schwach, um sie klar erkennen zu können.
- Farblich abgesetzt sind Reaktionen, bei denen die Verwertung von Kohlenhydraten geprüft wird, aufgeführt sind Monosaccharide, Disaccharide und Zuckeralkohole. Bei der Verwertung von Kohlenhydraten wird durch einen pH-Indikator geprüft, ob beim Abbau Säuren entstehen. Die Gasbildung kann mit Hilfe eines Durhamröhrchens gezeigt werden, in dem das Gas aufgefangen wird oder durch den OF-Test.
- Der ONPG-Test ist ein biochemischer Nachweis für das Enzym β-Galactosidase und dient als Bestätigungsreaktion der Verwertung des Disaccharids Lactose.
Diese Untersuchungen können für miniaturisierte Testsysteme verwendet werden. Typische Ergebnisse für K. aerogenes sind in der frei zugänglichen Datenbank BacDive der DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen) einsehbar.[5]
Systematik und Taxonomie
Die nahe Verwandtschaft von Klebsiella, Enterobacter, Serratia und einigen weiteren Gattungen führt dazu, dass sich die Systematik der Enterobacteriaceae seit Jahrzehnten beständig ändert, da sie an die Erkenntnisse der Wissenschaft angepasst wird. Die Gattung Enterobacter wurde 1960 von Hormaeche und Edwards definiert und enthielt die damals anerkannten Arten „Aerobacter aerogenes“ und „Aerobacter cloacae“. Ihr Ziel war es, durch die Beschreibung der typischen Merkmale den in dem Bereich tätigen Wissenschaftlern eine eindeutige Klassifizierung neu beschriebener Arten zu ermöglichen. Die zuvor als „Aerobacter“ bezeichnete Gattung enthielt sowohl motile wie auch nicht-motile Bakterien, wobei letztere der Gattung Klebsiella zuzuordnen wären.[1] Systematische biochemische Untersuchungen von Arten, die zum Tribus der Klebsielleae gezählt wurden, mit numerischer Auswertung durch Computerprogramme ergab 1971, dass E. aerogenes näher mit Klebsiella-Arten als mit E. cloacae verwandt ist. Die logische Konsequenz wäre gewesen, Enterobacter aerogenes in die Gattung Klebsiella zu überführen und als Klebsiella aerogenes zu bezeichnen. Dies war 1971 aber nicht möglich, da damals bereits ein Bakterium mit dem Namen „Klebsiella aerogenes“ (Kruse) Taylor et al. 1956 bekannt war. Folglich wurde ein neues Epitheton gewählt, durch die Bezeichnung als K. mobilis wurde darauf aufmerksam gemacht, dass diese Art, anders als für Vertreter der Gattung Klebsiella üblich, motil ist, also zur aktiven Bewegung durch Flagellen fähig ist.[6] Als Typusstamm wurde der Stamm CDC 819-56 (= NCTC 10006 = ATCC 13048) gewählt, da dieser als Neotyp für E. aerogenes vorgeschlagen war.[3]
1980 führte die Umsetzung der Approved Lists of Bacterial Names gemäß dem Bakteriologischen Code (International Code of Nomenclature of Bacteria, ICNB) dazu, dass sowohl K. mobilis wie auch E. aerogenes als gültige Bakteriennamen geführt wurden, es handelt sich um homotypische Synonyme, da beide Arten den gleichen Typusstamm aufweisen. Hingegen wurde der Name „Klebsiella aerogenes“ (Kruse) Taylor et al. 1956 für ungültig erklärt.[14] Tatsächlich wurde in der Fachwelt weiterhin die Bezeichnung als E. aerogenes bevorzugt, obwohl auch durch die neue Möglichkeit genetischer Untersuchungen bestätigt wurde, dass das Bakterium zur Gattung Klebsiella gehört. Mit Hilfe der DNA-Hybridisierung wurde gezeigt, dass die Bakterienart näher mit Klebsiella pneumoniae (etwa 55 % strukturelle Verwandtschaft) als mit Enterobacter cloacae (etwa 45 %) verwandt ist. F. Grimont und P. A. D. Grimont wiesen 2006 darauf hin, dass es vernünftig sei, E. aerogenes in die Gattung Klebsiella zu stellen, allein die Umsetzung in der Nomenklatur sei das Problem.[2] Dies setzten Brian J. Tindall, Granger Sutton und George M. Garrity 2017 mit ihrem Fachartikel um, in dem unter Nennung aller adäquaten Regeln des Internationalen Codes der Nomenklatur der Bakterien (ICNB) bewiesen wurde, dass das 1971 gewählte Epitheton K. mobilis unzulässig ist und die Bakterienart als Klebsiella aerogenes zu benennen ist.[6]
Klebsiella aerogenes (Hormaeche & Edwards 1960) Tindall et al. 2017 comb. nov. ist durch den Typusstamm NCTC 10006 (= ATCC 13048 = CCUG 1429 = DSM 30053 = JCM 1235 = KCTC 2190 = LMG 2094 = NBRC 13534, ) definiert. Synonyme sind:[5][6][15]
- „Aerobacter aerogenes“ Hormaeche & Edwards 1958 → diese Bezeichnung ist nicht in den Approved Lists 1980 aufgeführt und damit ungültig
- Enterobacter aerogenes Hormaeche & Edwards 1960 → als Basonym
- Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980) → dieses Synonym darf nicht mehr verwendet werden, da das Epitheton unzulässig ist
Klebsiella aerogenes (Hormaeche & Edwards 1960) Tindall et al. 2017 comb. nov. ist nicht identisch mit „Klebsiella aerogenes“ (Kruse) Taylor et al. 1956. Dieses Bakterium wurde dem Taxon Klebsiella pneumoniae subsp. pneumoniae zugeordnet.[6] Das Epitheton K. aerogenes ist die latinisierte Kombination aus den altgriechischen Wörtern für ‚Luft‘ und ‚produzieren‘ und bedeutet ‚gasproduzierend‘.[15] Dadurch wird auf die Produktion von Kohlenstoffdioxid (CO2) und Wasserstoff (H2) beim fermentativen Abbau von Glucose aufmerksam gemacht.[1]
Bedeutung
Vorkommen
K. aerogenes ist ubiquitär verbreitet. Ihre natürlichen Habitate sind Gewässer, Abwasser, Erdboden, Rohmilch und der Darm von Menschen und Tieren.[2] Medizinisches Untersuchungsmaterial, in dem sie nachgewiesen wurde, umfasst Urin, Faeces, Blut, Sputum, Wunden und Liquor cerebrospinalis (Gehirn-Rückenmarks-Flüssigkeit).[13]
Biotechnologie
Die Bildung von Wasserstoff (H2) im Rahmen der Gärung von Klebsiella aerogenes kann biotechnologisch genutzt werden, um Biowasserstoff herzustellen. Als Ausgangsmaterial kann dazu Reisstroh verwendet werden. Im Vergleich zu strikt anaeroben Bakterien, wie beispielsweise Clostridien, die ebenfalls Wasserstoff bilden, ist die Fermentation mit der fakultativ anaeroben K. aerogenes einfacher, da Sauerstoff nicht komplett entfernt werden muss.[16] Ein weiteres Produkt der Gärung von K. aerogenes ist 2,3-Butandiol, das als Ausgangsstoff für die chemische Industrie von Bedeutung ist. Als preiswerter Rohstoff für den fermentativen Abbau kann Bagasse benutzt werden, die bei der Zuckerfabrikation aus Zuckerrohr anfällt. Zur Steigerung der Ausbeute wird ein gentechnisch veränderter Bakterienstamm eingesetzt, der Xylose besser verwerten kann.[17]
Antibiotikaresistenzen
K. aerogenes verfügt über eine natürliche Antibiotikaresistenz gegen Benzylpenicillin, Oxacillin und Ampicillin (allesamt β-Lactam-Antibiotika).[5] Bei zusätzlich dazu auftretenden, erworbenen (engl. “acquired”) Resistenzen ist K. aerogenes genauso wie E. cloacae problematisch als opportunistischer Krankheitserreger,[2] beide Arten sind als Erreger nosokomialer Infektionen von zunehmender Bedeutung.[18] Die Resistenz gegen die zu den Beta-Lactam-Antibiotika zählendenen Carboxypenicillinen (z. B. Carbenicillin) und Ureidopenicillinen (z. B. Mezlocillin) sowie Cephalosporinen der 3. Generation (z. B. Cefotaxim) kann durch eine plasmidcodierte Extended Spectrum β-Lactamase (ESBL) verursacht werden.[2] Ein Fallbericht ist im Abschnitt Genetik beschrieben. Dort wurde ein K. aerogenes-Isolat entdeckt, das eine Carbapenemase (KPC-3) produziert und somit resistent gegenüber Carbapenemen ist. Carbapenemase-produzierende Enterobacteriaceae (CPE) werden in Deutschland als 3MRGN oder 4MRGN (multiresistente gramnegative Bakterien) klassifiziert.[18] In der Erregergruppe CPE ist K. pneumoniae überproportional vertreten, während E. cloacae und K. aerogenes selten gefunden werden. Vereinzelt gibt es jedoch Berichte aus verschiedenen Ländern (z. B. Italien, Portugal, China) über das Auftreten von K. aerogenes mit Carbapenem-Resistenz.[10]
Die Antibiotikaresistenz wird im Labor durch ein Antibiogramm ermittelt, häufig unter Verwendung der Kirby-Bauer-Methode auf Müller-Hinton-Agar. Auf oder in diesem Nährmedium wird eine Suspension des Bakteriums verteilt und kleine, kreisförmige Filterplättchen aufgelegt, die verschiedene Antibiotika in definierter Menge enthalten. Wenn das Antibiotikum wirksam ist, erscheinen nach Inkubation kreisförmige Hemmhöfe im Bakterienrasen, deren Durchmesser ermittelt wird. Falls das Bakterium resistent gegen den Arzneistoff ist, fehlt der Hemmhof und der Durchmesser wird mit 0 mm angegeben. Typische Ergebnisse für Antibiogramme von K. aerogenes sind in der Datenbank BacDive der DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen) einsehbar.[5]
Überwachungsprogramme, die sogenannten Surveillances, dienen dazu, epidemiologisch nutzbare Informationen über Infektionskrankheiten und die daran beteiligten, möglicherweise resistenten Krankheitserreger zu sammeln. Das Robert Koch-Institut (RKI) hat 2015 eine Übersicht der Surveillance-Systeme für Erreger und Resistenz für Deutschland herausgegeben. In den Programmen Surveillance der Antibiotika‐Anwendung und der bakteriellen Resistenzen auf Intensivstationen (SARI) und Antibiotika‐Resistenz‐Monitoring in Niedersachsen (ARMIN) wird K. aerogenes jedoch nicht erfasst, K. pneumoniae und E. cloacae hingegen schon.[19] Berichte des ECDC (Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten), beispielsweise über das Programm European survey on carbapenemase-producing Enterobacteriaceae (EuSCAPE) und The European Surveillance System (TESSy) liefern Daten über die Antibiotikaresistenzen von Enterobacter spp. (siehe dort), ohne die einzelnen Arten näher zu spezifizieren.
Medizinische Bedeutung
Die Bedeutung von K. aerogenes als Erreger von Infektionen, speziell von nosokomialen Infektionen, ist nicht vergleichbar mit der von K. pneumoniae.[12] Jedoch ist zu beachten, dass die drei verwandten Arten K. pneumoniae, K. aerogenes und E. cloacae zur menschlichen Darmflora gehören und damit die Möglichkeit gegeben ist, dass die Bakterien andere Körperregionen kolonisieren können und bei immunsupprimierten Patienten so Infektionen verursachen können. Weitere Möglichkeiten zur Verbreitung sind Kontaminationen über die Hände des Pflegepersonals bei mangelnder Hygiene oder Kreuzkontaminationen durch Gegenstände. Risikofaktoren für eine Infektion sind vor allem ein längerer Aufenthalt auf der Intensivstation eines Krankenhauses, Erkrankungen des Gastrointestinaltrakts, bei denen es beispielsweise zu einem Durchbruch des Darms kommt, Verbrennungen sowie Anwendung invasiver medizinischer Verfahren, z. B. beim Einführen von Kathetern. Im Hinblick auf multiresistente K. aerogenes oder E. cloacae wird eine lange und intensive Antibiotikatherapie als ein Risikofaktor diskutiert, da durch die Verwendung von Beta-Lactam-Antibiotika die Resistenzentwicklung gefördert wird, durch Selektion der Bakterienarten, die über einen induzierbaren Genabschnitt (dieser wird als ampC bezeichnet) verfügen, dessen Genprodukt das Enzym Cephalosporinase ist.[18]
Von dem Krankenhaus-Infektions-Surveillance-System (KISS) werden nosokomiale Infektionen überwacht. Die am System beteiligten Krankenhäuser stellen Daten zu den ermittelten Krankheitserregern zur Verfügung, diese beinhalten die Erregergruppen 3MRGN und 4MRGN (multiresistente gramnegative Bakterien), in den Referenzdaten der Jahre 2013 bis 2016 ist K. aerogenes jedoch nicht erfasst, im Gegensatz zu K. pneumoniae und E. cloacae.[20]
Weblinks
- Taxonomy Browser Klebsiella aerogenes. In: Website des National Center for Biotechnology Information (NCBI). Abgerufen am 24. Mai 2018.
- Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ): Klebsiella aerogenes, Type Strain. In: Website BacDive. Abgerufen am 28. Mai 2018.
Quellen
Literatur
- Brian J. Tindall, Granger Sutton, George M. Garrity: Enterobacter aerogenes Hormaeche and Edwards 1960 (Approved Lists 1980) and Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980) share the same nomenclatural type (ATCC 13048) on the Approved Lists and are homotypic synonyms, with consequences for the name Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980). In: International Journal of Systematic and Evolutionary Microbiology. Band 67, Februar 2017, ISSN 1466-5026, S. 502–504, doi:10.1099/ijsem.0.001572.
- Francine Grimont, Patrick A. D. Grimont: The Genus Enterobacter (Chapter 3.3.11). In: Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6: Proteobacteria: Gamma Subclass. 3. Auflage. Springer-Verlag, New York 2006, ISBN 978-0-387-25496-8, S. 197–214, doi:10.1007/0-387-30746-X_9.
Einzelnachweise
- E. Hormaeche, P. R. Edwards: A proposed genus Enterobacter. In: International Bulletin of Bacteriological Nomenclature and Taxonomy. Band 10, Nr. 2, April 1960, S. 71–74. ISSN 0096-266X. doi:10.1099/0096266X-10-2-71.
- F. Grimont, P. A. D. Grimont: The Genus Enterobacter. Introduction. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 197–214.
- Shoshana Bascomb, Stephen P. Lapage, W. R. Willcox, M. A. Curtis: Numerical Classification of the Tribe Klebsielleae. In: Journal of General Microbiology. Band 66, Nr. 3, 1971, S. 279–295, doi:10.1099/00221287-66-3-279.
- Sang Heum Shin, Sewhan Kim u. a.: Complete Genome Sequence of Enterobacter aerogenes KCTC 2190. In: Journal of Bacteriology. Band 194, Nr. 9, Mai 2012, S. 2373–2374, doi:10.1128/JB.00028-12, PMID 22493190, PMC 3347075 (freier Volltext).
- Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ): Klebsiella aerogenes, Type Strain. In: Webseite BacDive. Abgerufen am 28. Mai 2018.
- B. J. Tindall, G. Sutton, G. M. Garrity: Enterobacter aerogenes Hormaeche and Edwards 1960 (Approved Lists 1980) and Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980) share the same nomenclatural type (ATCC 13048) on the Approved Lists and are homotypic synonyms, with consequences for the name Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980). In: International Journal of Systematic and Evolutionary Microbiology. Band 67, 2017, S. 502–504, doi:10.1099/ijsem.0.001572.
- William M. O'Leary: S-adenosylmethionine in the biosynthesis of bacterial fatty acids. In: Journal of Bacteriology. Band 84, Nr. 5, November 1962, S. 967–972, PMID 16561975, PMC 277996 (freier Volltext).
- John I. Gallin, William M. O'Leary: Lipoidal Components of Bacterial Lipopolysaccharides: Nature and Distribution of Fatty Acids in Aerobacter aerogenes. In: Journal of Bacteriology. Band 96, Nr. 3, September 1968, S. 660–664, PMID 5732501, PMC 252356 (freier Volltext).
- Klebsiella aerogenes. In: Webseite Genome des National Center for Biotechnology Information (NCBI). Abgerufen am 25. Mai 2018.
- Carolina Venditti, Laura Villa u. a.: Isolation of KPC 3-producing Enterobacter aerogenes in a patient colonized by MDR Klebsiella pneumoniae. In: New Microbiologica. Band 39, Nr. 4, Oktober 2016, S. 310–313, PMID 27284988.
- TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. August 2015, S. 115, 164, abgerufen am 29. März 2018 (letzte Änderung vom 31. März 2017).
- Subhash Chandra Parija: Coliforms: Klebsiella, Enterobacter (Chapter 31). In: Textbook of Microbiology and Immunology. 2. Auflage. Elsevier India, Haryana 2012, ISBN 978-81-312-2810-4, S. 261–264.
- J. J. Farmer III, B. R. Davis u. a.: Biochemical identification of new species and biogroups of Enterobacteriaceae isolated from clinical specimens. In: Journal of Clinical Microbiology. Band 21, Nr. 1, Januar 1985, S. 46–76, ISSN 0095-1137. PMID 3881471, PMC 271578 (freier Volltext) (Review).
- Approved Lists of Bacterial Names. In: V. B. D. Skerman, Vicki McGowan, P. H. A. Sneath (Hrsg.): International Journal of Systematic Bacteriology. Band 30, Nr. 1, 1980, S. 362, doi:10.1099/00207713-30-1-225.
- Jean Euzéby, Aidan C. Parte: Genus Klebsiella. In: List of Prokaryotic names with Standing in Nomenclature (LPSN). Abgerufen am 24. Mai 2018.
- Nooshin Asadi, Hamid Zilouei: Optimization of organosolv pretreatment of rice straw for enhanced biohydrogen production using Enterobacter aerogenes. In: Bioresource Technology. 227, März 2017, S. 335–344, doi:10.1016/j.biortech.2016.12.073.
- Jaeyong Um, Duck Gyun Kim u. a.: Metabolic engineering of Enterobacter aerogenes for 2,3-butanediol production from sugarcane bagasse hydrolysate. In: Bioresource Technology. Band 245, Part B, Dezember 2017, S. 1567–1574, doi:10.1016/j.biortech.2017.05.166, PMID 28596073.
- Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut (RKI): Hygienemaßnahmen bei Infektionen oder Besiedlung mit multiresistenten gramnegativen Stäbchen. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 55, 2012, S. 1311–1354, ISSN 1437-1588. doi:10.1007/s00103-012-1549-5.
- Robert Koch-Institut (Hrsg.): Übersicht der Surveillance-Systeme für Erreger und Resistenz. 29. Januar 2015, S. 1–3 (Online + PDF; 141 KB [abgerufen am 30. März 2018]).
- KISS Krankenhaus-Infektions-Surveillance-System – Erreger-Surveillance im Modul ITS-KISS. (PDF; 559 KB) Referenzdaten 2013–2016, Stratifizierung: Alle Stationen. In: Nationales Referenzzentrum für Surveillance von nosokomialen Infektionen. 2. Mai 2017, S. 1–157, abgerufen am 27. Mai 2018.