Glucokinase
Glucokinase (GCK) (Hexokinase IV) ist der Name für ein Enzym aus der Gruppe der Hexokinasen, das in Wirbeltieren (neben anderen Hexosen) D-Glucose zu Glucose-6-phosphat phosphoryliert.
| Glucokinase | ||
|---|---|---|
| ||
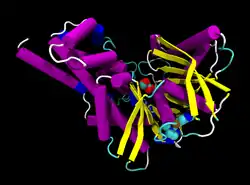
| Bändermodell der menschlichen Glucokinase mit Glucose und Aktivator MRK als Kalotten, nach PDB 3F9M | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 465 Aminosäuren | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name | GCK | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.1.2, Kinase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | D-Glucose + ATP | |
| Produkte | D-Glucose-6-phosphat + ADP | |
| Vorkommen | ||
| Homologie-Familie | Glucokinase | |
| Übergeordnetes Taxon | Euteleostomi | |
Beim Menschen gibt es drei Isoformen des Enzyms; in der Leber wird so die Speicherung von Zucker in Form von Glykogen eingeleitet; im Pankreas reguliert die Reaktion die Ausschüttung von Insulin. Mutationen am GCK-Gen können eine spezielle Form des frühen Diabetes (MODY 2) und eine angeborene Hypoglykämie (HHF3) verursachen.
Weitere Hexokinasen (die andere Hexosen als Substrat akzeptieren, EC 2.7.1.1) sind im Gehirn, den Muskeln, den Augen, Nieren und im Darm lokalisiert.[1][2]
Funktion
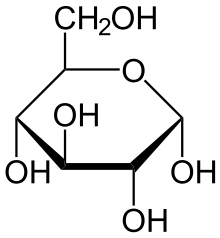 + ATP
+ ATP
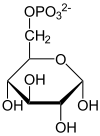 + ADP
+ ADP
Beim Eintritt in die Glykolyse wird Glucose (Glc) am C6-Atom zu Glucose-6-phosphat (G-6P) phosphoryliert. Für die Katalyse dieser Reaktion gibt es mehrere Enzyme, Hexokinasen und die Glucokinase. Die Glucokinase ist ausschließlich in Leber (Hepatozyten) und β-Zellen der Pankreas zu finden, im übrigen Körper wird die Phosphorylierung der Glucose durch die Hexokinasen vorgenommen.[3][4]
Hexokinasen
Die Hexokinasen binden Glucose mit hoher Affinität entsprechend einem Km-Wert von 0,01 mM und sind durch ihr Endprodukt hemmbar. In Erythrozyten fungiert das im Rapoport-Luebering-Zyklus, einem Nebenweg der Glykolyse, durch das Enzym Bisphosphoglyceratmutase gebildete Intermediat 2,3-Diphosphoglycerat ebenfalls als Inhibitor der Hexokinasen.[5][6]
Aufgrund des geringen Km-Wertes arbeiten die Hexokinasen bezüglich der Glucose sowohl bei einer Blutglucosekonzentration von 4 mmol/l in der Postresorptionsphase als auch bei 8–10 mmol/l Glucose in der Resorptionsphase im Sättigungsbereich. Die Hexokinasen weisen also einen Km-Wert für Glucose auf, der weit unterhalb der niedrigsten Blutglucosekonzentration liegt. Dadurch ist gewährleistet, dass Muskel, Hirn etc. unabhängig von der Stoffwechsellage bei Bedarf Glucose aus dem Blut in die Glykolyse einschleusen können.
Glucokinase
Die Glucokinase weist eine geringere Affinität auf, ihr Km-Wert liegt im Bereich der Serum-Glucosekonzentration, sie ist durch G-6P nicht hemmbar und zeigt (positiv) kooperatives Bindungsverhalten. Dies ist für ihre Rolle im Blutzucker-Sensorsystem des Pankreas von entscheidender Bedeutung.
Die Regulation der Glucokinase erfolgt durch reversible Komplexierung mit dem Glucokinase-Regulator-Protein (GkRP). Die Bindung wird stimuliert durch Fructose-6-phosphat und Sorbitol-6-phosphat, aber behindert durch Fructose-1-phosphat. Letzteres erhöht also die Glucokinase-Aktivität. Nach Translokation in den Nukleus wird der Komplex bei hohem Glukosespiegel getrennt und die Glucokinase wieder ins Zytosol geschafft.[7]
Vergleich
In der folgenden Abbildung werden die Sättigungskurven von Glucokinase und Hexokinase verglichen
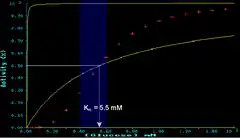
Abbildung: Glucose-Sättigungskurven für Hexokinase (gelbe obere Hyperbel entsprechend Km = 0.01 mM) und eine hypothetische Kinase mit Km = 5,5 mM (gelbe, flach verlaufende untere Hyperbel). Die Glucokinase des Pankreas folgt den Messpunkten zwischen diesen Extremen, sie besitzt die folgenden Kooperativitätsparameter nach Hill: Km(av) = 5.5 mM (mittlere Michaeliskonstante); nH = 3 (Hill Koeffizient); Der blau unterlegte Bereich kennzeichnet den Schwankungsbereich der Blutzuckerkonzentration, d. h. der Blut-Glucose.
Die Kurve der Glucokinase weist demnach einen linearen Verlauf im Bereich physiologischer Blutzucker-Konzentrationen auf, d. h. bei Glc-Anstieg wird proportional mehr Glc in G-6P umgewandelt und dabei dem Blutkreislauf entzogen.
Kürzlich wurde durch systematisches Screening synthetischer Verbindungen ein Aktivator (RO-28-1675) der Glucokinase entdeckt, der sowohl auf das Leber- als auch das Pankreasenzym wirkt. Dieser könnte ein neues Therapieprinzip für Diabetes mellitus (Typ 2) ermöglichen.
Weblinks
Einzelnachweise
- PROSITE documentation PDOC00370. Hexokinasen. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- UniProt P35557
- Scott Goodman: Carbohydrate Metabolism. In: kumc.edu. University of Kansas, 1999, abgerufen am 20. Oktober 2019.
- Sigurd Lenzen: A Fresh View of Glycolysis and Glucokinase Regulation: History and Current Status. In: Journal of Biological Chemistry. Band 289, 2014, S. 12189, doi:10.1074/jbc.R114.557314.
- F. Liu, Q. Dong, A. M. Myers, H. J. Fromm: Expression of human brain hexokinase in Escherichia coli: purification and characterization of the expressed enzyme. In: Biochem. Biophys. Res. Commun.. 177, Nr. 1, Mai 1991, S. 305–11. PMID 2043117.
- F. Palma, D. Agostini, P. Mason et al.: Purification and characterization of the carboxyl-domain of human hexokinase type III expressed as fusion protein. In: Mol. Cell. Biochem.. 155, Nr. 1, Februar 1996, S. 23–9. PMID 8717435.
- reactome.org: Negative Regulation of Glucokinase by Glucokinase Regulatory Protein