Enzymspezifität
Der Begriff Enzymspezifität oder Substratspezifität bezeichnet das Phänomen, dass Enzyme zumeist nur ein Substrat bzw. eine beschränkte Anzahl von Substraten in ihrem aktiven Zentrum aufnehmen können, was einen Aspekt des Schlüssel-Schloss-Prinzips beschreibt. Dieser Sachverhalt ist sowohl für den Organismus, der diese Enzyme besitzt, als auch für die Wissenschaft von fundamentaler Wichtigkeit.
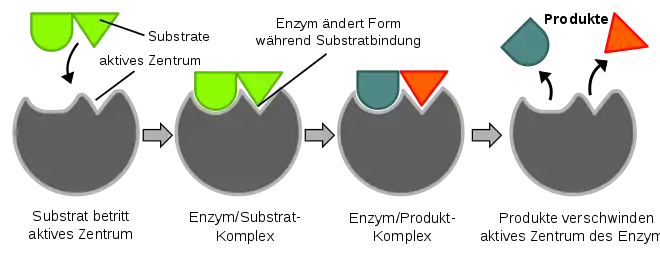
Faktoren der Spezifität
Enzyme sind meistens in der Anzahl der Substrate, die sie binden können, stark eingeschränkt. Dies wird durch die nötige Komplementarität zwischen dem Substrat und dem aktiven Zentrum des Enzyms begründet. Dabei unterscheidet man zwei Aspekte:
- Geometrische Komplementarität
Hierbei ist der stereochemische Gesichtspunkt gemeint, da das aktive Zentrum eines Enzyms nur für Substrate bestimmter Form und Größe zugänglich ist, zumal es zu keiner Abstoßung zwischen den Aminosäureresten im aktiven Zentrum und dem Substrat durch beispielsweise die Unterschreitung der Van-der-Waals-Radien kommen darf, sodass nicht lediglich die Form des Substrats, sondern in den meisten Fällen auch die funktionellen Gruppen, die die Form des Substrats bilden, für die geometrische Komplementarität von Bedeutung sind.
- Elektronische Komplementarität
Auch die elektrostatischen Wechselwirkungen zwischen aktiven Zentrum und Substrat sind bei dessen Bindung aneinander von großer Bedeutung. Dabei kommen vermehrt Wasserstoffbrückenbindungen, Dispersionskräfte und Dipol-Dipol-Wechselwirkungen zustande. All diese intramolekularen Kräfte sind sowohl für die Aufnahme des Substrats im aktiven Zentrum, als auch für die Stabilisierung des Substrats im selbigen verantwortlich. Seltener kommt es noch vor, dass im Sinne der Stabilisierung kovalente Bindungen zwischen Aminosäureresten des Enzyms und dem Substrat gebildet werden.
Durch solche Wechselwirkungen wird auch die konformationelle Anpassung des aktiven Zentrums eines Enzyms an das Substrat induziert, was als „Induced fit“ bezeichnet wird. Dieses Phänomen ist ebenfalls ein Grund für die meist hohe Spezifität von Enzymen, da das Induced-fit die enzymatische Umsetzung initiiert. So existieren Substrate, die im aktiven Zentrum eines Enzyms aufgenommen werden können, jedoch aufgrund einer anderen Ausrichtung oder Anordnung von funktionellen Gruppen keine vollständige elektronische Komplementarität besitzen, sodass eine – für die Umsetzung relevante – substratinduzierte Anpassung des aktiven Zentrums ausbleibt.
Beide Komplementaritäten und somit auch die Enzymspezifität sind letztendlich von der Tertiär- und Quartärstruktur des aktiven Zentrums eines Enzyms abhängig.
Arten der Spezifität
Eine Wirkungsspezifität beschreibt die durch den Aufbau des Enzyms bedingte Art der durch ein Enzym katalysierten chemischen Reaktionen, z. B. Hydrolasen, Hydroxylasen, Synthasen. Es ist relativ selten, dass ein Enzym nur ein Substrat binden kann. Viele Enzyme sind in der Lage, mehr als nur ein Substrat zu binden. Für dieses Phänomen gibt es mehrere Unterteilungen:
- Substratspezifität
Selten kommt es vor, dass ein aktives Zentrum eines Enzyms tatsächlich nur ein spezifisches Substrat binden kann. Eine Substratspezifität kommt bei Enzymen wie z. B. der Meerrettichperoxidase (HRP), der Maltase-Glucoamylase, sämtlichen RNasen und Restriktionsenzymen vor.
- Gruppenspezifität
Der wohl größte Anteil der biologisch aktiven Enzyme gehören dieser Kategorie an. Die meisten Enzyme nehmen nicht die Substrate (meistens Moleküle und Molekülionen) als Ganzes im aktiven Zentrum auf, sondern lediglich die Teile der Substrate, die umgewandelt werden müssen. Daher ist es auch möglich, dass Molekülstrukturen der Substrate, die außerhalb der enzymatisch-relevanten Bereiche liegen bis zu einem bestimmten Maß stark variieren können. Diese Begrenzung der Variabilität ist dadurch begründet, dass auch Substratstrukturen, die außerhalb der aktiven Zentren liegen, sterisch und durch elektrostatische Wechselwirkungen die Enzymstruktur verzerren können, wodurch die Aktivität des Enzyms geschwächt oder gar aufgehoben wird.
Jedoch können die Substrate von Enzymen, deren aktive Zentren die jeweiligen Substrate komplett aufnehmen, ebenfalls mehr oder weniger stark variieren. Dies ist möglich, wenn die funktionellen Gruppen der verschiedenen Substrate eines aktiven Zentrums ähnliche physikalische Eigenschaften, wie Polaritäten und Bindungslängen besitzen.
Nicht selten haben Enzyme auch eine so genannte Gruppenspezifität, was impliziert, dass deren aktive Zentren Substrate mit zum Teil verschiedensten Strukturen binden können, die lediglich die gleiche Anordnung einzelner funktioneller Gruppen besitzen. Dies lässt vermuten, dass das aktive Zentrum lediglich die Molekülstrukturen im Bereich der invariablen funktionellen Gruppen bindet. Ein Beispiel dafür ist die Alkoholdehydrogenase, die sowohl Methanol, Ethanol und – wenn auch bedeutend schwächer – höhere Alkanole binden und umsetzen kann.
Obwohl ein Enzym mehrere mögliche Substrate für dasselbe aktive Zentrum besitzen kann, ist die jeweilige Aktivität des Enzyms bei verschiedenen Substraten stets eine andere. Denn trotz der Komplementarität aller Substrate unterscheiden sie sich normalerweise in der Effektivität ihrer Umsetzung. So kann bei Verwendung verschiedener Substrate am gleichen aktiven Zentrum eines Enzyms beispielsweise die Reaktionsgeschwindigkeit variieren. Daher gibt es für Enzyme immer ein Substrat, das am effektivsten umgesetzt wird, wie dies schon an der Alkoholhydrogenase gezeigt wurde, dessen effektivstes Substrat das Methanol ist.
- Stereospezifität
Die meisten Enzyme sind so spezifisch, dass sie nur ein Enantiomer des Substrats aufnehmen können, da die Substituenten des Enantiomers eines Substrats nicht an den gleichen Stellen im aktiven Zentrum des entsprechenden Enzyms angreifen wie das primäre Substrat, woraus eine schwächere Bindung oder eine gänzliche Nichtaufnahme resultiert. Die Pfeiffersche Regel beschreibt den Zusammenhang zwischen der Affinität und der Enantioselektivität zwischen einem Enzym und einem chiralen Substrat.
Bedeutung für die Wissenschaft
Pharmakologie
Fast sämtliche wirksamen Medikamente beruhen in ihrer Funktionalität auf der Bindung und der daraus folgenden Hemmung oder Aktivierung von Proteinen, zu denen auch die Enzyme gehören. Dies stellt auch eine zentrale Aufgabe der Pharmakologie dar, da Stoffe meistens synthetisiert werden müssen, die in der Lage sind spezifisch an ein ganz bestimmtes Enzym zu binden, um dessen Funktionalität zu beeinflussen.
Biochemie
Auch in der Biochemie spielt es eine große Rolle, dass Enzyme nur bestimmte Stoffe umwandeln können. Dort agieren sie meist als labortechnische Werkzeuge. Beispielsweise benötigt man bei der Sequenzierung eines Genoms kleine DNA-Sequenzen. Um die Zerteilung der biologisch aktiven DNA, die aus ungefähr 3,2 Mrd. Basenpaaren besteht, in kleinere, wenige 100 Basenpaare große, DNA-Fragmente zu bewerkstelligen kommen Restriktionsenzyme zum Einsatz, die in der Lage sind die DNA an spezifischen Nukleotidabfolgen und auf spezielle Weise zu „zerschneiden“. Durch mangelnde Spezifität können solche Enzyme ihre Hydrolyse an anderen Stellen der DNA durchführen als ihre Erkennungssequenz dies üblicherweise eingrenzt. Dies kann z. B. durch suboptimale Umgebungsbedingungen bezüglich der Tonizität und fehlender Kofaktoren geschehen. Die Veränderung der Enzymspezifität ist ein Ziel des Protein-Engineering.
Analytik
Oft ist der analytischen Chemie die Aufgabe gestellt, organische und zum Teil hochmolekulare Stoffe nachzuweisen. Da jedoch beispielsweise nachzuweisende Proteine eine große Anzahl an chemischen Gruppen beherbergen können, ist diese Aufgabe durch klassische analytische Verfahren kaum lösbar. Aufgrund der Spezifität von Enzymen jedoch ist es möglich, einen ganz bestimmten Stoff mit einer hohen Wahrscheinlichkeit nachzuweisen. Diese Wahrscheinlichkeit ist von der Anzahl an Substraten, an die das gewählte Enzyme obendrein binden kann, abhängig. Eine sehr bekannte Verwendung dieser Methode ist der GOD-Test, mithilfe dessen man Glucose (beispielsweise in Urin) nachweisen kann. Dabei wird das Enzym Glucose-Oxidase verwendet, das spezifisch Glucose zu Glucono-δ-lacton oxidiert. Das entstehende Nebenprodukt Wasserstoffperoxid initiiert durch ein weiteres, spezifisch an Peroxide bindendes Enzym (Peroxidase) eine charakteristische Färbung.
Siehe auch
Literatur
- Donald Voet, Judith G. Voet und Charlotte W. Pratt: Lehrbuch der Biochemie. Wiley-VCH, ISBN 978-3-527-32667-9
- Rüdiger Faust, Peter W. Atkins und Loretta Jones: Chemie einfach alles. Wiley-VCH, ISBN 978-3-527-31579-6
- E. Buxbaum: Fundamentals of Protein Structure and Function (englisch), Springer, New York 2007. ISBN 9780387263526.
- P. Kaumaya: Protein Engineering, Intech Open, 2012. ISBN 978-953-51-0037-9. (Online-Version in Englisch)