Chymotrypsin B
Chymotrypsin B ist ein Verdauungsenzym, das in seiner Struktur dem Trypsin sehr ähnlich ist, sich aber von ihm insbesondere durch seine milchgerinnende Wirkung unterscheidet. Die humanen Chymotrypsine B und C gehören zu den Serinproteasen und sind innerhalb der höheren Säugetiere nahezu identisch. Mehrere andere Chymotrypsine von Meereslebewesen und Insekten wurden identifiziert.
| Chymotrypsin B | ||
|---|---|---|
| ||
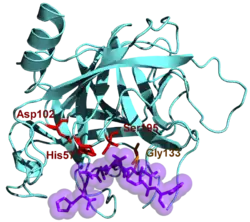
| Bändermodell von Chymotrypsin nach PDB 4cha. Die katalytische Triade – Aspartat-102, Histidin-57, Serin-195 – und ein Ausschnitt des Inhibitors Eglin C (violett) sind hervorgehoben | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 241 = 13+131+97 AA | |
| Präkursor | Chymotrypsinogen B (245 AA) | |
| Bezeichner | ||
| Gen-Name | CTRB1 | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B06AA04, S01KX01 | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.1, Serinprotease | |
| MEROPS | S01.152 | |
| Substrat | Tyr-+-Xaa, Trp-+-Xaa, Phe-+-Xaa, Leu-+-Xaa | |
| Vorkommen | ||
| Homologie-Familie | Trypsin | |
| Übergeordnetes Taxon | Lebewesen | |
Chymotrypsin B wird im Pankreas in Form einer inaktiven Zymogen-Vorstufe (Chymotrypsinogen) gebildet. Die Spaltung von Chymotrypsinogen in drei Untereinheiten erfolgt durch Trypsin im Dünndarm, der Zusammenbau der Untereinheiten wandelt es zur aktiven Form (Chymotrypsin) um.
Geschichte
Moses Kunitz (1887–1978) und John Howard Northrop stellten Chymotrypsin 1935 kristallin her; 1947 erkannte C. Jacobsen, dass es verschiedene Modifikationen gibt.[1]
1962 nutzte T. L. Shields es zur Therapie von Herpes Zoster und auch A. Rosanova erzielte 1967 Erfolge bei der Behandlung von Herpes Zoster, Viruspneumonie und grippalem Infekt.[1]
Anwendung in der Medizin
Chymotrypsin ist als Wirkstoff Bestandteil von Enzympräparaten, die bei Thrombophlebitis und anderen Entzündungen angewendet werden.
Auch wird es in der Augenheilkunde als Proteolytikum lokal verwendet.[1]
Die Bestimmung von Chymotrypsin im Stuhl kann Aufschluss über verschiedene Erkrankungen der Bauchspeicheldrüse geben, insbesondere die exokrine Pankreasinsuffizienz. Die Bestimmung der Pankreas-Elastase im Stuhl gilt aber als empfindlicher.[2]
Biochemie
Chymotrypsin B spaltet bevorzugt an Peptidbindungen, deren Carbonylgruppe von einer aromatischen Aminosäure (L-Tyrosin-, L-Tryptophan- oder L-Phenylalanin) oder von L-Leucin stammt. Es gehört damit zu den Endopeptidasen. Aufgrund des Wirkmechanismus mit der katalytischen Triade aus L-Aspartat, L-Histidin und L-Serin wird es den Serinproteasen zugeordnet.
Diese drei polaren und in Serinproteasen hochkonservierten Aminosäuren finden sich auch in Trypsin und in der Elastase.
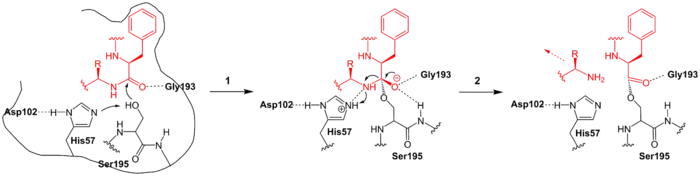
Ein wahrscheinlicher enzymatischer Mechanismus ist in den unteren Abbildungen dargestellt.[3] Hierbei bindet das zu spaltende Polypeptid an Chymotrypsin B, wobei die im Substrat enthaltene hydrophobe Aminosäure (in der Abbildung ein Phenylalanin, rot) spezifisch in einer Bindungstasche gelangt. Dieses wird auch von einem Glycin (Gly193) durch Wasserstoffbrückenbindungen stabilisiert.
Im ersten Reaktionsschritt (1) erfolgt ein nukleophiler Angriff des katalytischen Serins (Ser195) an die Peptidbindung, die gespalten werden soll. Das Histidin-57 (His-57) fungiert hierbei als Base, da es ein Proton von Ser195 entzieht. Dabei entsteht ein kurzlebiger, tetraedrischer Übergangszustand, bei dem anschließend eine Bindungsspaltung zum restlichen Substratpeptid erfolgt (2). Dieses verlässt das Enzym. Das übriggebliebene Acyl-Enzym-Intermediat ist hingegen stabil und kann auch mit Hilfe von Substratanaloga isoliert werden.[4]
Durch Einlagerung von Wasser (Schritt 3, blau) reagiert dieses als nukleophiles Agens und greift den Carbonylkohlenstoff des Intermediates an. His57 fungiert hierbei als Base und nimmt ein Proton des Wassers auf. Es bildet sich wieder ein tetraedrischer Übergangszustand (4). Dieser ist kurzlebig (5). Dieser setzt das restliche Polypeptid frei und regeneriert infolgedessen das Ser195. Ein neuer Zyklus kann beginnen.

Einzelnachweise
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 115.
- Olav Hagemann: Chymotrypsin im Stuhl. In: laborlexikon.de. Abgerufen am 23. November 2016.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle: Eine Einführung in die Organische Chemie. Helvetica Chimica Acta / Wiley-VCH 2006; ISBN 978-3-906390-29-1; S. 453.
- Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Thomsom Learning Inc.; 3. Auflage 2005; ISBN 0-534-41020-0; S. 434ff.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Trypsin and Chymotrypsin. (engl.)