Histidin
Histidin, abgekürzt His oder H, ist in der natürlichen L-Form eine bedingt essentielle,[4] proteinogene, α-Aminosäure und wurde 1896 unabhängig voneinander von Sven Gustaf Hedin und Albrecht Kossel entdeckt.[5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
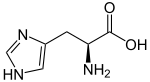 | ||||||||||||||||||||||
| Struktur von L-Histidin, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Histidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H9N3O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V06DE00 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 155,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
| |||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (38,2 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Histidin zählt gemeinsam mit den Aminosäuren Arginin und Lysin zu den basischen Aminosäuren, die man wegen ihrer sechs C-Atome auch als Hexonbasen bezeichnet. Basische Aminosäuren besitzen zusätzlich zur obligatorischen α-Aminogruppe eine weitere basische Gruppe. Im Histidin ist der Ring des heterocyclischen Amins Imidazol die basische Gruppe, der gleichzeitig auch die Aromatizität des Histidins bedingt. Damit zählt Histidin auch zu den aromatischen Aminosäuren, ebenso wie Phenylalanin, Tyrosin und Tryptophan.[6]
Isomere
Histidin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. Die L-Form [Synonym: (S)-Histidin] kommt in der Natur als Proteinbestandteil vor.
In diesem Artikel betreffen die Angaben zur Physiologie allein L-Histidin. Wenn in diesem Text und in der wissenschaftlichen Literatur ohne jeden Zusatz Histidin erwähnt wird, ist stets L-Histidin gemeint. Racemisches DL-Histidin [Synonym: (RS)-Histidin] und enantiomerenreines D-Histidin [Synonym: (R)-Histidin] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung.
Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.[7]
| Isomere von Histidin | ||
| Name | L-Histidin | D-Histidin |
| Andere Namen | (S)-Histidin | (R)-Histidin |
| Strukturformel |  | 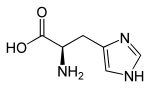 |
| CAS-Nummer | 71-00-1 | 351-50-8 |
| 4998-57-6 (Racemat) | ||
| EG-Nummer | 200-745-3 | 206-513-8 |
| 225-660-9 (Racemat) | ||
| ECHA-Infocard | 100.000.678 | 100.005.922 |
| 100.023.328 (Racemat) | ||
| PubChem | 6274 | 71083 |
| 773 (Racemat) | ||
| DrugBank | DB00117 | − |
| − (Racemat) | ||
| FL-Nummer | 17.008 | - |
| Wikidata | Q485277 | Q27077043 |
| Q27103201 (Racemat) | ||
Eigenschaften

Der Imidazolring von Histidin unterliegt einer Tautomerie, genauer einer Imin-Enamin-Tautomerie.
Diese Umlagerung ist reversibel und beide Tautomere stehen im Gleichgewicht. Hierbei kann das an eines der Stickstoffatome des Rings gebundene Wasserstoffatom zum anderen Stickstoffatom wechseln. Zugleich verschiebt sich die Doppelbindung zwischen beiden Stickstoffatomen im Ring.
Ein isoelektrischer Punkt von 7,59[8] macht Histidin zu einer im physiologischen Milieu neutralen Aminosäure; ihr Van-der-Waals-Volumen beträgt 118, der Hydrophobizitätsgrad −3,2. Histidin bildet mit einer geeigneten Diazo-Komponente einen orangen Azofarbstoff und lässt sich auf diese Weise mit der Pauly-Reaktion qualitativ nachweisen.[9]
Vorkommen
L-Histidin kommt in jungem Pflanzengewebe (gr. ἱστός: Gewebe) vor, daher leitet sich auch der Name ab. L-Histidin erfüllt eine wichtige Aufgabe als Blutpuffer im Hämoglobin (siehe auch Funktionen).
L-Histidin ist in proteinreichen Nahrungsmitteln enthalten. Die folgenden Beispiele geben einen Überblick über Histidingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Histidin am Gesamtprotein angegeben:[10]
| Lebensmittel | Protein | Histidin | Anteil |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 678 mg | 3,2 % |
| Hähnchenbrustfilet, roh | 21,23 g | 791 mg | 3,7 % |
| Lachs, roh | 20,42 g | 549 mg | 2,7 % |
| Hühnerei | 12,57 g | 309 mg | 2,4 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 89 mg | 2,7 % |
| Walnüsse | 15,23 g | 391 mg | 2,6 % |
| Weizenkeime, getrocknet | 23,15 g | 643 mg | 2,8 % |
| Weizen-Vollkornmehl | 13,70 g | 317 mg | 2,3 % |
| Mais-Vollkornmehl | 6,93 g | 211 mg | 3,0 % |
| Reis, ungeschält | 7,94 g | 202 mg | 2,5 % |
| Sojabohnen, getrocknet | 36,49 g | 1097 mg | 3,0 % |
| Erbsen, getrocknet | 24,55 g | 597 mg | 2,4 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Histidin als Proteinbestandteil, jedoch kein freies L-Histidin.
Es ist auch Bestandteil mancher Medikamente und Vitaminpräparate.
Synthese
Im Stoffwechsel wird L-Histidin aus Phosphoribosylpyrophosphat (PRPP) und ATP in einer Abfolge von elf Reaktionen, die von acht Enzymen katalysiert werden, über mehrere Zwischenprodukte, u. a. Imidazolglycerinphosphat, synthetisiert.
L-Histidin ist ein Vorläufer in der Biosynthese von Histamin und Carnosin.
Abbau
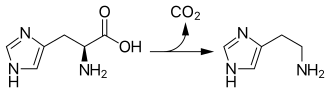
Für den Abbau inklusive Strukturformeln siehe Abschnitt Weblinks
L-Histidin kann zum biogenen Amin Histamin decarboxyliert werden.
Die Desaminierung (durch das Enzym Histidase) führt zu Urocaninsäure, der weitere Abbau nach Hydratation durch Urocanase zu Imidazol-4-on-5-propionsäure. Imidazolonpropionase katalysiert dessen Umsetzung zu Formiminoglutamat (FIGLU), aus dem unter Einwirkung des bifunktionalen Enzyms Formiminotransferase-Cyclodesaminase dann L-Glutamat entsteht, eine andere Aminosäure.
Funktionen
Der isoelektrische Punkt von Histidin befindet sich im Neutralbereich. Daher ist es die einzige proteinogene Aminosäure, die unter physiologischen Bedingungen sowohl Protonendonator als auch Protonenakzeptor sein kann. Ein Beispiel hierfür ist seine Rolle in der „katalytischen Triade“ (Asp-His-Ser) von Serinproteasen. Im Proteinanteil des sauerstofftransportierenden Blutfarbstoffs Hämoglobin wie des sauerstoffspeichernden Muskelfarbstoffs Myoglobin sind das „distale“ und das „proximale“ Histidin der Peptidkette von besonderer Bedeutung für den Bindungsplatz des Eisens der prosthetischen Häm-Gruppe. Histidin tritt auch als Ligand von Metallionenkomplexen der Elektronentransportketten auf in den Mitochondrien (oxidative Phosphorylierung) und in den Chloroplasten (Photosynthese).
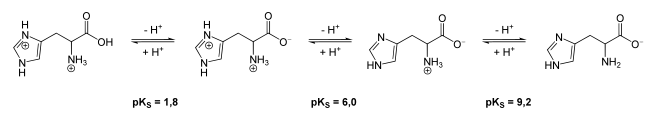
In wässriger Lösung protolysiert Histidin entsprechend dem pH-Wert sowie seiner pKS-Werte (siehe Abbildung).
Verwendung
Bestandteil von Infusionslösungen zur parenteralen Ernährung, peroral bei Gelenkrheumatismus und gegen renale Anämie.[11]
Weblinks
Einzelnachweise
- Eintrag zu Histidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juni 2014.
- F.A. Carey: Organic Chemistry. 5th edition, The McGraw Companies 2001, S. 1059, Link
- Datenblatt Histidin (PDF) bei Merck, abgerufen am 25. Dezember 2019.
- Vergleiche Protein and amino acid requirements in human nutrition – Report of a Joint WHO/FAO/UNU Expert Consultation. (2007) In: WHO Techchnical Report Series. Band 935, Kapitel 8.1.8 Histidine (PDF; 4,0 MB), S. 146 f.
- Hubert Bradford Vickery, Charles S. Leavenworth: On the Separation of Histidine and Arginine. In: Journal of Biological Chemistry. 78, Nr. 3, 1. August 1928, ISSN 0021-9258, S. 627–635. doi:10.1016/S0021-9258(18)83967-9.
- Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage. Georg Thieme Verlag, 2003, ISBN 3-13-759403-0, S. 60.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- P. M. Hardy: The Protein Amino Acids. In: G. C. Barrett (Hrsg.): Chemistry and Biochemistry of the Amino Acids. Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- Schüleraufgabe: CHEMKON 3/2018. In: CHEMKON. Band 25, Nr. 3, Juni 2018, S. 121–122, doi:10.1002/ckon.201880371.
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- S. Ebel und H. J. Roth (Hrsg.): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 66.