Racematspaltung
Als Racematspaltung werden Verfahren zur Trennung von Racematen in ihre Enantiomere bezeichnet. Enantiomere von Wirkstoffen in Pharmaka oder Pflanzenschutzmitteln besitzen meist unterschiedliche biologische Aktivität. Die Racematspaltung wird unter anderem dazu eingesetzt, diese Enantiomere in möglichst reiner Form zu gewinnen. Der Umsatz von Arzneimitteln mit enantiomerenreinen Arzneistoffen betrug im Jahr 2000 etwa 150 Milliarden US-Dollar.[1]
Bis zur Entwicklung von asymmetrischen Synthesemethoden war die Racematspaltung die einzige Möglichkeit zur Gewinnung reiner Enantiomere aus racemischen Produkten, die bei chemischen Synthesen meist entstehen. Die Racematspaltung ist bis heute eine industriell häufig angewandte Methode zur Erzeugung enantiomerenreiner Stoffe.
Geschichte

Die erste Racematspaltung gelang Louis Pasteur im Jahr 1848 durch manuelles Aussortieren enantiomerer Natrium-Ammonium-Tartrat-Kristalle, die sich makroskopisch wie Bild und Spiegelbild verhalten, unter dem Mikroskop.[2] Diese Methode gelingt nur, wenn das Racemat durch spontane Spaltung Kristalle bildet, die nur eines der Enantiomere enthalten. Im Jahr 1857 erreichte Pasteur die Racematspaltung auf einem anderen Weg: durch Diastereomerentrennung. Die Umsetzung einer racemischen Säure (oder Base) mit einer optisch aktiven Base (oder Säure) ergab diastereomere Salze, deren Isomere sich durch fraktionierte Kristallisation in die Enantiomere trennen ließen.[3] Pasteur fand noch eine dritte Methode der Racematspaltung: Bereits 1858 nutzte er erstmals die Fermentation mittels des Schimmelpilzes Penicillium glaucum, den er auf racemischer Weinsäure als Nährstoff wachsen ließ. Während ein Enantiomer vom Pilz verstoffwechselt wurde, blieb das andere Enantiomer in der Lösung zurück.[4]
Marckwald und A. McKenzie berichteten 1899 über die erste kinetische Racematspaltung bei der Veresterung von racemischer Mandelsäure mit optisch aktivem (−)-Menthol. Bei dieser Reaktion zeigt das (R)-Enantiomer der Mandelsäure eine höhere Reaktionsgeschwindigkeit und im Reaktionsgemisch wird (S)-Mandelsäure angereichert.[5]
Die erste gaschromatografische Trennung von D, L-Aminosäuren-Racematgemischen in ihre Enantiomere mittels einer chiralen stationären Phase gelang 1966 Emanuel Gil-Av am Weizmann-Institut für Wissenschaften in Rehovot, Israel.[6]
Im Jahr 1975 meldete Merck ein Patent zur Herstellung von Methyldopa über Racematspaltung mittels Konglomeratkristallisation an.[7]
Im Jahr 2002 startete die Degussa die Produktion von enantiomerenreinen Aminosäuren mit dem Hydantoinase-Verfahren, das auf dynamischer kinetischer Racematspaltung basiert.[8]
Mechanische Trennverfahren
Die von Pasteur angewandte Methode der mechanischen Trennung eignet sich nur für Systeme, in denen die Enantiomere als enantiomerenreine Konglomerate kristallisieren. Außerdem können so nur relativ geringe Mengen getrennt werden.
Besser gelingt die Trennung von Racematen durch Animpfen übersättigter Racemat-Lösungen mit einer geringen Menge eines reinen Enantiomers des gleichen Racemates und anschließende fraktionierende Kristallisation.[9] Die Trennung von enantiomerenreinem Kristall und Lösung geschieht durch mechanische Verfahren wie Filtration oder Zentrifugation. Diese Methode wurde zwar im industriellen Maßstab eingesetzt, ist in ihrer Anwendungsbreite eingeschränkt, da viele Racemate racemisch und nicht als enantiomerenreines Konglomerat kristallisieren.
Trennverfahren über Diastereomerenbildung
Die in einem Racemat enthaltenen Enantiomere lassen sich durch Reaktion mit einem chiralen Reagenz oder Kontakt mit einer chiralen Phase in Diastereomere überführen, die unterschiedliche physikalische Eigenschaften besitzen. Durch die Unterschiede in den physikalischen Eigenschaften lassen sich die entstehenden Diastereomere mittels herkömmlicher Verfahren wie Chromatographie, Kristallisation oder Destillation trennen. Dabei muss die Bildung des Diastereomers nicht unbedingt über kovalente Bindung erfolgen, es kann sich dabei um diastereomere Übergangszustände, die etwa durch Wasserstoffbrückenbindung entstehen, wie etwa bei der chiralen Chromatographie handeln. Eine Voraussetzung für diese Trennmethode ist es, dass die Trennung schneller als Racemisierung erfolgt oder dass stabile Isomere vorliegen. Eine weitere Voraussetzung ist, dass etwa aus dem Chiral pool enantiomerenreine Verbindungen vorliegen, die zur Bildung der Diastereomeren eingesetzt werden können.
Chirale Chromatographie
Racemate lassen sich mit allen bekannten Chromatographiemethoden wie der Dünnschichtchromatographie, der HPLC, Säulenchromatographie oder der Gaschromatographie trennen. Letztere findet bevorzugt in der Analytik nicht-racemischer Enantiomerengemische Anwendung zur Bestimmung des Enantiomerenüberschusses.
Die chirale Phase kann dabei stationär sein oder im Falle der Flüssigkeitschromatographie der Eluent. Die im organisch-chemischen Labor übliche Methode ist das in Kontakt bringen mit chiralen Materialien. Die Chromatographie wählt dazu entweder die mobile Phase (Eluent) oder die stationäre Phase optisch aktiv. Das führt zur unterschiedlichen Retention zweier Enantiomere. Eine dünnschichtchromatographische Enantiomerentrennung unter Verwendung einer enantioselektiven stationären Phase ist bekannt.[10]
Größere Probenmengen lassen sich über Säulenchromatographie trennen. Zur Herstellung der chiralen stationären Phase wird z. B. ein enantiomerenreines chirales Auxiliar wie (+)-Weinsäure auf einem Träger, wie z. B. Kieselgel fixiert. Die racemische Lösung wird mit einem herkömmlichen Eluent chromatographiert. Die einzelnen Enantiomere wechselwirken unterschiedlich stark mit der chiralen Matrix und verlassen die Säule bei verschiedenen Retentionszeiten.
Die Differenz der freien Standardbildungsenergie der diastereomeren Übergangszustände
- ΔS, RΔG≠ = RT ln α
(α: Trennfaktor)
bewirkt einen Unterschied der Retentionszeit.
Als chirale Phasen finden eine Reihe von Stoffen Anwendung. Die Art des chiralen Erkennens ist dabei je nach Art des Trägermaterials verschieden. Peptidphasen wechselwirken meist über Wasserstoffbrücken sowie Dipol-Dipol-Wechselwirkungen, während chirale Metallkomplexe über Komplexierung wechselwirken. Intensiv untersucht wurde die Gaschromatographie mittels Cyclodextrinderivaten.[11]
Kristallisation und Destillation
Die Racematspaltung mittels fraktionierter Kristallisation ist eine weit verbreitete Methode. Dabei werden diastereomere Salze durch Zugabe eines enantiomerenreinen Hilfsstoffes und anschließende Trennung durch fraktionierende Kristallisation unter Ausnutzung ihrer unterschiedlichen physikalischen Eigenschaften getrennt.[12] Weit verbreitet ist der Einsatz von Weinsäure oder Chinin als Komponente des Chiral pools.
Nicht oder schwer kristallisierbare Diastereomere können destillativ getrennt werden. Das Verfahren eignet sich etwa für racemische Säuren oder Alkoholgemische, die in die Ester überführt werden können.
Kinetische Racematspaltung
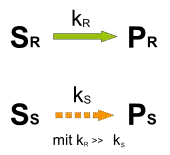
Sind die Geschwindigkeitskonstanten der Überführung der Substratisomere SR und SS in die korrespondierenden Produkte PR und PS verschieden, so ist eine kinetische Racematspaltung möglich. Die Reaktion wird bei einem Umsatz von circa 50 % abgebrochen, da das schneller reagierende Enantiomer verbraucht ist. Im Reaktionsgemisch reichert sich das langsamer reagierende Enantiomer an. Die Komponenten SS und PR können mit herkömmlichen Methoden getrennt werden, PR kann nach erfolgter Trennung gegebenenfalls wieder in SR überführt werden.
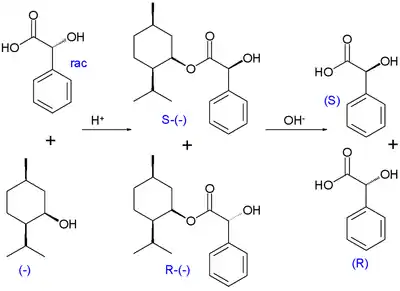
Bei der kinetischen Racematspaltung nach Willy Marckwald und McKenzie wird racemische Mandelsäure mit optisch aktivem (−)-Menthol teilverestert. Das (R)-Enantiomer der Mandelsäure zeigt dabei eine höhere Reaktionsrate und in der Reaktionsmischung reichert sich die (S)-Mandelsäure an. Die angereicherte Fraktion kann abgetrennt werden, die (R)-Mandelsäure kann durch Hydrolyse wieder zurückgewonnen werden.
Im Gegensatz zur fermentativen Racematspaltung haben kinetische Racematspaltungen mittels Enzymen eine breite Anwendung gefunden.[13]
Dynamische kinetische Racematspaltung
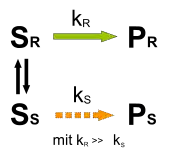
Die Nachteile der kinetischen Racematspaltung wie die theoretisch begrenzte Ausbeute von 50 % und die notwendige Aufarbeitung der Reaktionslösung lassen sich durch die dynamische kinetische Racematspaltung vermeiden. Durch die Racemisierung des langsamer reagierenden Enantiomers SS lassen sich Racemate quantitativ in Produkte mit hohem Enantiomerenüberschuss umwandeln. Die Ausbeute und der Enantiomerenüberschuss kann theoretisch 100 % betragen.
Eines der ersten Beispiele für die dynamische kinetische Racematspaltung ist die asymmetrische Hydrierung nach Ryoji Noyori (1989):[14]
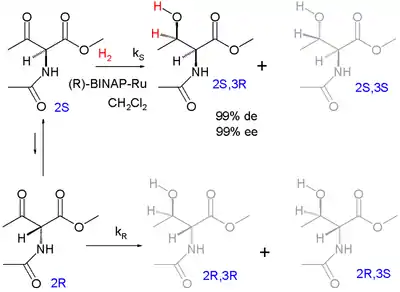
Die Enantiomere racemisieren über die Enol-Form. Das Zielprodukt ist das geschützte syn-Addukt L-Threonin (2S, 3R) mit 99 % Diastereomerenüberschuss (mit Präferenz für das syn-Diastereomerenpaar und nicht das Anti-Paar) und 99 % Enantiomerenüberschuss (Präferenz für das (3R)-Produkt innerhalb der syn-Paares).
Die dynamische kinetische Racematspaltung kann über die Bildung eines prochiralen Übergangszustandes oder einer meso-Verbindung erfolgen. Ein Beispiel hierfür ist die allylische asymmetrische Alkylierung nach Barry Trost, die über einen η3-Palladium-Allylkomplex erfolgt.[15]
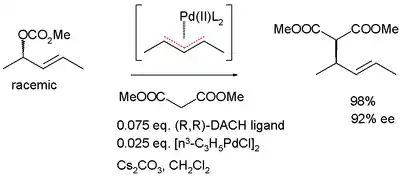
Ein Beispiel für die industrielle Anwendung der dynamischen kinetischen Racematspaltung ist das von der Degussa entwickelte Hydantoinase-Verfahren zur Darstellung von Aminosäuren mit hoher Enantiomerenreinheit. Als Substrate werden Hydantoine verwendet, die durch Zugabe von Racemase schnell racemisiert werden. Durch D-Hydantoinase wird das (R)-Hydantoin zur Carbamoyl-geschützten D-Aminosäure gespalten, die durch eine Carbamoylase anschließend entschützt wird.
Literatur
- G. Subramanian: Chiral Separation Techniques: A Practical Approach, 641 Seiten, Verlag Wiley-VCH Verlag GmbH & Co. KGaA (2006) ISBN 3-527-31509-8, ISBN 978-3-527-31509-3.
- W. A. König: The Practice of Enantiomer Separation by Capillary Gas Chromatography, 104 Seiten, Verlag Hüthig (1987); ISBN 3-7785-1324-9, ISBN 978-3-7785-1324-8.
- P. J. Walsh, M. C. Kozlowski: Fundamentals of Asymmetric Catalysis, 688 Seiten, Verlag Palgrave Macmillan (2008), ISBN 1-891389-54-8, ISBN 978-1-891389-54-2.
- A. Pandey: Enzyme Technology, 742 Seiten, Verlag Springer, Berlin (2006), ISBN 0-387-29294-2, ISBN 978-0-387-29294-6.
Weblinks
Einzelnachweise
- V. Schurig: Bedeutung der Chiralität und Enantiomerentrennung - Methoden der Chiralitätserkennung, bei uni-tuebingen.de. Abgerufen am 21. September 2013.
- Louis Pasteur: On the Relationships between the Crystalline Form, Chemical Composition and the Direction of Optical Rotation. Annales de Chimie et de Physique. Vol. 24. No. 6. 1848. S. 442–459.
- Louis Pasteur: C. R. Hebd. Seance Acad. Sci., 1857, Bd. 45, S. 1032.
- Louis Pasteur: C. R. Hebd. Seances Acad. Sci., 1858, Bd. 46, S. 615–618.
- Willy Marckwald, A. McKenzie: Über eine principiell neue Methode zur Spaltung racemischer Verbindungen in die activen Bestandtheile. In: Ber. Dtsch. Chem. Ges. 1899, 32, S. 2130. doi:10.1002/cber.189903202130
- Emanuel Gil-Av, Binyamin Feibush, Rosita Charles-Sigler: Separation of enantiomers by gas liquid chromatography with an optically active stationary phase. In: Tetrahedron letters 7.10 (1966): S. 1009–1015.
- Edward J.J. Grabowski: Enantiopure drug synthesis: From methyldopa to imipenem to efavirenz. In: Chirality. 17, 2005, S. S249–S259, doi:10.1002/chir.20143.
- Oliver May, Stefan Verseck, Andreas Bommarius, Karlheinz Drauz: Development of Dynamic Kinetic Resolution Processes for Biocatalytic Production of Natural and Nonnatural-Amino Acids. In: Organic Process Research & Development. 6, 2002, S. 452–457, doi:10.1021/op020009g.
- Axel Kleemann und Jürgen Martens: Optical resolution of racemic S-(Carboxymethyl)cysteine. In: Liebigs Annalen der Chemie. 1982, 11, S. 1995–1998, doi:10.1002/jlac.198219821108.
- Kurt Günther, Jürgen Martens, Maren Schickedanz: Dünnschichtchromatographische Enantiomerentrennung mittels Ligandenaustausch. In: Angewandte Chemie. 96, 1984, S. 514–515, doi:10.1002/ange.19840960724.
- Volker Schurig, Hans-Peter Nowotny: Gaschromatographische Enantiomerentrennung an Cyclodextrinderivaten. In: Angewandte Chemie. 102, 1990, S. 969–986, doi:10.1002/ange.19901020904.
- Bernd Schäfer: Naturstoffe der chemischen Industrie, Elsevier GmbH, Spektrum Verlag, 2007, ISBN 978-3-8274-1614-8, S. 155.
- Michal Shapira-Levinger, Ayelet Fishman: Kinetic resolution of a diltiazem intermediate by lipase-catalyzed enantioselective alcoholysis. In: Journal of Molecular Catalysis B: Enzymatic. 9, 2000, S. 251–257, doi:10.1016/S1381-1177(99)00102-2.
- R. Noyori, T. Ikeda, T. Ohkuma, M. Widhalm, M. Kitamura, H. Takaya, S. Akutagawa, N. Sayo, T. Saito: Stereoselective hydrogenation via dynamic kinetic resolution In: J. Am. Chem. Soc. 1989; 111, S. 9134–9135; doi:10.1021/ja00207a038.
- Barry M. Trost, Michelle R. Machacek, Aaron Aponick: Predicting the Stereochemistry of Diphenylphosphino Benzoic Acid (DPPBA)-Based Palladium-Catalyzed Asymmetric Allylic Alkylation Reactions: A Working Model. In: Accounts of Chemical Research. 39, 2006, S. 747–760, doi:10.1021/ar040063c.