Theorie des Übergangszustandes
Die Theorie des Übergangszustandes[1] (englisch Transition state theory, TST), auch Eyring-Theorie genannt (nach Henry Eyring,[2] 1901–1981), ist eine molekulare Theorie zur Reaktionskinetik. Sie wurde unter Berücksichtigung molekularer Größen, der Zustandssummen, abgeleitet und ermöglicht die Bestimmung der absoluten Reaktionsgeschwindigkeitskonstanten einer chemischen Reaktion. Diese Reaktionsrate kann dann in einer Ratengleichung verwendet werden. Zu den Begründern der Theorie zählen neben Eyring in Princeton Michael Polanyi und Meredith Gwynne Evans in England.
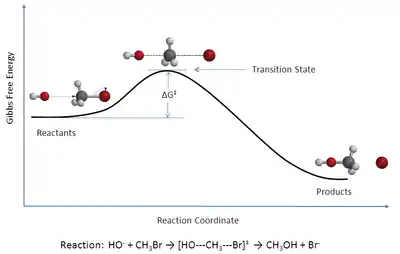
Die Edukte sind von den Produkten durch einen Potentialwall (Aktivierungsbarriere) getrennt, der einen Sattelpunkt auf der Potentialhyperfläche darstellt. Die Reaktion der Edukte über den Übergangszustand zu den Produkten verläuft entlang einer Trajektorie (siehe dazu auch Phasenraumanalyse), der Reaktionskoordinate (Weg zwischen den Edukten und Produkten mit jeweils minimaler Änderung der potentiellen Energie). Der Punkt höchster potentieller Energie auf dieser Reaktionskoordinate ist der Übergangszustand. Der Begriff Aktivierter Komplex bezeichnet die Anordnung der Teilchen im Übergangszustand (es handelt sich nicht um einen Komplex im Sinne des Artikels Komplexchemie)[3]. Kramers Theorie zur Reaktionskinetik erweitert die TST.
Die wichtigsten Annahmen, die der TST zugrunde liegen, sind:
- Separation von Kern- und Elektronenbewegung, analog zur Born-Oppenheimer-Näherung
- Die Wahrscheinlichkeitsdichte der Energiezustände der Edukte lässt sich durch eine Boltzmann-Verteilung beschreiben.
- Im Übergangszustand kann die Bewegung entlang der Reaktionskoordinate von anderen Bewegungen separiert und klassisch als Translation behandelt werden.
- Der Übergangszustand steht mit den Edukten in einem Gleichgewicht. (Quasi-Gleichgewichts-Hypothese)
- Nur Edukte reagieren zu Produkten, nicht umgekehrt (Einbahnstraßenverkehr).
Als Ergebnis der Herleitung ergibt sich die Eyring-Gleichung:
= Geschwindigkeitskonstante, = Transmissionskoeffizient (nicht im Sinne von Optik), = Boltzmann-Konstante, = Temperatur, = Planck’sches Wirkungsquantum, = Gleichgewichtskonstante des Übergangszustandes.
Die TST erklärt den Mechanismus der Katalyse: durch eine Erniedrigung der Aktivierungsenergie wird die Reaktionsgeschwindigkeitskonstante erhöht.
Herleitung
Die Herleitung erfolgt für eine Beispielreaktion, in der die Edukte und zum Produkt reagieren. Als Zwischenstufe wird der Übergangszustand definiert.
Die Reaktionsgeschwindigkeit wird als Produktbildungsgeschwindigkeit definiert,
wobei die relative Aktivität des Übergangszustandes durch die Gleichgewichtskonstante des vorgelagerten Gleichgewichtes (gemäß dem Reaktionsquotienten)
und die Konzentrationen von A und B ersetzt wird. Es ergibt sich:
Man fasst zusammen und bezieht die Produktbildungsgeschwindigkeit auf die Edukte und
und erhält für die Geschwindigkeitskonstante
Die weitere Herleitung unterscheidet sich je nach Lehrbuch. Es ergibt sich die oben angegebene Eyring-Gleichung.
Die Geschwindigkeitskonstante ergibt sich als
wobei der Transmissionskoeffizient nicht abgeleitet wird, sondern als zusätzlicher Parameter zur Anpassung von experimentellen Ergebnissen an die berechneten eingeführt wird.
Damit gilt also:
- .
mit und der Differenz der Standard Gibbs Energie der Edukte und des Übergangszustandes.
hat bei einen Wert von und wird als Frequenz-Faktor bezeichnet. Er liegt in der Größenordnung von Stoßfrequenzen der Moleküle in Flüssigkeiten.
Somit ergibt sich die endgültige Form:
Thermodynamische Formulierung
Mit der van’t-Hoffschen Reaktionsisobare ergibt sich:
Die Legendre-Transformation der Gibbs-Helmholtz-Gleichung erlaubt eine Darstellung als:
Aus der Arrhenius-Gleichung ergibt sich eine formale Definition für die Aktivierungsenergie :
Analog lässt sich die Eyring-Gleichung unter Berücksichtigung der van’t-Hoffschen Reaktionsisobare umschreiben:
Daraus folgt mit der Definition der Enthalpie (bei konstantem Druck):
Für unimolekulare Reaktionen ist und für Reaktionen in Lösungen und kondensierter Materie näherungsweise Null:
Bei idealen Gasen ergibt sich für den präexponentiellen Faktor:
Kritik
- Die TST basiert auf der klassischen Mechanik. Bei Reaktionen sehr leichter Spezies, zum Beispiel Wasserstoff- oder Deuterium-Atome, treten Tunneleffekte auf, für deren Beschreibung eine quantenmechanische TST nötig wäre. Dieses Problem wurde bisher noch nicht zufriedenstellend gelöst.
- Nur wenn die Bewegung auf der Potentialhyperfläche eine eindimensionale Bewegung entlang der Reaktionskoordinaten ist, ist die Annahme gerechtfertigt, dass die Bewegung entlang der Reaktionskoordinaten separiert werden kann von den anderen Freiheitsgraden. Diese Annahme ist aber für die Herleitung der Eyring-Gleichung nötig.
- Für höhere Temperaturen sind anharmonische Korrekturen des Potentials am Sattelpunkt nötig.
Siehe auch
Weblinks
- Theorie des Übergangszustands: Betrachtung aus dem Phasenraum (Memento vom 24. April 2009 im Internet Archive) (Englisch, PDF)
Einzelnachweise
- Eintrag zu Transition State Theory. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.T06470 – Version: 2.3.3.
- H. Eyring: The Activated Complex in Chemical Reactions. In: J. Chem. Phys. 1935, 3, 107; doi:10.1063/1.1749604.
- Eintrag zu Activated Complex. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00092 – Version: 2.3.3.