Membrantransport
Unter Membrantransport wird in der Biologie der Transport von unterschiedlichen Stoffen durch eine Biomembran verstanden. Werden dabei zugleich Teile der Membran selbst verlagert, wird dies gelegentlich als Membranfluss gesondert bezeichnet.
Der von einer Biomembran umschlossene Bereich (beispielsweise das Cytoplasma einer Zelle) schafft eine in sich weitgehend kontrollierte Region. Die Abschirmung des Inneren gegenüber der Außenwelt ermöglicht der Zelle Aufbau und Aufrechterhaltung eines spezifischen Zellmilieus, welches essentielle Funktionsabläufe unterstützt.
Die aus Phospholipiden bestehende Doppelschicht der Membran ist nur für Gase und sehr kleine, meist ungeladene (und somit hydrophobe) Moleküle „von sich aus“ permeabel. Ionen sowie die meisten biologisch wirksamen Substanzen sind polar, also hydrophil. Für sie stellt die Lipiddoppelschicht eine Barriere dar, die nur durch zusätzliche Transportmechanismen überwindbar ist.
Alle Lebensprozesse und spezifischen Zellfunktionen sind darauf angewiesen, dass die Zelle oder deren Kompartimente mit ihrer Umgebung in Kontakt stehen, kommunizieren. Kommunikation bedeutet unter anderem selektiven Stoff- bzw. Teilchenaustausch. Deswegen müssen Mechanismen vorhanden sein, die es Molekülen äußerst selektiv erlauben, die Membran zu passieren, z. B. Kanäle und sogenannte Carrier.
Transmembran-Transport
Bei den meisten Transportvorgängen, die in komplexen Systemen schwer separat betrachtet werden können (sie sind abhängig davon, was „um sie herum passiert“, zum Beispiel von einem vorgeschalteten Transportvorgang), wirken sowohl Konzentrations- als auch Ladungsgradienten in unterschiedlicher Gewichtung, und das teils synergistisch, teils antagonistisch.
Einfache Diffusion
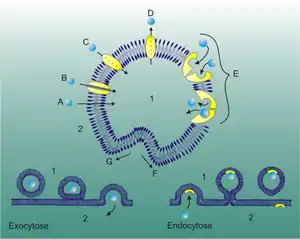
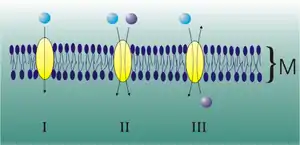
Lipophile und sehr kleine unpolare Moleküle können durch Diffusion durch die Membran gelangen. Dabei folgen sie immer ihrem Konzentrationsgefälle, mit dem Bestreben dieses auszugleichen. Ist die Konzentration innerhalb und außerhalb der Zelle gleich, stellt sich ein Fließgleichgewicht ein (siehe Abb. 1, A). Bei geladenen Teilchen spielt auch das Membranpotential bei der Einstellung des Gleichgewichtes eine Rolle.
Passiver Transport
Auch beim passiven Transport überwinden die Moleküle die Membran ohne jegliche Zuführung von Energie von außen oder von der Zelle in Richtung eines Konzentrations- oder Potentialgefälles. Letztlich ist der passive Transport nur ein Spezialfall der Diffusion: Auch größere Moleküle und Ionen, wie Zucker, Aminosäuren oder Nukleotide, für die die Membran unüberwindlich ist, werden hierbei mit Hilfe von Membrantransport-Proteinen von einer Seite auf die andere befördert. Dabei gibt es zwei Möglichkeiten: die freie Diffusion durch eine Plasmamembran und die erleichterte Diffusion durch Kanalproteine oder Transportproteine.
Passiver Transport durch Kanalproteine
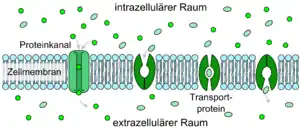
Bei den passiv transportierenden Kanälen handelt es sich um Transmembranproteine (auch Kanalproteine genannt), die die Membran tunnelartig durchspannen. Zum Inneren des Kanals hin tragen sie polare Aminosäuren. Dadurch können kleine polare oder geladene Teilchen wie Ionen über diese Kanäle in die Zelle transportiert werden. Verschiedene Kanäle weisen eine unterschiedliche Spezifität hinsichtlich der Leitfähigkeit für bestimmte Ionen oder Moleküle auf.
Die meisten Kanäle öffnen sich erst auf ein bestimmtes Signal hin, wodurch es zu einer Schleusenbewegung, dem "gating", kommt. Ligandengesteuerte Kanäle reagieren auf die Bindung eines Botenstoffes, beispielsweise eines Hormons. Spannungsgesteuerte Kanäle reagieren auf die Änderung des Membranpotentials. Mechanisch gesteuerte Kanäle werden zum Beispiel bei Veränderungen der Zellform durch Wechselwirkungen mit dem Cytoskelett reguliert.
Sind die Kanäle einmal offen, diffundieren die Moleküle entlang des Konzentrationsgradienten durch die Plasmamembran. Dies geschieht entweder, bis die Konzentration des transportierten Stoffes auf beiden Seiten der Membran gleich ist, sodass der Nettofluss gleich Null ist, oder aber, bis sich die Kanäle wieder schließen (Siehe Abb. 1, B).
Porine sind ähnlich aufgebaut wie Ionenkanäle, ermöglichen jedoch den Durchtritt deutlich größerer Moleküle. Ein Beispiel sind die so genannten Aquaporine. Diese bilden wasserleitende Kanäle.
Passiver Transport durch Carrier-Proteine
Beim passiven Transport durch Carrier-Proteine wird das Molekül von Carriern von einer Seite der Membran auf die andere transportiert. Carrier sind auf ganz bestimmte Moleküle spezialisiert, für die sie – ähnlich wie Enzyme – eine Bindungsstelle haben. Wenn sich der Carrier mit dem Substrat verbindet, ändert er seine Konformation. Durch diese Umlagerung wird das betreffende Molekül durch die Membran geschleust und auf der anderen Seite freigesetzt (Siehe: Abb. 1, E). Jeder zu transportierende Stoff ist auf sein entsprechendes Carrier-Protein angewiesen. Während manche Carrier nur ein Molekül auf einmal befördern können (Uniport), haben andere Bindungsstellen für zwei verschiedene Moleküle. Sie ändern ihre Konformation erst dann, wenn beide Bindungsstellen besetzt sind. Der Transport erfolgt für beide Moleküle in der gleichen (Symport) oder in entgegengesetzter Richtung (Antiport). Zu beachten ist, dass im Gegensatz zum sekundär aktiven Transport keine Abhängigkeit von einem elektrischen Gradienten besteht.
Aktiver Transport

Aktiver Transport ist definiert als ein Transportvorgang, der im jeweiligen System nur dann abläuft, wenn von außen Energie zugeführt wird. Mit deren Hilfe können dann Moleküle gegen ein chemisches Konzentrationsgefälle bzw. Ionen gegen ein elektrisches Potentialgefälle transportiert werden.
Für die Energiebilanz des Transportes der meisten geladenen Teilchen spielen sowohl Ladungs- als auch Konzentrationsaspekte eine Rolle: Sowohl die Verminderung der Entropie eines Systems (Aufbau / Verstärkung eines Konzentrationsgradienten) als auch Ladungstransport gegen das elektrische Feld, hier das Ruhemembranpotential, erfordert die Zufuhr von Energie. Dabei ist zu beachten, dass es zwar um Energie- und Ladungsbilanzen im betrachteten System (hier ein Volumen um den Transporter) geht, die Teilchenkonzentrationen und deren Veränderungen aufgrund der semi- / selektiv permeablen Zellmembran aber durchaus separat zu betrachten sind.
Diese Energie wird im Wesentlichen auf 3 Arten (oft auch durch eine Kombination dieser) zur Verfügung gestellt:
- Chemische Bindungsenergie, ein typisches Beispiel ist die Hydrolyse von ATP;
- Abbau eines Ladungsgradienten als „Triebkraft“, also elektrischer Energie;
- Erhöhung der Entropie in einem kommunizierenden System, z. B. der Abbau eines anderen Konzentrationsgradienten.
Ein Transportvorgang, der in der Bilanz gegen den elektrischen Gradienten erfolgt, wird als elektrogen bezeichnet (vs. elektroneutral). Bezüglich der Herkunft der Energie und der Art der verrichteten Arbeit unterscheidet man primär, sekundär und tertiär aktiven Transport sowie den Spezialfall Gruppentranslokation.
- Beim primär aktiven Transport werden unter ATP-Verbrauch Protonen und anorganische Ionen durch Transport-ATPasen durch die Cytoplasmamembran hindurch aus der Zelle gepumpt. Die H+-ATPase arbeitet in Pflanzenzellen z. B. als Protonenpumpe. Ein Ion wird durch eine so genannte Ionenpumpe (Abb. 1 E), von der Seite der niedrigeren auf die Seite der höheren Konzentration gepumpt. Die Energie entstammt der Hydrolyse von ATP zu ADP und anorganischem Phosphat (Siehe: Abb. 1, D). Eine wichtige Anwendung für den primär aktiven Transport ist die Natrium-Kalium-Pumpe, ein in die Zellmembran integriertes Protein, das, unter Verbrauch von ATP, drei positiv geladene Natrium-Ionen aus der Zelle hinaus pumpt und im selben Zyklus zwei ebenfalls positiv geladene Kalium-Ionen in die Zelle hineinpumpt. Dadurch wird das Ruhepotential in Nervenzellen (Neuronen) aufrechterhalten, das zur Erzeugung und Weiterleitung von Aktionspotentialen notwendig ist.

- Der sekundäre aktive Transport befördert ein Teilchen (zumeist ein Ion) passiv entlang eines elektrochemischen Gradienten und nutzt dabei die potentielle Energie dieses Gradienten aus, um ein zweites Substrat gegen dessen Konzentrationsgefälle oder elektrischen Gradienten zu transportieren. Findet dieser Transport in gleicher Richtung statt, so wird von einem Symport über einen Symporter gesprochen (z. B. Natrium-Glukose-Symport im Dünndarm, Natrium-Iodid-Symporter in der Schilddrüse). Ein Transport in entgegengesetzter Richtung heißt Antiport über einen Antiporter, z. B. der Natrium-Calcium-Antiport durch den Natrium-Calcium-Austauscher. (Siehe: Abb. 1, C).
- Beim tertiär aktiven Transport wird der Konzentrationsgradient genutzt, den ein sekundär aktiver Transport auf der Basis eines primär aktiven Transports aufgebaut hat. Durch diese Form des aktiven Transports werden im Dünndarm z. B. Di- und Tripeptide durch den Peptidtransporter 1 aufgenommen.
- Bei der Gruppentranslokation werden meist Monosaccharide wie Glucose und Mannose oder Zuckeralkohole wie Glucitol oder Mannitol durch eine Membran geschleust, wobei der zu transportierende Stoff chemisch verändert (i. A. phosphoryliert) wird und damit gar kein Konzentrationsgradient entsteht. Das bestuntersuchte Gruppentranslokationssystem ist das sogenannte PEP-PTS (Phosphoenolbrenztraubensäure-Phosphotransferase-System) bei E. coli. Die notwendige Energie stammt statt aus ATP von PEP (Phosphoenolbrenztraubensäure). Diese Form des aktiven Transports wurde bisher nur bei Bakterien gefunden.
Membranverlagernder Transport
Endozytose
Als Endozytose bezeichnet man einen Einstülpungsvorgang der Biomembran, bei dem sich eine Einzelzelle oder ein Kompartiment, einen Flüssigkeitstropfen, bestimmte darin gelöste Substanzen, Makromoleküle oder größere Nahrungsteilchen bis hin zu kleineren anderen Zellen, einverleibt. Am Ende des Einstülpungsvorgangs wird ein sogenanntes Endosom ins Cytoplasma abgeschnürt bzw. abgestoßen und ist jetzt Teil des Endomembransystems. So nimmt die Zelle einen Teil des sie umgebenden Mediums in ihr Inneres auf (Siehe: Abb. 1, F).
Man unterscheidet vier verschiedene Formen der Endozytose, die Clathrin-vermittelte Endozytose, die Endozytose über Caveolae, die Phagozytose und die Pinozytose.
Des Weiteren ist die rezeptorvermittelte (bzw. rezeptorgesteuerte) Endozytose über Clathrin von Bedeutung, bei der spezielle Rezeptoren (Asialoglykoproteinrezeptoren) an der Zellmembranoberfläche für die Erkennung der aufzunehmenden Partikel zuständig sind. So tragen beispielsweise LDL-Partikel das Apolipoprotein B-100 an ihrer Oberfläche, das an den LDL-Rezeptor der Zelle bindet, und so die Aufnahme des Partikels auslöst. Auf diese Weise wird beispielsweise Cholesterin in die Zelle aufgenommen. Nach der Bindung an den Rezeptor stülpt sich aufgrund von Protein-Lipid-Interaktionen die Zellmembran ein und bildet eine ummantelte Grube (englisch: coated pit, eine Vertiefung, die mit dem Protein Clathrin ausgekleidet ist). Am Nacken des dabei wachsenden Vesikels lagert sich das Protein Dynamin an. Dieses erkennt mit seiner Pleckstrin-homologen Domäne (pleckstrin homology domain, PH) spezifisch das Phosphoinositol aus der Membran. Bei der Anordnung zu einem Dynamin-Supramolekül hilft Ampiphysin, welches mit seiner SH3-Domäne die prolinreiche Domäne (PRD) des Dynamins bindet und dabei weitere Dynaminmoleküle rekrutiert. Im GTP-gebundenen Zustand liegt das Supramolekül als rechtsgewundene Helix um den Vesikelnacken. Während der Interaktion der GED- und der GTPase-Domäne von Dynamin wird GTP hydrolysiert und das Dynamin-Supramolekül macht eine Konformationsänderung durch. In der „Poppase“-Theorie ist dieses ein Anstieg in der Ganghöhe der Dynaminhelix, welcher dazu führt, dass der Vesikel von der Membran abgestoßen wird. In der „Pinchase“-Theorie ist es diese Konformationsänderung, die zur Verringerung des Helixdurchmessers führt und somit zur Abschnürung des Vesikelnackens.
Exocytose
Die Exocytose ist ein Vorgang, bei dem Stoffe aus der Zelle an die Zellumgebung abgegeben werden. Diese Stoffe können entweder in der Zelle gebildet werden oder unverdauliche Überreste aus der Zellverdauung sein. Grundsätzlich verschmilzt bei der Exozytose immer ein Transportvesikel (Exosom) mit der Zellmembran (Siehe: Abb. 1, G). Das Exosom besitzt eine einfache Lipiddoppelschicht (Biomembran) als äußere Umhüllung, aus welcher auch die Zellmembran besteht. Die meisten Exozytosen sind mit einer Endozytose verbunden (Exozytose-gekoppelte Endozytose). Diese ist notwendig, um zu verhindern, dass die Zellmembran sich ungehindert vergrößert. Auf der anderen Seite spart sich die Zelle hiermit auch die Neusynthese von Transportvesikeln und den zugehörigen Membranproteinen. Dieser Vorgang wird als Vesicle Recycling bezeichnet.
Transcytose
Transcytose (= Zytopempsis) ist ein rezeptorabhängiger Transport von extrazellulärem Material durch die Zelle hindurch und somit eine Kombination aus Endozytose und Exozytose. Das Vesikel wird an eine Nachbarzelle weitergegeben oder in den extrazellulären Raum transportiert, ohne dass sein Inhalt verändert wird. Sie tritt in den Epithelzellen der Gefäße und in den Epithelzellen des Darmes auf, da die Zwischenräume durch Tight junctions versperrt sind.
Ein Beispiel für einen Rezeptor für Transzytose ist eine Gruppe von Fc-Rezeptoren. Sie befinden sich in der Plazenta und auf der apikalen Seite von kindlichem Darmepithel und transportieren durch Transzytose mütterliches IgG in den Fötus bzw. in das Kleinkind.
Elektronentransportkette
Atmungskette
Photosynthetische Elektronentransportkette
Siehe auch
Literatur
- Bruce Alberts: Lehrbuch der Molekularen Zellbiologie. Wiley-VCH, April 2005, ISBN 3-527-31160-2.
- Helmut Plattner, Joachim Hentschel: Zellbiologie. Thieme, Stuttgart Januar 2002, ISBN 3-13-106512-5.
- Gerald Karp: Molekulare Zellbiologie. Springer, Berlin März 2005, ISBN 3-540-23857-3.
- M. A. Schlager, C. C. Hoogenraad: Basic mechanisms for recognition and transport of synaptic cargos. (Review). In: Molecular brain. Band 2, 2009, S. 25, ISSN 1756-6606. doi:10.1186/1756-6606-2-25. PMID 19653898. PMC 2732917 (freier Volltext).