Urease
Die Urease ist das Enzym, das Harnstoff in Ammoniak und Kohlenstoffdioxid bzw. in Ammonium- und Carbonationen spaltet; da die Reaktion in wässriger Lösung stattfindet, entstehen zum Teil auch Hydrogencarbonationen:
| Urease (Klebsiella aerogenes) | ||
|---|---|---|
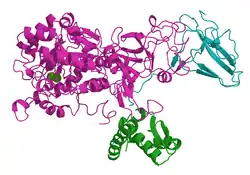
| ||
| Bändermodell mit 2 Ni-Ionen (grün) nach PDB 2KAU | ||
|
Vorhandene Strukturdaten: siehe UniProt-Eintrag | ||
| Masse/Länge Primärstruktur | 2319 = 3*(567+106+100) Aminosäuren | |
| Sekundär- bis Quartärstruktur | 3*(α + β + γ) | |
| Kofaktor | 2 Ni2+ | |
| Bezeichner | ||
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.1.5, Hydrolase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Harnstoff + H2O | |
| Produkte | CO2 + 2 NH3 | |
| Vorkommen | ||
| Homologie-Familie | Urease-alpha | |
| Übergeordnetes Taxon | Bakterien | |
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| CAS-Nummer | ||||||||
| ||||||||
oder
Die Urease zählt zur Gruppe der Amidasen und kommt häufig in Pflanzensamen, Bakterien, Krebsen und Meeresmuscheln vor. Pflanzenurease wirkt unabhängig von der harnstoffspaltenden Funktion als Insektizid und erzeugt in Säugetierblut eine Thrombozytenaggregation.[2]
Insbesondere die Urease in Bodenbakterien spielt eine wichtige Rolle im Stickstoffkreislauf, denn ohne sie wäre eine Stickstoffdüngung durch den in Abwesenheit von Enzymen zersetzungsbeständigen Harnstoff, eines Bestandteils der Jauche, nicht möglich. Auf der anderen Seite sind Urease-positive Bakterien in den Exkrementen die Ursache für unerwünschte Ammoniak-Emissionen in der landwirtschaftlichen Tierhaltung (in Deutschland im Jahr 2005 geschätzte 490.000 von 590.000 Tonnen Gesamt-Ammoniakemission).[3][4]
Durch die Katalyseaktivität des Enzyms wird die Reaktionsgeschwindigkeit sehr stark um den Faktor 1014 erhöht. Die Urease aus Bohnen (und wohl auch der Bakterien) ist ein Metalloenzym und enthält Nickel.
Die Urease aus Jackbohnen war das erste Enzym, das 1926 durch James Batcheller Sumner gereinigt und kristallisiert werden konnte.[5] Dafür gab es 1946 den Nobelpreis in Chemie.[6]
Urease wird auf Grund der Struktur des nickelhaltigen Zentrums in der metallorganischen Chemie als ein mögliches Modellsystem für die katalytische Aktivierung von Kohlenstoffdioxid angesehen. Komplexe N-Carbamate (Bindung des elektronenarmen Kohlenstoffatoms des Kohlenstoffdioxids an das elektronenreiche Stickstoffatom von Iminen/Aminen) mit Nickel (0- oder 2-wertig) als Zentralatom existieren und sind strukturell charakterisiert; infrarotspektroskopische Untersuchungen haben eine Energieabsenkung (Aktivierung) der thermodynamisch sehr stabilen C=O-Doppelbindungen nachweisen können. Jedoch steht der Nachweis der Übertragung von derartig „aktiviertem“ Kohlenstoffdioxid auf andere Substrate noch aus.
Medizinische Bedeutung
Organismen (z. B. Helicobacter pylori), welche Urease besitzen, sind oft Krankheitserreger des Verdauungssystems, da sie durch das freigesetzte Ammoniak im sauren Milieu des Magens überleben können. Das Gleiche gilt für die pathologischen Arten der Gattung Proteus, die so den Urogenitaltrakt besiedeln. Diese alkalische Reaktion des Ammoniaks wird auch zum Nachweis dieser Organismen eingesetzt (siehe: Helicobacter-Urease-Test).
Bedeutung für die Landwirtschaft
Urease in Bodenbakterien ist die Voraussetzung für die Wirkung von Exkrementen als Stickstoffdünger, da erst die hydrolytische Spaltung von Harnstoff den Stickstoff als Ammoniumionen verfügbar macht. Das Zwischenprodukt Ammoniak ist allerdings gasförmig und nur geringe Mengen des Gases können von der Feuchtigkeit des Bodens aufgefangen werden. Es entweicht daher immer ein Anteil des Ammoniaks und geht als Dünger verloren. Dieser Anteil ist umso größer, je konzentrierter der Ausgangsstoff Harnstoff vorhanden ist und deswegen geht am meisten Ammoniak aus Stallboden und Jauche verloren. Da Ammoniak außerdem auf mehrere Arten umweltschädlich ist und man sich international auf eine Eingrenzung der Emissionen geeinigt hat, wird unter anderem versucht, mit Ureaseinhibitoren das Problem zu lösen und die Emission aus Ställen zu senken.[7]
Kinetik
Die Reaktion von Urease mit Harnstoff eignet sich zur Veranschaulichung der Abhängigkeit der Reaktionsgeschwindigkeit von der Zeit, wenn man eine Harnstofflösung mit einer hohen Konzentration wählt.
Da beim Zerfall von Harnstoff in wässriger Lösung Ionen entstehen, lässt sich die Zunahme der Ionen über Leitfähigkeitsmessung verfolgen. Über einen längeren Zeitraum steigt die Leitfähigkeit linear.
Die Reaktion kann auch fotometrisch verfolgt werden. Hierbei wird als Indikator Bromthymolblau zugegeben, der sich im Verlauf der Reaktion immer intensiver blau färbt. Die Extinktion, ein Maß für die Konzentration, steigt dabei über einen längeren Zeitraum ebenfalls linear an.
Beim Zerfall von Harnstoff ist die Reaktionsgeschwindigkeit über einen längeren Zeitraum konstant. Es liegt hierfür eine Reaktion nullter Ordnung vor.
Entscheidend dabei ist aber, dass die Substratkonzentration, hier die von Harnstoff, nicht zu klein ist. Für kleinere Substratkonzentrationen lässt sich mit diesen Versuchen die Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration, wobei die Zeit konstant gehalten wird, entsprechend der Michaelis-Menten-Theorie veranschaulichen.[8][9]
Geschichte
Die Wirkungen von Urease wurden 1798 von Fourcroy und Vauquelin entdeckt und 1861 von Louis Pasteur mit Mikroorganismen in Zusammenhang gebracht, die 1864 von Van Tieghem als Micrococcus ureae erstbeschrieben wurden. 1876 wurde Bakterien-Urease durch Musculus isoliert und die katalytische Reaktion definiert. Erst die Entdeckung von Sojabohnen-Urease durch T. Takeuchi im Jahr 1909 und folgend deren Herstellung in großen Mengen machten tiefergehende Untersuchungen möglich.[10]
Siehe auch
Literatur
- L. Holm, C. Sander: An evolutionary treasure: unification of a broad set of amidohydrolases related to urease. In: Proteins. Band 28, Nr. 1, Mai 1997, S. 72–82, PMID 9144792.
Weblinks
- chemieunterricht.de: Urease
Einzelnachweise
- Eintrag zu Urease in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Dezember 2021. (JavaScript erforderlich)
- C. Follmer, R. Real-Guerra, G. E. Wasserman, D. Olivera-Severo, C. R. Carlini: Jackbean, soybean and Bacillus pasteurii ureases: biological effects unrelated to ureolytic activity. In: Eur. J. Biochem. Band 271, Nr. 7, April 2004, S. 1357–1363, doi:10.1111/j.1432-1033.2004.04046.x, PMID 15030486.
- U. Dämmgen: Emissionen aus der deutschen Landwirtschaft - Nationaler Emissionsbericht (NIR) 2007 für 2005. Einführung, Methoden und Daten. Landbauforschung Völkenrode, SH 304
- U. Dämmgen: Emissionen aus der deutschen Landwirtschaft - Nationaler Emissionsbericht (NIR) 2007 für 2005. Tab.n, Landbauforschung Völkenrode, SH 304
- The Isolation and Crystallization of the Enzyme Urease. In: Journal of biological Chemistry. Nr. 69, S. 435–441.
- Nobelpreisträger in Chemie 1946, Nobelprize.org, abgerufen am 1. November 2012.
- Martin Leinker: Entwicklung einer Prinziplösung zur Senkung von Ammoniakemissionen aus Nutztierställen mit Hilfe von Ureaseinhibitoren. Diss. Martin-Luther-Univ. Halle-Wittenberg 2007. urn:nbn:de:gbv:3-000012809 (PDF)
- H. Hassinger, R.-D. Wiebusch: Experimentelle Enzymologie. Diesterweg Salle & Sauerländer, 1977, ISBN 3-425-05345-0.
- Dr. Bruno Lange GmbH: Handbuch zum Lange Photometer, Versuchsanleitungen.
- William Robert Fearon: Urease. In: Biochemical Journal. Band 17, Nr. 1, 1923, S. 84–93, bes. S. 84, (PDF; 1,1 MB).

