Merrifield-Synthese
Die Merrifield-Synthese ist ein von dem US-amerikanischen Chemiker Robert Bruce Merrifield entwickeltes Verfahren zur Synthese von Peptiden aus einzelnen Aminosäuren.[1][2][3] Er erhielt dafür 1984 den Nobelpreis für Chemie.[4] Das Verfahren kann automatisiert werden. Der Zeitaufwand für die Verlängerung des Peptids um eine Aminosäureneinheit liegt in der Größenordnung von einigen Minuten bis mehrere Stunden. Bei der Proteinbiosynthese liegt sie bei Sekunden.
Prinzip
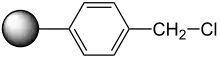
Das Verfahren bedient sich einer festen Phase (Harz) aus Polystyrol, das an der Oberfläche CH2Cl-Gruppen trägt. Diese Festphase wird Merrifield-Harz genannt. Die Synthese besteht aus mehreren einleitenden Schritten, Propagationsschritten und einem abschließenden Reaktionsschritt. Praktisch lassen sich Peptide mit einer Länge von ca. 100 Aminosäuren herstellen.[5]
Einleitende Reaktion
Im ersten Schritt wird eine am N-Terminus geschützte Aminosäure mit dem Rest R1 am C-Terminus an die Oberfläche der festen Phase gebunden. Dabei wird Chlorid im Zuge einer nukleophilen Substitution abgespalten. Da die Aminosäure nun über eine Estergruppe fest an das Substrat gebunden ist, wird gespült, um Reaktionsprodukte und überschüssige Aminosäure zu entfernen.
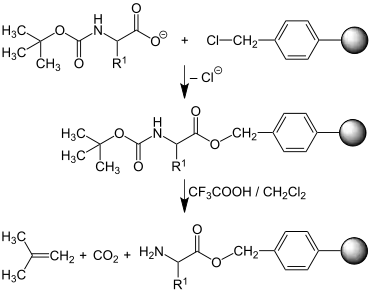
Im nächsten Schritt wird die Schutzgruppe [in der Regel tert-Butyloxycarbonyl (BOC), siehe Abbildung, oder Fluorenylmethoxycarbonyl (Fmoc)] abgespalten. Die an das polymere Substrat gebundene Aminosäure besitzt nun einen reaktiven (freien) N-Terminus. Es wird ein weiteres Mal gespült, um niedermolekulare Verunreinigungen zu entfernen.
Peptidpropagation
Nun setzt man wiederum eine am N-Terminus geschützte und am C-Terminus aktivierte Aminosäure mit dem Rest R2 hinzu. Diese mit Dicyclohexylcarbodiimid (DCC) aktivierte Aminosäure reagiert nun endergonisch mit der bereits gebundenen unter Ausbildung einer Peptidbindung und formaler Abspaltung von Wasser, das als Dicyclohexylharnstoff gebunden wird. Es folgt wiederum eine Spülung. Dann wird die Schutzgruppe der neu hinzugefügten Aminosäure entfernt.

Daraufhin kann man wieder eine N-geschützte Aminosäure mit dem Rest R3 zusetzen und mittels DCC das Peptid um eine dritte N-geschützte Aminosäure verlängern. Durch Abspalten der Schutzgruppe erhält man den immobilisierten Tripeptidester.
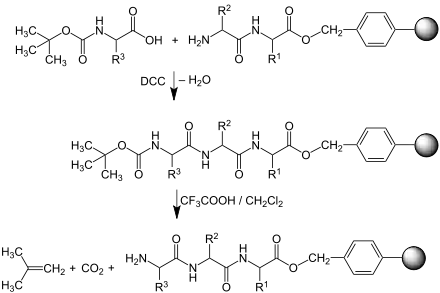
Ggf. können analog weitere N-geschützte Aminosäuren ankondensiert werden.
Abbruch-Reaktion
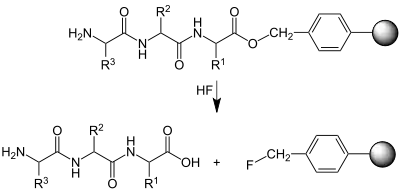
Mit Hilfe von Flusssäure wird die Esterbindung der zuerst eingeführten Aminosäure zum Substrat (polymerer Träger) protoniert und gespalten, so dass das fertige Peptid (hier ein Tripeptid) freigesetzt wird:
Geschichte
Die Entwicklung der Merrifield-Synthese ist eng mit der Entwicklung der Peptidsynthese verwandt. Die erste Festphasensynthese von Peptiden auf festen porösen Polymeren als Substrate wurde 1966 von Bruce Merrifield und Arnold Marglin mit der Merrifield-Synthese am Beispiel von Insulin durchgeführt.[1] Dadurch stieg die Ausbeute pro Reaktionszyklus von 90 % auf 99,5 % und die Nebenreaktionsprodukte und Edukte konnten einfach durch Waschen entfernt werden, wodurch auch längere Peptide mit akzeptabler Ausbeute erzeugt werden konnten.[4] Eine Variante der Merrifield-Synthese namens SPOT-Synthese auf Cellulose-Filterpapier als Matrix wurde 1992 von Ronald Frank beschrieben.[6] Sie wird vor allem zur Epitopkartierung kontinuierlicher Epitope von Antikörpern verwendet.
Einzelnachweise
- Robert Bruce Merrifield, Solid phase peptide synthesis Journal of the American Chemical Society Volume 85, Heft 14 S. 2149–2154, doi:10.1021/ja00897a025.
- A. Marglin, R. B. Merrifield: The synthesis of bovine insulin by the solid phase method. In: Journal of the American Chemical Society. Band 88, Nummer 21, November 1966, S. 5051–5052, PMID 5978833.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 204–222.
- Informationen der Nobelstiftung zur Preisverleihung 1984 an Robert Bruce Merrifield (englisch)
- Erich Wünsch Synthese von Peptid-Naturstoffen: Problematik des heutigen Forschungsstandes Angewandte Chemie Volume 83, Heft 20, S. 773–782, doi:10.1002/ange.19710832002.
- Ronald Frank: Spot-synthesis: an easy technique for the positionally addressable, parallel chemical synthesis on a membrane support. In: Tetrahedron. 48, 1992, S. 9217, doi:10.1016/S0040-4020(01)85612-X.
Literatur
- Weng C. Chan, Peter D. White: Fmoc Solid Phase Peptide Synthesis: A Practical Approach. Oxford University Press, Oxford/ New York 2000, ISBN 0-19-963724-5.