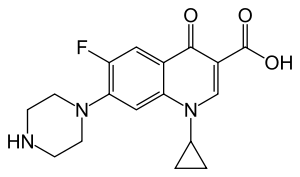
Ciprofloxacin
Ciprofloxacin ist ein synthetisches Antibiotikum mit breitem Wirkspektrum aus der Gruppe der Fluorchinolone. Die Substanz wurde 1981 von einem Forschungschemiker der Firma Bayer (Klaus Grohe) entwickelt und 1983 patentiert. [7][8] Antibiotika dieser Gruppe hemmen die Gyrase von Bakterien und damit deren DNA-Replikation und Zellteilung. Sie verhindern dadurch die Zellteilung, und zwar vor allem von gramnegativen Keimen. Fluorchinolone haben weiterhin eine bakterizide Wirkung, deren Ursache bislang ungeklärt ist.[9][10]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ciprofloxacin | |||||||||||||||||||||
| Andere Namen |
1-Cyclopropyl-6-fluor-4-oxo-7-(piperazin-1-yl)-1,4-dihydrochinolin-3-carbonsäure (IUPAC)
| |||||||||||||||||||||
| Summenformel | C17H18FN3O3 | |||||||||||||||||||||
| Kurzbeschreibung |
schwach gelber, pulverförmiger Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Gyrasehemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
318–320 °C (Ciprofloxacin·Hydrochlorid·Monohydrat)[2] | |||||||||||||||||||||
| pKS-Wert |
6,09[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wegen starker und oftmals langanhaltender oder permanenter Nebenwirkungen geriet das Medikament zunehmend in die Kritik. Die FDA informierte 2008 und 2013 über neu beobachtete schwere Nebenwirkungen bei systemisch angewendeten Fluorchinolonen und ordnete entsprechende Maßnahmen an. 2015 hat sie nach ärztlichen Meldeberichten das Nutzen-Risiko-Verhältnis von Cipro-, Levo-, Moxi- und Ofloxacin neu bewertet und 2016 die Anwendung deutlich eingeschränkt.[11] Auch in EU-Ländern wurden mehrmals Warnhinweise und Anwendungsbeschränkungen für Fluorchinolone verfügt. Die Europäische Arzneimittelagentur hat die schwerwiegenden, potentiell dauerhaften und die Lebensqualität beeinträchtigenden Nebenwirkungen zuletzt 2018 neu bewertet und Anwendungseinschränkungen empfohlen.[12] Das Bundesinstitut für Arzneimittel und Medizinprodukte hat daraufhin am 8. April 2019 in einem umfassenden Bescheid die Indikationen für Fluorchinolone weiter eingeschränkt und eine weitere Aktualisierung der Gebrauchs- und Fachinformationen angeordnet, um auf möglicherweise irreversible Nebenwirkungen hinzuweisen. Ärzte wurden über einen Rote-Hand-Brief am 8. April 2019 informiert, Fluorchinolone bei einfachen Infektionen nicht mehr einzusetzen.[13]
Wirkungsspektrum
Das Wirkspektrum umfasst neben Enterobakterien weitere gramnegative Erreger wie Haemophilus- und Salmonella-Species und Pseudomonaden (Problemkeim Pseudomonas aeruginosa).[14] Ciprofloxacin eignet sich somit gegen bakterielle Erreger einer infektiösen Darmerkrankung. Bei komplizierten Harnwegsinfektionen, die auch von Darmbakterien oder unter Umständen von Pseudomonaden ausgelöst werden, gilt es als Reserveantibiotikum. Weitere Anwendungsgebiete sind Infektionen der Vorsteherdrüse, der Gallenwege, der Atemwege, der Bauchhöhle (Peritonitis) und viele andere Infektionskrankheiten bei Nachweis eines entsprechend empfindlichen Erregers;[15] auf diesen Nachweis kann z. B. bei Infekten des äußeren Gehörgangs verzichtet werden.[16] Ciprofloxacin ist auch zur Prophylaxe und Heilbehandlung nach Inhalation von Milzbranderregern zugelassen.[15] Ciprofloxacin kann wie andere moderne Chinolone neben Makroliden und Rifampicin zur Behandlung der Pneumonie durch Legionellen eingesetzt werden.[17]
Ciprofloxacin hemmt E. Coli-Topoisomerasen ab einer Konzentration von 0,012 mg/l. Dies ist die minimale Hemmkonzentration (MHK). Sie verursacht bei E. Coli zwar reversible, aber nachweisliche DNA-Schäden.[18] Die MHK anderer Spezies beträgt: Enterobacter cloacae 0,03–1 mg/l, Proteus mirabilis 0,03–0,5 mg/l, Pseudomonas aeruginosa 0,25–8 mg/l, Klebsiella spp. 0,06–1 mg/l, Streptococcus spp. 0,5–4 mg/l, Bacteroides spp. 8 mg/l, Enterococcus faecalis 0,5–64 mg/l und Staphylococcus aureus 0,46–2 mg/l.[19]
Ciprofloxacin wirkt weiterhin zytotoxisch und zytostatisch auf menschliches Gewebe: Nekrose von Knorpelzellen wurde ab 1 mg/l beobachtet,[20] DNA-Fragmentierung und Apoptose von T-Zellen ab 2,5 mg/l,[21] Mitochondrienschäden und Apoptose von Sehnenzellen ab 3 mg/l,[22] Proliferationshemmung von Fibroblasten ab 5 mg/l,[23] Schädigung der mitochondrialen DNA (mtDNA) und Wachstumshemmung ab 20 mg/l,[24] und Unterbrechung des Zellzyklus, Genommutation sowie Verlust der mtDNA ab 25 mg/l.[25][26] Die zytotoxische und zytostatische Wirkung von Ciprofloxacin ist für eine mögliche Anwendung in der Chemotherapie zur Behandlung von Krebszellen von Interesse.[27] Im umu-Test zeigte Ciprofloxacin jedoch eine deutlich stärkere genotoxische Wirkung als die Chemotherapeutika Etoposid, Doxorubicin, Cisplatin, Fluorouracil, Dacarbazin, Bleomycin und Mitomycin C (siehe auch Genotoxisches Potential).[28]
Anwendung
Die Anwendung und damit auch Dosierung von Ciprofloxacin ist abhängig von der zu behandelnden Infektionserkrankung. Allgemein wird Ciprofloxacin zweimal täglich verabreicht, vorzugsweise peroral (p.o.), alternativ auch intravenös. Zur Therapie der Gonorrhoe (Tripper) ist schon eine einmalige Gabe von 500 mg Ciprofloxacin p.o. in Tablettenform ausreichend. Es sind auch Zubereitungen für eine örtliche Anwendung als Ohren- und Augentropfen erhältlich.
Bei normaler Anwendung (500 mg Einzeldosis bei einer 70 kg schweren Person) beträgt die Konzentration 3 mg/l in Serum/Muskeln, 6–9 mg/l in Prostata/Darm, 18–21 mg/l in Granulozyten, 6–30 mg/l in der Lunge und 15–30 mg/l in der Galle.[29] Die maximale Serumkonzentration von Ciprofloxacin wird eine Stunde nach Einnahme erreicht. Die Halbwertszeit beträgt 4 Stunden. Ciprofloxacin wird zu 40–50 % unverändert über den Urin ausgeschieden[30][31] und zu 25–40 % metabolisiert.[32] Von den identifizierten Metaboliten wirken einige schwächer und andere stärker als das ursprüngliche Ciprofloxacin.[33]
Bei Infektionen die unbehandelt besser werden oder nicht schwerwiegend sind, wird empfohlen Fluorchinolone nicht mehr anzuwenden. Hierzu zählen Infekte des Halses, abakterielle (chronische) Prostatitis, Bronchitis, Sinusitis, Prophylaxe der Reisediarrhoe sowie wiederkehrende Infektionen der unteren Harnwege (Harnwegsinfekte, die nicht über die Blase hinausgehen). Zur Behandlung leichter oder mittelschwerer bakterieller Infektionen sollen sie nur angewendet werden, falls andere üblicherweise für diese Infektionen empfohlene Antibiotika nicht verwendet werden können. Es ist wichtig, dass Fluorchinolone generell bei Patienten, die zuvor schwerwiegende Nebenwirkungen mit einem Fluorchinolon- oder Chinolon-Antibiotikum hatten, vermieden werden sollten. Sie sollten bei älteren Patienten, Patienten mit Nierenerkrankungen und Patienten, die sich einer Organtransplantation unterzogen haben, mit besonderer Vorsicht angewendet werden, da bei diesen Patienten ein höheres Risiko für eine Sehnenverletzung besteht.[34][35]
Nebenwirkungen
Häufigste Nebenwirkungen (jedoch unter 10 %) sind Übelkeit, Durchfall und Hautausschläge. Nach prophylaktischer Gabe einer Einzeldosis Ciprofloxacin an 1.390 Schüler wurde eine Nebenwirkungshäufigkeit von 44 % beobachtet, wobei es am häufigsten zu Störungen des Nervensystems kam.[36] Akute Leberschäden treten mit einer Häufigkeit von 1:154 auf.[37] Das Risiko für Sehnenschäden beträgt bei Ciprofloxacin 1:227.[38] In einer Gruppe von 65-jährigen und älteren Patienten erlitten nach der Einnahme von Fluorchinolonen 2,1 % einen Sehnenriss, 1,1 % ein Aortenaneurysma und 0,2 % eine Netzhautablösung.[39] Nebenwirkungen können um Tage bis Wochen verzögert auftreten und langfristig an Intensität zunehmen. Die Nebenwirkungen halten im Durchschnitt 14 Monate bis 9 Jahre an[40] und äußern sich häufig als Konstellation verschiedener Symptome (Erschöpfung, Konzentrationsprobleme, Neuropathien, Tendinopathien und mehr).[41]
Schwerwiegende Nebenwirkungen von Fluorchinolonen sind nicht effektiv behandelbar, daher führen sie in 29,3 % der Fälle zu einer körperlichen Behinderung. Im Vergleich zu anderen gängigen Antibiotika sind Fluorchinolone für die meisten dauerhaften Behinderungen verantwortlich.[42] Der FDA wurden für Fluorchinolone bis 2016 insgesamt 210.705 Verdachtsfälle auf Nebenwirkungen sowie 2.991 Todesfälle gemeldet. Für Ciprofloxacin wurden davon bei 22.488 Patienten insgesamt 100.865 Verdachtsfälle auf Nebenwirkungen und 2.072 Todesfälle gemeldet.[43] Aufgrund der geringen Melderate von 1–10 % wird in den USA die Dunkelziffer an fluorchinolonassoziierten Nebenwirkungen auf 2–21 Millionen sowie die Dunkelziffer an Todesfällen auf 29.000 bis über 299.000 geschätzt.[44] Todesfälle sind bereits ab der ersten Tagesdosis möglich.[3][45]
Ciprofloxacin kann aufgrund seiner Chondrotoxizität Knorpelschäden bei Kindern und Erwachsenen verursachen.[20] Fluorchinolone haben im Tierversuch bei jungen Hunden Störungen des Knorpelwachstums verursacht, deshalb sollen sie nicht in der Schwangerschaft, Stillzeit und nicht bei Kindern eingesetzt werden. Davon abweichend ist Ciprofloxacin aufgrund seiner Wirksamkeit gegen Pseudomonas jedoch zur Behandlung von Kindern und Jugendlichen (5–17 Jahre) mit akuten, durch P. aeruginosa verursachten Infektionsschüben einer zystischen Fibrose zugelassen. Weitere Nebenwirkungen sind Neurotoxizität, Lebertoxizität und allergische Reaktionen, auch das Red man syndrome wurde beschrieben. Des Weiteren gibt es mehrere Studien, die den Nachweis erbrachten, dass Ciprofloxacin die Krampfschwelle senken kann: Ein Einsatz bei Patienten mit Anfallsleiden sollte daher nur unter strenger Indikationsstellung erfolgen.[46][47]
2015 wurde in einer Studie gezeigt, dass Fluorchinolone durch Eisen-Chelation der α-Ketoglutarat-abhängigen Dioxygenase den Cofaktor Eisen entziehen. Das könnte die Kollagenreifung stören sowie epigenetische Veränderungen auslösen. Die Autoren schlagen das als eine Ursache für die Fluorchinolon-induzierten Nierenschäden und Tendopathien (Sehnenschädigungen) vor.[48]
Es können Schmerzen, Schwellungen, Risse und Entzündungen der Sehnen aufkommen, einschließlich der Rückseite des Knöchels (auch Schulter-, Hand- oder andere Sehnensysteme). Dies gilt für Menschen aller Altersgruppen, die Fluorchinolon-Antibiotika einschließlich Ciprofloxacin einnehmen. Der häufigste Bereich der Schmerzen und Schwellungen ist die Achillessehne. Sehnenrupturen können während oder auch noch mehrere Monate nach der Einnahme von Ciprofloxacin erfolgen. Das Risiko von Sehnen-Schäden ist bei Patienten über 60 Jahren höher, vor allem bei Einnahme von Steroiden (Kortikosteroide) oder nach Nieren-, Herz- oder Lungentransplantation. Sehnenschwellungen (Tendinitis) und -risse (Bruch) wurden auch bei Patienten, die Fluorchinolone einnahmen, aber keine der übrigen v.g. Risikofaktoren aufwiesen, festgestellt. Nach einer Feststellung besagter Folgen sollen Bewegungen vermieden werden.[50] Erklärt wird die Nebenwirkung mit einer erhöhten Wirksamkeit von Matrix-Metalloproteinasen, die die Festigkeit der Sehnen herabsetzen können.[51]
Vor den teilweise irreversiblen schwerwiegenden Nebenwirkungen wird in den USA auf dem Beipackzettel des Antibiotikums mittels einer Black-Box-Warnung gewarnt. In der Warnung wird auch darauf hingewiesen, dass das Mittel nicht erste Wahl sein sollte bei akuten Exazerbationen der chronischen Bronchitis, bei akuten unkomplizierten Blasenentzündungen und akuten Sinusitiden.[52]
Selten sind psychotische Störungen mit Suizidtendenz.[53][54] Auf Pharmakovigilanz-Erhebungen der WHO beruhende Studienergebnisse legen jedoch nahe, dass Fluorchinolone mit einem signifikant erhöhten Risiko für Suizidalität und vollendeten Suizid assoziiert sind. Entsprechende Fälle nahmen seit 2008 deutlich zu und wurden am häufigsten nach der Einnahme von Ciprofloxacin beobachtet.[55] Laut Bekanntmachung der Arzneimittelkommission der deutschen Ärzteschaft ist eine hohe Dunkelziffer vollendeter Suizide nach Fluorchinolonanwendung anzunehmen.[56]
Ferner wurde ein erhöhtes Risiko für das Auftreten von Aortenaneurysmen und -dissektionen festgestellt. In Deutschland ordnete das Bundesinstitut für Arzneimittel und Medizinprodukte im Oktober 2018 für alle systemisch und inhalativ angewendete Fluorchinolone, inklusive Ciprofloxacin, eine entsprechende Information in den Produktinformationstexten an.[57]
Aufgrund von Störungen des Blutzuckerspiegels, einschließlich Hypoglykämie und Hyperglykämie, durch Fluorchinolone[58] ordnete das Bundesinstitut für Arzneimittel und Medizinprodukte im Februar 2019 eine weitere Aktualisierung der Produktinformationstexte für Ciprofloxacin (für die systemische Anwendung) an.[59] Bei Diabetikern kann Ciprofloxacin schon nach einer Einzeldosis lebensbedrohliche Hypoglykämien auslösen.[60] Auch bei Nicht-Diabetikern kann es unter Ciprofloxacin zu Dysglykämien kommen.[61] Mögliche Komplikationen Fluorchinolon-induzierter Blutzuckerstörungen bestehen in zentralnervösen Effekten (Krampfanfall, Koma) mit dauerhaften neurologischen Defiziten.[62] Der Pathomechanismus ist mit erhöhten zytosolischen Calciumkonzentrationen und Beeinträchtigungen der Mitochondrienfunktion in pankreatischen Betazellen assoziiert.[63][64][65] Fluorchinolone stehen im Verdacht, für eine Zunahme des Typ-2-Diabetes in den USA verantwortlich zu sein.[66]
Wechselwirkungen
Patienten mit Herzrhythmusstörungen oder Krampfanfällen in der Vorgeschichte sollten coffeinhaltige Lebens- (z. B.: Kaffee, Cola, schwarzen Tee, grünen Tee) und Arzneimittel (häufig Schmerzmittelkombination, Erkältungsmittel) meiden. Der Abbau von Coffein wird durch Cytochrom P450 (Isoenzym 1A2) katalysiert. Einige Gyrasehemmer greifen in den Coffeinmetabolismus ein und blockieren das Cytochrom P450, wodurch der Hauptabbauweg der N-Demethylierung zum Paraxanthin betroffen ist. Dadurch kommt es zu einer Wirkungsverstärkung des Coffeins. Eine vergleichbare Wechselwirkung tritt mit dem strukturähnlichen Methylxantin Theophyllin auf.
Ciprofloxacin hemmt auch das Cytochrom P450 3A4.[67] Dieses Isoenzym metabolisiert 50 % der gängigen Arzneimittel und zählt somit zu den wichtigsten Vertretern der CYP-Familie. Eine Hemmung von CYP3A4 beeinträchtigt gleichzeitig die Entgiftungskapazität der PGP-Pumpe.[68]
Ciprofloxacin darf nicht zusammen mit Quetiapin eingenommen werden, da der Abbau vom Quetiapin deutlich verlangsamt werden kann.
Ciprofloxacin darf nicht zusammen mit Lebens- oder Arzneimitteln, die über einen (hohen) Anteil mehrfach geladener Metallionen verfügen, eingenommen werden (nicht zusammen z. B. mit Milch oder Milchprodukten (Ca2+) oder Antazida (z. B. Mg2+)), da es hier im Rahmen einer Komplexbildung zwischen Metallionen und Wirkstoff zu einer relevanten Abschwächung der Wirkung desselben kommt.[69]
Da Ciprofloxacin zu den Fluorchinolonen gehört, könnte es, wie andere Antibiotika dieser Gruppe, die Wirksamkeit hormoneller Kontrazeptiva herabsetzen. Für den speziellen Fall von Ciprofloxacin hat sich ein solcher Verdacht jedoch bisher nicht bestätigt. In der aktuellen Packungsbeilage von Ciprofloxacin (Stand 2006) wird eine Wechselwirkung zwischen diesem Antibiotikum und hormonellen Kontrazeptiva nicht erwähnt. Mindestens zwei klinische Studien belegen, dass Ciprofloxacin die Wirksamkeit der Antibabypille nicht beeinträchtigt.[70][71] Die Nicht-Beeinträchtigung hormoneller Kontrazeptiva war auch der Grund, dass Ciprofloxacin statt Rifampicin an 4253 Student(inn)en der Universität Oxford ausgegeben wurde, um die Ausbreitung einer Meningokokken-Meningitis zu verhindern.[72]
Grapefruits und deren Saft können die Bioverfügbarkeit, also die Wirksamkeit von Ciprofloxacin, signifikant verringern (siehe hierzu den Artikel Grapefruit, Abschnitt „Wechselwirkung mit Arzneimitteln“). Auch ein zeitlicher Abstand zwischen der Einnahme von Ciprofloxacin und dem Genuss von Grapefruit(saft) im Tagesverlauf verhindert diese Wechselwirkung nicht, da der Abbau der hierfür verantwortlichen Inhaltsstoffe der Grapefruit mehrere Tage dauert.
Ciprofloxacin kann mit einer Schilddrüsenhormon-Ersatztherapie wechselwirken und die Wirkung von Levothyroxin beeinträchtigen.[73]
Genotoxisches Potential
In prokaryotischen Testsystemen hat sich Ciprofloxacin als stark genotoxisch und hoch mutagen erwiesen.[74][75][76][28] In humanspezifischen Testsystemen induziert Ciprofloxacin Chromosomenaberrationen und Aneuploidie.[77][78] Die hierbei untersuchten Konzentrationen (5 – 25 µg/ml) entsprechen therapeutischen Gewebespiegeln.[79] Im Mausmodell führte Ciprofloxacin bei einer dem humantherapeutischen Dosisbereich vergleichbaren Exposition zu Erbgutschäden.[80][81] Neben der nukleären DNA kann auch die mitochondriale DNA geschädigt werden.[82] Die Einnahme von Ciprofloxacin erhöht möglicherweise das Hautkrebsrisiko.[83] Klinische Beobachtungen legen nahe, dass Ciprofloxacin speziell bei langfristiger Behandlung immunsupprimierter Patienten hochaggressive, metastasierende und rezidivierende Plattenepithelkarzinome induzieren kann.[84]
Anwendung in der Schwangerschaft/Stillzeit
Ciprofloxacin verfügt über reproduktionstoxisches Potential: in vivo kam es bei therapeutisch relevanten Dosierungen zu embryotoxischen (u. a. Früh-, Fehl- und Totgeburten, Fehlbildungen, Organschäden)[85][86][87][88] und die Fortpflanzungsfähigkeit beeinträchtigenden Effekten (u. a. hormonelle Störungen, Störungen der Spermatogenese, ultrastrukturelle Spermienschäden, Hodenatrophie). So wurden u. a. DNA Schäden der Spermien nachgewiesen, welche reduzierte Fruchtbarkeit und embryonale Missbildungen im Mausmodell zur Folge hatten.[89][90][91][92] In begrenzten Untersuchungen an exponierten Schwangeren wurden Totgeburten beobachtet.[93][94] Laut Fachinformation (Stand 01/2019) zeigen verfügbare Daten zur Anwendung von Ciprofloxacin bei schwangeren Frauen keine Hinweise auf Fehlbildungen oder fötale/neonatale Toxizität.[95] Zudem liegen laut Fachinformation keine tierexperimentellen Hinweise auf Reproduktionstoxizität vor.[95] Es wird darauf hingewiesen, dass Ciprofloxacin in die Muttermilch übergeht und in der Schwangerschaft und während der Stillzeit wegen möglicher gelenkschädigender Wirkungen nicht eingenommen werden sollte.[95] Laut Zulassungsdaten der Europäischen Arzneimittel-Agentur sind auch andere schwere embryotoxische Effekte möglich.[96]
Handelsnamen
Agyr (A), Ciloxan (D, A, CH), Ciprobay (D), Ciproxin (A, CH), InfectoCipro (D), Keciflox (D), Otanol (A), Panotile Cipro (D), Quinox (T) zahlreiche Generika (D, A, CH)
Weblinks
Weiterführende Literatur
- P. C. Scholten, R. M. Droppert u. a.: No interaction between ciprofloxacin and an oral contraceptive. In: Antimicrobial agents and chemotherapy. Band 42, Nummer 12, Dezember 1998, S. 3266–3268, PMID 9835524. PMC 106032 (freier Volltext).
- R. Davis, A. Markham, J. A. Balfour: Ciprofloxacin. An updated review of its pharmacology, therapeutic efficacy and tolerability. In: Drugs. Band 51, Nummer 6, Juni 1996, S. 1019–1074, PMID 8736621.
- Anu Hangas, Koit Aasumets, Nina J Kekäläinen, Mika Paloheinä, Jaakko L Pohjoismäki, Joachim M Gerhold, Steffi Goffart: Ciprofloxacin impairs mitochondrial DNA replication initiation through inhibition of Topoisomerase 2. In: Nucleic Acids Research. 46, 2018, S. 9625–9636, doi:10.1093/nar/gky793.
Einzelnachweise
- Datenblatt Ciprofloxacin, ≥98.0% (HPLC) bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF)..
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 386–387, ISBN 978-0-911910-00-1.
- Eintrag zu Ciprofloxacin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Journal of Medicinal Chemistry. Vol. 33, S. 1344, 1990.
- Zhongguo Yaoxue Zazhi. Chinese Pharmaceutical Journal. Vol. 27, S. 297, 1992.
- Shmuel Fuchs, Zvi Simon, Mayer Brezis: Fatal hepatic failure associated with ciprofloxacin. In: The Lancet. 343, 1994, S. 738, doi:10.1016/S0140-6736(94)91624-1.
- Patent DE3142854: 1-Cyclopropyl-6-fluor-1,4-dihydro-4-oxo-7-piperazino-chinolin-3-carbonsäuren, Verfahren zu ihrer Herstellung sowie diese enthaltende antibakterielle Mittel. Angemeldet am 9. Oktober 1981, veröffentlicht am 11. Mai 1983, Anmelder: Bayer, Erfinder: Klaus Grohe, Hans-Joachim Zeiler, Karl Georg Metzger.
- Patent DE3033157: 7-Amino-1-cyclopropyl-4-oxo-1,4-dihydro-naphthyridin-3-carbonsäuren, Verfahren zu ihrer Herstellung sowie diese enthaltende antibakterielle Mittel. Angemeldet am 3. September 1980, veröffentlicht am 1. April 1982, Anmelder: Bayer, Erfinder: Klaus Grohe, Hans-Joachim Zeiler, Karl Georg Metzger.
- María Tamayo, Rebeca Santiso, Jaime Gosalvez, Germán Bou, José Luis Fernández: Rapid assessment of the effect of ciprofloxacin on chromosomal DNA from Escherichia coli using an in situ DNA fragmentation assay. In: BMC Microbiology. Band 9, Nr. 13, April 2009, PMC 2670838 (freier Volltext).
- Xilin Zhao, Robert J. Kerns, Muhammad Malik, Karl Drlica: Quinolone-Mediated Bacterial Death. In: Antimicrobial Agents and Chemotherapy. Band 52, Nr. 2, 1. Februar 2008, S. 385–392, doi:10.1128/AAC.01617-06, PMID 17724149 (asm.org [abgerufen am 28. Januar 2019]).
- Center for Drug Evaluation and Research: Drug Safety and Availability - FDA Drug Safety Communication: FDA advises restricting fluoroquinolone antibiotic use for certain uncomplicated infections; warns about disabling side effects that can occur together. Abgerufen am 31. Januar 2019 (englisch).
- Quinolone- and fluoroquinolone-containing medicinal products, EMA, abgerufen am 27. März 2019.
- BfArM - Risikobewertungsverfahren - Fluorchinolone: Schwere und langanhaltende Nebenwirkungen im Bereich Muskeln, Gelenke und Nervensystem. Abgerufen am 9. April 2019.
- G. Geisslinger et al.: Mutschler Arzneimittelwirkungen. 11. Auflage. WVG, Stuttgart 2019, S. 1015 ff.
- Fachinformation Ciprofloxacin Stada 100/250/500/750 mg Filmtabletten, Stadapharm GmbH, Stand Juli 2019.
- Fachinformation INFECTOCIPRO® 2mg/ml Ohrentropfen | Gelbe Liste. Abgerufen am 28. September 2017.
- S. Ewig, P. Tuschy , G. Fätkenheuer: Diagnostik und Therapie der Legionellen-Pneumonie. In: Pneumologie. Band 56 (2002), S. 695–703, doi:10.1055/s-2002-35548.
- María Tamayo, Rebeca Santiso, Jaime Gosalvez, Germán Bou, José Luis Fernández: Rapid assessment of the effect of ciprofloxacin on chromosomal DNA from Escherichia coli using an in situ DNA fragmentation assay. In: BMC Microbiology. Band 9, Nr. 13, April 2009, PMID 19364397.
- Sora Schipper: Verteilung und Pharmakokinetik von Fluorchinolonen im Pankreas der Ratte. (PDF) Medizinischen Fakultät der Universität Rostock, 2011, abgerufen am 31. Januar 2019.
- W. B. Graninger, W. Graninger, R. Ullrich, M. Köller, L. Erlacher: Effects of ciprofloxacin and ofloxacin on adult human cartilage in vitro. In: Antimicrobial Agents and Chemotherapy. Band 41, Nr. 11, 1. November 1997, S. 2562–2565, doi:10.1128/AAC.41.11.2562, PMID 9371369 (asm.org [abgerufen am 28. Januar 2019]).
- Yong-Taek Jun, Hee-Jung Kim, Min-Jin Song, Ji-Hyang Lim, Dong-Gun Lee: In Vitro Effects of Ciprofloxacin and Roxithromycin on Apoptosis of Jurkat T Lymphocytes. In: Antimicrobial Agents and Chemotherapy. Band 47, Nr. 3, März 2003, PMID 12604563.
- Judith Sendzik, Mehdi Shakibaei, Monika Schäfer-Korting, Ralf Stahlmann: Fluoroquinolones cause changes in extracellular matrix, signalling proteins, metalloproteinases and caspase-3 in cultured human tendon cells. In: Toxicology. Band 212, Nr. 1, 15. August 2005, S. 24–36, doi:10.1016/j.tox.2005.04.002.
- R. J. Williams, E. Attia, T. L. Wickiewicz, J. A. Hannafin: The effect of ciprofloxacin on tendon, paratenon, and capsular fibroblast metabolism. In: The American Journal of Sports Medicine. Band 28, Nr. 3, Mai 2000, PMID 10843129.
- J. W. Lawrence, S. Darkin-Rattray, F. Xie, A. H. Neims, T. C. Rowe: 4-Quinolones cause a selective loss of mitochondrial DNA from mouse L1210 leukemia cells. In: Journal of Cellular Biochemistry. Band 51, Nr. 2, Februar 1993, PMID 8440750.
- R. Koziel, J. Szczepanowska, A. Magalska, K. Piwocka, J. Duszynski: Ciprofloxacin inhibits proliferation and promotes generation of aneuploidy in Jurkat cells. In: Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. Band 61, Nr. 2, April 2010, PMID 20436225.
- Rafał Kozieł, Krzysztof Zabłocki, Jerzy Duszyński: Calcium Signals Are Affected by Ciprofloxacin as a Consequence of Reduction of Mitochondrial DNA Content in Jurkat Cells. In: Antimicrobial Agents and Chemotherapy. Band 50, Nr. 5, Mai 2006, PMID 16641433.
- TOMASZ KLOSKOWSKI, NATALIA GURTOWSKA, JOANNA OLKOWSKA, JAKUB MARCIN NOWAK, JAN ADAMOWICZ: Ciprofloxacin is a potential topoisomerase II inhibitor for the treatment of NSCLC. In: International Journal of Oncology. Band 41, Nr. 6, Oktober 2012, PMID 23042104.
- Andreas Hartmann, Alfredo C. Alder, Theo Koller, Rosa M. Widmer: Identification of fluoroquinolone antibiotics as the main source of umuC genotoxicity in native hospital wastewater. (PDF) 1998, abgerufen am 20. Januar 2019.
- Quinolone Antibacterials (= Handbook of Experimental Pharmacology). Springer-Verlag, Berlin Heidelberg 1998, ISBN 978-3-642-80366-6 (springer.com [abgerufen am 31. Januar 2019]).
- G Höffken, H Lode, C Prinzing, K Borner, P Koeppe: Pharmacokinetics of ciprofloxacin after oral and parenteral administration. In: Antimicrobial Agents and Chemotherapy. Band 27, Nr. 3, März 1985, PMID 3158275.
- Dakshina M. Chilukuri, Jenny J. Zheng: CLINICAL PHARMACOLOGY AND BIOPHARMACEUTICS REVIEW. (PDF) In: www.fda.gov. FDA, März 2004, abgerufen im Januar 2019 (englisch).
- Siporin, Clifford, 1949-, Heifetz, Carl L., 1935-, Domagala, John M., 1951-: The New generation of quinolones. Hrsg.: M. Dekker. New York 1990, ISBN 0-8247-8224-0.
- R Wise, R M Lockley, M Webberly, J Dent: Pharmacokinetics of intravenously administered ciprofloxacin. In: Antimicrobial Agents and Chemotherapy. Band 26, Nr. 2, August 1984, PMID 6486762.
- Quinolone- and fluoroquinolone-containing medicinal products | European Medicines Agency. Abgerufen am 2. Februar 2019.
- Wissenschaftliches Institut der AOK (WIdO): Meldung. Archiviert vom Original am 3. Februar 2019; abgerufen am 3. Februar 2019.
- Los Angeles County Department of Public Health: Follow-up Survey Of Side Effects Of Single Dose Ciprofloxacin For Prophylaxis Of Meningococcal Disease In A Los Angeles County High School. (PDF) Archiviert vom Original am 30. April 2019; abgerufen am 6. März 2021 (englisch).
- Xiao-Yu Wang, Yuan-Jie Xu, Man Zhu, Wang-Ping Jia, Dai-Hong Guo: Incidence, clinical features, and risk factors of fluoroquinolone-induced acute liver injury: a case-control study. 8. März 2019, abgerufen am 14. März 2019 (englisch).
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Fluorochinolone: Entzündungen und Rupturen der Achillessehne. (PDF) AkdÄ, abgerufen am 27. Januar 2019.
- Donald A. Redelmeier, Hong Lu, Nick Daneman: Fluoroquinolones and collagen associated severe adverse events: a longitudinal cohort study. In: BMJ Open. Band 5, Nr. 11, 1. November 2015, S. e010077, doi:10.1136/bmjopen-2015-010077, PMID 26582407 (bmj.com [abgerufen am 27. Januar 2019]).
- Center for Drug Evaluation and Research: Drug Safety and Availability - FDA Drug Safety Communication: FDA updates warnings for oral and injectable fluoroquinolone antibiotics due to disabling side effects. Abgerufen am 28. Januar 2019 (englisch).
- Krzysztof Michalak, Aleksandra Sobolewska-Włodarczyk, Marcin Włodarczyk, Justyna Sobolewska, Piotr Woźniak: Treatment of the Fluoroquinolone-Associated Disability: The Pathobiochemical Implications. In: Oxidative Medicine and Cellular Longevity. Band 2017, 2017, PMID 29147464.
- FDA: FDA/CDER Drug Information Webinar - Fluoroquinolone Safety Labeling Changes. (PDF) In: www.fda.gov. FDA, April 2017, abgerufen am 22. Januar 2019.
- Kamaljeet Kaur, Raja Fayad, Arpit Saxena, Norma Frizzell, Anindya Chanda: Fluoroquinolone-related neuropsychiatric and mitochondrial toxicity: a collaborative investigation by scientists and members of a social network. In: The Journal of Community and Supportive Oncology. Band 14, Nr. 2, Februar 2016, PMID 26955658.
- Charles Bennett M.D. Ph.D. M.P.P.: Should Black Box Warnings for Fluoroquinolones be Revised: Is the Bar Set Too High? (PDF) Pharmed Out Conference, Juni 2015, abgerufen am 27. Januar 2019 (englisch).
- Shmuel Fuchs, Zvi Simon, Mayer Brezis: Fatal hepatic failure associated with ciprofloxacin. In: The Lancet. 343, 1994, S. 738, doi:10.1016/S0140-6736(94)91624-1.
- J. M. Kushner, H. J. Peckman, C. R. Snyder: Seizures associated with fluoroquinolones. In: Ann Pharmacother. Band 35, 2001, S. 1194–1198.
- T. O. Grøndahl, I. A. Langmoen: Epileptogenic effect of antibiotic drugs. In: J Neurosurg. Band 78, 1993, S. 938–943.
- S. Badal, Y. F. Her, L. J. Maher: Non-antibiotic effects of fluoroquinolones in mammalian cells. In: The Journal of biological chemistry. [elektronische Veröffentlichung vor dem Druck] Juli 2015, doi:10.1074/jbc.M115.671222, PMID 26205818.
- Victor E Reviglio, Melinda A Hakim, Jae K Song, Terrence P O'Brien: Effect of topical fluoroquinolones on the expression of matrix metalloproteinases in the cornea. In: BMC Ophthalmology. Band 3, 6. Oktober 2003, PMID 14529574.
- CIPRO Medication Guide - Reference ID: 2910764; BAYER Health Care Pharmaceuticals Inc, Wayne, NJ 07470 3/2011 (PDF; 281 kB)
- H. Vyas, G. Krishnaswamy: Quinolone-associated rupture of the Achilles' tendon. In: New England Journal of Medicine, 2007. Artikel 357 (20): 2067.
- Richard L. Elliott: Third World Diseases S. 76–77.
- Suizidalität unter Levofloxacin (TAVANIC) und anderen Gyrasehemmern. Arznei-Telegramm 37: 67-8, 1. Juli 2006.
- Gyrasehemmer und Suizid. Arznei-Telegramm 8: 87, 1995.
- J. Samyde, P. Petit, D. Hillaire-Buys, J. L. Faillie: Quinolone antibiotics and suicidal behavior: analysis of the World Health Organization’s adverse drug reactions database and discussion of potential mechanisms. In: Psychopharmacology. April 2016, doi:10.1007/s00213-016-4300-3.
- Suizidalität unter der Behandlung mit 5-Fluorchinolon-Antibiotika (Aus der UAW-Datenbank). Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 14. Januar 2016.
- Rote-Hand-Brief zu systemisch und inhalativ angewendeten Fluorchinolonen: Risiko für Aortenaneurysmen und Aortendissektionen. In: bfarm.de. Bundesinstitut für Arzneimittel und Medizinprodukte, 26. Oktober 2018, abgerufen am 26. Oktober 2018.
- Evaluation of procedure PSUSA/00000775/201801, Minutes of the PRAC meeting on 01-04 Oktober 2018.
- BfArM - PSUR Single Assessment (PSUSA) - Umsetzung des einstimmigen Beschlusses der Koordinierungsgruppe EMA/CMDh/689167/2018 vom 17.10.2018 betreffend die Zulassungen für Humanarzneimittel mit dem Wirkstoff Ciprofloxacin (systemische Anwendung). Archiviert vom Original am 2. April 2019; abgerufen am 6. März 2021.
- Elvia Canseco, Theodoros Kelesidis: Quinolone-induced Hypoglycemia: A Life-threatening but Potentially Reversible Side Effect. In: The American Journal of Medicine. Band 123, Nr. 2, 1. Februar 2010, S. e5–e6, doi:10.1016/j.amjmed.2009.07.022.
- Wissam K Kabbara, Wijdan H Ramadan, Peggy Rahbany, Souhaila Al-Natour: Evaluation of the appropriate use of commonly prescribed fluoroquinolones and the risk of dysglycemia. In: Therapeutics and Clinical Risk Management. Band 11, Nr. 22, 2015, PMID 25960658.
- Anita Rachlis, Sandra Knowles, Elizabeth Phillips, William Cornish, Andrew E. Simor: Analysis of Spontaneous Reports of Hypoglycemia and Hyperglycemia Associated with Marketed Systemic Fluoroquinolones Made to the Canadian Adverse Drug Reaction Monitoring Program. In: The Canadian Journal of Hospital Pharmacy. Band 57, Nr. 1, 2004, doi:10.4212/cjhp.v57i1.345 (cjhp-online.ca [abgerufen am 19. Februar 2019]).
- Hany Ghaly, Christine Kriete, Seher Sahin, Anja Pflöger, Ulrike Holzgrabe: The insulinotropic effect of fluoroquinolones. In: Biochemical Pharmacology. Band 77, Nr. 6, 2009, PMID 19073153.
- H. Ghaly, K. Hatlapatka, I. Rustenbeck: The insulinotropic effect of fluoroquinolones is counteracted by their inhibitory effect on pancreatic beta cell energy metabolism. In: Diabetologie und Stoffwechsel. Band 5, Nr. 3, 2010, doi:10.1055/s-0030-1255203.
- Effect of fluoroquinolones on mitochondrial function in pancreatic beta cells | Request PDF. Abgerufen am 19. Februar 2019 (englisch).
- Stephen J. Telfer: Fluoroquinolone antibiotics and type 2 diabetes mellitus. In: Medical Hypotheses. Band 83, Nr. 3, 2014, PMID 24947193.
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Pharmakokinetische Wechselwirkungen: Das Interaktionspotenzial der Fluorchinolone. Hrsg.: Holger Petri. 2016 (aerzteblatt.de [abgerufen am 24. Februar 2018]).
- R. Stahlmann: CYP450 und p-Glycoprotein vermittelte Arzneimittelinteraktionen. (PDF) Frühjahrstagung Sektion Antimykotische Therapie der PEG., 7. Mai 2004, archiviert vom Original am 18. Juni 2018; abgerufen am 24. Februar 2018.
- Gelbe Liste: Cipro - 1 A Pharma® 500 mg, Filmtbl.
- F. Maggiolo, G. Puricelli, M. Dottorini, S. Caprioli, W. Bianchi, F. Suter: The effect of ciprofloxacin on oral contraceptive steroid treatments, Drugs under Experimental and Clinical Research 17 (1991) 451-454.
- P. C. Scholten PC, Droppert RM, Zwinkels MGJ, Moesker HL, Nauta JJP, Hoepelman IM: No Interaction between Ciprofloxacin and an Oral Contraceptive. In: Antimicrobial Agents and Chemotherapy 42(12), 1998: 3266-3268.
- P. Burke, S. R. Burne: Allergy associated with ciprofloxacin. In: BMJ. Band 320, Nummer 7236, März 2000, S. 679, PMID 10710576. PMC 27310 (freier Volltext).
- John G Cooper, Knut Harboe, Sofia K Frost, Øyvind Skadberg: Ciprofloxacin interacts with thyroid replacement therapy. In: BMJ : British Medical Journal. Band 330, Nr. 7498, April 2005, PMID 15860826.
- S W Mamber, B Kolek, K W Brookshire, D P Bonner, J Fung-Tomc: Activity of quinolones in the Ames Salmonella TA102 mutagenicity test and other bacterial genotoxicity assays. In: Antimicrobial Agents and Chemotherapy. Band 37, Nr. 2, Februar 1993, S. 213–217, PMID 8452351, PMC 187641 (freier Volltext).
- DNA-damage caused by antibiotic drugs - quinolones. Abgerufen am 20. Januar 2019 (englisch).
- L'. Majtánová, V. Majtán: Quinolone effects in the SOS chromotest and in the synthesis of biomacromolecules. In: Folia Microbiologica. Band 41, Nr. 3, 1. Juni 1996, S. 233–236, doi:10.1007/BF02814622.
- N Gorla, H Garcı́a Ovando, I Larripa: Chromosomal aberrations in human lymphocytes exposed in vitro to enrofloxacin and ciprofloxacin. In: Toxicology Letters. Band 104, Nr. 1, 11. Januar 1999, S. 43–48, doi:10.1016/S0378-4274(98)00230-6.
- (PDF) Ciprofloxacin inhibits proliferation and promotes generation of aneuploidy in Jurkat cells. Abgerufen am 20. Januar 2019 (englisch).
- J. Kuhlmann, A. Dalhoff, H.-J. Zeiler (Hrsg.): Quinolone Antibacterials. 1. Auflage. Springer, Berlin / Heidelberg 1998, ISBN 978-3-642-80364-2, S. 7.
- A. Mukherjee, S. Sen, K. Agarwal: Ciprofloxacin: mammalian DNA topoisomerase type II poison in vivo. In: Mutation Research. Band 301, Nr. 2, Februar 1993, S. 87–92, PMID 7678175.
- (PDF) Scholars Research Library Induction of micronucleus and abnormal sperm cells in albino mice exposed to ciprofloxacin. Abgerufen am 20. Januar 2019 (englisch).
- Jerzy Duszyński, Krzysztof Zabłocki, Rafał Kozieł: Calcium Signals Are Affected by Ciprofloxacin as a Consequence of Reduction of Mitochondrial DNA Content in Jurkat Cells. In: Antimicrobial Agents and Chemotherapy. Band 50, Nr. 5, 1. Mai 2006, S. 1664–1671, doi:10.1128/AAC.50.5.1664-1671.2006, PMID 16641433 (asm.org [abgerufen am 20. Januar 2019]).
- Peter Karran, Peter Macpherson, Reto Brem, Matthew Peacock: DNA repair inhibition by UVA photoactivated fluoroquinolones and vemurafenib. In: Nucleic Acids Research. Band 42, Nr. 22, 16. Dezember 2014, S. 13714–13722, doi:10.1093/nar/gku1213 (oup.com [abgerufen am 20. Januar 2019]).
- A. D. Katsambas, T. M. Lotti, C. Dessinioti, A. M. D'Erme (Hrsg.): European Handbook of Dermatological Treatments. 3. Auflage. Springer, Berlin / Heidelberg 2015, ISBN 978-3-662-45139-7, S. 242.
- (PDF) Evaluation of the teratogenic potentials of Ciprofloxacin in Albino Rat. Abgerufen am 11. Februar 2019 (englisch).
- (PDF) Reproductive performance of pregnant rats and embryotoxic effects of ciprofloxacin. Abgerufen am 11. Februar 2019 (englisch).
- Nadia H. Ismail: Assessment of histopathological and histochemical changes in liver of pregnant female rats and their fetuses following Ciprofloxacin administration. (PDF) J. Egypt. Soc. Toxicol., 17. Juli 2006, abgerufen am 11. Februar 2019.
- Zumrut Dogan, Aymelek Cetin, Ebru Elibol, Nigar Vardi, Yusuf Turkoz: Effects of ciprofloxacin and quercetin on fetal brain development: a biochemical and histopathological study. In: The Journal of Maternal-Fetal & Neonatal Medicine. 10. Januar 2018, S. 1–9, doi:10.1080/14767058.2017.1418222.
- (PDF) Adverse effects of ciprofloxacin on testis apoptosis and sperm parameters in rats. Abgerufen am 11. Februar 2019 (englisch).
- Fatemeh Zobeiri, Rajab-Ali Sadrkhanlou, Siamak Salami, Karim Mardani, Abbas Ahmadi: The effect of ciprofloxacin on sperm DNA damage, fertility potential and early embryonic development in NMRI mice. In: Veterinary Research Forum. Band 3, Nr. 2, 2012, S. 131–135, PMID 25653759, PMC 4312808 (freier Volltext).
- Fatemeh Zobeiri, Rajab-Ali Sadrkhanlou, Siamak Salami, Karim Mardani: Long-Term Effect of Ciprofloxacin on Testicular Tissue: Evidence for Biochemical and Histochemical Changes. In: International Journal of Fertility & Sterility. Band 6, Nr. 4, 2013, S. 294–303, PMID 24520454, PMC 3850316 (freier Volltext).
- Fatemeh Zobeiri, Siamak Salami, Rajabali Sadrkhanlou, Tahmineh Peirouvi: Role of Mitochondria in Ciprofloxacin-Induced Apoptosis in Murine Sperm Cells. In: Reproductive Sciences. Band 20, Nr. 9, 18. Februar 2013, S. 1090–1095, doi:10.1177/1933719113477482.
- D. Raoult, G. Verghese, P. Jasper, M. Mathai, L. Verghese: Case reports: scrub typhus during pregnancy in India. In: Transactions of The Royal Society of Tropical Medicine and Hygiene. Band 97, Nr. 5, 1. Oktober 2003, S. 570–572, doi:10.1016/S0035-9203(03)80032-9 (oup.com [abgerufen am 11. Februar 2019]).
- Chhaya Goyal, Mohammad Rafi, Ghazala Khan: Anaphylaxis to parenteral ciprofloxacin in mother leading to foetal death. (PDF) Indian Journal of Pharmacy and Pharmacology, 2016, abgerufen am 11. Februar 2019.
- Fachinformation Ciprofloxacin Aristo® 250 mg/500 mg/750 mg Filmtabletten. (PDF) Aristo Pharma GmbH, Januar 2019, abgerufen am 11. Februar 2019.
- Ciprofloxacin Kabi Annexes I - II – III. (PDF) European Medicines Agency, abgerufen am 2. November 2019.
- Rote Liste online, Stand: September 2009.
- AM-Komp. d. Schweiz, Stand: September 2009.
- AGES-PharmMed, Stand: September 2009.