Buruli-Ulkus
Das Buruli-Ulkus (Ulcus tropicum) ist eine in den Tropen verbreitete, aber nicht an das tropische Klima gebundene (kommt auch in Japan und Australien vor) infektiöse Erkrankung der Haut und Weichteile mit Bildung zum Teil ausgedehnter Geschwüre. Erreger ist das atypische Mykobakterium (MOTT) Mycobacterium ulcerans, das mit den Erregern von Tuberkulose und Lepra verwandt ist.
| Klassifikation nach ICD-10 | |
|---|---|
| A31.1 | Infektion der Haut durch sonstige Mykobakterien Infektion durch Mycobacterium ulcerans [Buruli-Ulkus] |
| ICD-10 online (WHO-Version 2019) | |
Epidemiologie
Verbreitet ist die Erkrankung in vielen Ländern West-, Zentral- und Ostafrikas, kommt aber auch in Südasien, Lateinamerika und Australien vor. Häufig ist die ländliche Bevölkerung in der Nähe von Gewässern oder Sumpfland betroffen. Beispielsweise lag die Prävalenz in mehreren ländlichen Regionen der Demokratischen Republik Kongo zwischen 0 und 27,5 pro 1000.[1]
Die Übertragungsmechanismen des Erregers sind bis heute ungeklärt. Möglich erscheint eine Übertragung durch Hautläsionen und Kontakt mit kontaminiertem Wasser, oder auch durch Schwimmwanzen oder Stiche anderer Insekten. Ein natürliches Erregerreservoir ist bisher nicht identifiziert worden.[2]
Klinik
In den meisten Fällen sind die Extremitäten betroffen, bei Kindern können die Ulzerationen überall vorkommen. Aus einer papelartigen bis knotigen Hautschwellung heraus entwickelt sich das Geschwür, das erhebliche Ausdehnung annehmen kann. Verhängnisvoll ist, dass die Läsion schmerzlos ist und daher oft erst sehr spät einem Arzt vorgestellt wird. Nach Monaten bis Jahren heilt sie gelegentlich von selbst aus, allerdings kann es auch zu schweren Verstümmelungen, narbigen Kontrakturen oder Lymphödemen kommen.
Diagnose
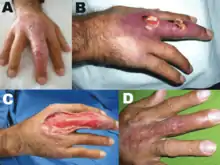
In Endemiegebieten wird die Diagnose in der Regel klinisch unterstützend durch die Mikroskopie aus Wundabstrichen oder Feinnadelaspiraten auf säurefeste Stäbchenbakterien nach Ziehl-Neelsen als first-line Test im Feld gestellt. Die histopathologische Untersuchung exzidierten Gewebes oder von 3 mm Stanzbiopsien stellt eine hochsensitive und spezifische Methode dar. Sie ist in Endemiegebieten selten verfügbar. Die labordiagnostische Nachweismethoden mit der höchsten Sensitivität und Spezifität stellt die PCR der repetitiven Insertionssequenz IS2404 des M. ulcerans Genoms dar. Sie ist als konventionelle PCR oder real-time PCR nur in nationalen Referenzlaboren verfügbar. Die kulturelle Anzüchtung des Bakteriums ist geprägt von einer niedrigen Sensitivität (40–70 %) und einer langen Inkubationszeit von mindestens 6 Wochen. Daher ist diese Methode für die zeitnahe Diagnostik und Einleitung der Therapie ungeeignet, stellt jedoch derzeit die einzige Möglichkeit zum Viabilitätsnachweis der Erreger dar, welcher bei Therapieversagern und Rezidiven für weitere Therapieentscheidungen notwendig ist.[3]
Behandlung
Herausschneiden
Die Therapie erfolgte bis 2004 weitgehend durch chirurgische Exzision. Dabei traten Rezidivraten bis zu 30 % auf, da die Mykobakterien weit ins makroskopisch gesund erscheinende Gewebe vordringen. Ein Herausschneiden ist vorwiegend bei prä-ulcerativen Formen der Erkrankung ratsam.[4]
Antibiotika
Seit 2004 empfiehlt die WHO eine standardisierte antimykobakterielle Therapie mit Rifampicin p.o. und Streptomycin i. m. über 8 Wochen, die bei rund 20 % der Behandelten mit einem mehr oder minder ausgeprägten partiellen Hörverlust einher geht. Die Rezidivrate liegt dabei unter 2 %. Antibiotikaresistenzen wurden bei Monotherapie mit Rifampicin aus Ghana berichtet. Sie stellen noch keinen limitierenden Faktor für eine Therapie dar.[5] Klinische Studien zur Anwendung eines rein oralen Therapieregimes mit Rifampicin und Clarithromycin zeigten erfolgversprechende Ergebnisse vorwiegend im Frühstadium.[6][7]
Als hochwirksam – auch gegenüber Rifampicin – bestätigte sich ein Imidazopyridinamid in vitro als auch in vivo in einer Phase-I-Studie. Da das Bakterium M. ulcerans an ein Leben in stabiler Umgebung angepasst ist, sind vieler seiner Gene inaktiviert, da viele Zellfunktionen nur von freilebenden Organismen benötigt werden. Die Atmung der robusteren TB-Bakterien beruht auf zwei Stoffwechselwegen. Das Imidazopyridinamid blockiert einen davon. M. ulcerans verlor den gegen das Imidazopyridinamid resistenten Signalweg und überlebt daher die Behandlung nicht lange.[8]
Wärme-Behandlung
Konsequentes Erwärmen der Geschwüre auf 40 °C inaktiviert die Bakterien. In einer Studie trugen sechs Patienten einige Wochen Verbände mit warmen Paketen. Jedes Geschwür heilte, Rückfälle lagen auch 18 Monate danach nicht vor. Die Methode wird nun an mehr Patienten erprobt.[9]
Literatur
- N. Schöffel, M. Braun, M. H. K. Bendels, D. A. Groneberg: Buruli-Ulkus. In: Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie. Band 69, Nummer 2, 2019, doi:10.1007/s40664-018-0271-z.
Weblinks
- World Health Organisation (WHO): Buruli ulcer (Mycobacterium ulcerans infection) (englisch)
- Altmeyers Enzyklopädie: Buruli-Geschwür
- Deutsche Lepra- und Tuberkulosehilfe: Buruli Ulcer
Einzelnachweise
- Delphin Mavinga Phanzu, Patrick Suykerbuyk u. a.: Burden of Mycobacterium ulcerans Disease (Buruli Ulcer) and the Underreporting Ratio in the Territory of Songololo, Democratic Republic of Congo. In: PLoS Neglected Tropical Diseases. 7, 2013, S. e2563, doi:10.1371/journal.pntd.0002563.
- Christian G. Meyer: Tropenmedizin: Infektionskrankheiten. ecomed-Storck GmbH, 2007, ISBN 978-3-609-16334-5 (google.de [abgerufen am 25. Februar 2022]).
- M. Beissner, K. H. Herbinger, G. Bretzel: Laboratory diagnosis of Buruli ulcer disease. In: Future microbiology. Band 5, Nummer 3, März 2010, S. 363–370, ISSN 1746-0921. doi:10.2217/fmb.10.3. PMID 20210548. (Review).
- K. H. Herbinger, D. Brieske, J. Nitschke, V. Siegmund, W. Thompson, E. Klutse, N. Y. Awua-Boateng, E. Bruhl, L. Kunaa, M. Schunk, O. Adjei, T. Löscher, G. Bretzel: Excision of pre-ulcerative forms of Buruli ulcer disease: a curative treatment? In: Infection. Band 37, Nummer 1, Februar 2009, S. 20–25, ISSN 1439-0973. doi:10.1007/s15010-008-8073-4. PMID 19139811.
- M. Beissner, N. Y. Awua-Boateng, W. Thompson, W. A. Nienhuis, E. Klutse, P. Agbenorku, J. Nitschke, K. H. Herbinger, V. Siegmund, E. Fleischmann, O. Adjei, B. Fleischer, T. S. van der Werf, T. Loscher, G. Bretzel: A genotypic approach for detection, identification, and characterization of drug resistance in Mycobacterium ulcerans in clinical samples and isolates from Ghana. In: The American journal of tropical medicine and hygiene. Band 83, Nummer 5, November 2010, S. 1059–1065, ISSN 1476-1645. doi:10.4269/ajtmh.2010.10-0263. PMID 21036838. PMC 2963970 (freier Volltext).
- W. A. Nienhuis, Y. Stienstra, W. A. Thompson, P. C. Awuah, K. M. Abass, W. Tuah, N. Y. Awua-Boateng, E. O. Ampadu, V. Siegmund, J. P. Schouten, O. Adjei, G. Bretzel, T. S. van der Werf: Antimicrobial treatment for early, limited Mycobacterium ulcerans infection: a randomised controlled trial. In: The Lancet, Band 375, Nummer 9715, Februar 2010, S. 664–672, doi:10.1016/S0140-6736(09)61962-0. PMID 20137805.
- WHO: Buruli ulcer. Information, Education and Communication (IEC) materials. (online)
- N. Scherr et al.: Targeting the Mycobacterium ulcerans cytochrome bc1:aa3 for the treatment of Buruli ulcer. In: Nature Communications, 2018, doi:10.1038/s41467-018-07804-8
- Thomas Junghanss, Alphonse Um Boock, Moritz Vogel, Daniela Schuette, Helmut Weinlaeder, Gerd Pluschke, David J. Diemert: Phase Change Material for Thermotherapy of Buruli Ulcer: A Prospective Observational Single Centre Proof-of-Principle Trial. In: PLoS Neglected Tropical Diseases. 3, 2009, S. e380, doi:10.1371/journal.pntd.0000380.
- Lynda B. Williams, Shelley E. Haydel, Rossman F. Giese, Jr., Dennis D. Eberl: Chemical and Mineralogical Characteristics of French Green Clays Used for Healing. In: Clays and Clay Minerals. 56, 2008, S. 437–452, doi:10.1346/CCMN.2008.0560405.