Moxifloxacin
Moxifloxacin ist ein Antibiotikum, das der vierten Generation der Fluorchinolone zugerechnet wird, und unterliegt der ärztlichen Verschreibungspflicht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
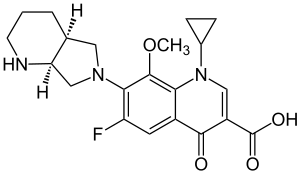 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Moxifloxacin | |||||||||||||||||||||
| Andere Namen |
1-Cyclopropyl-6-fluor-8-methoxy-7-[(4aS,7aS)-octahydro-6H-pyrrolo[3,4-b]pyridin-6-yl]-4-oxo-1,4-dihydrochinolin-3-carbonsäure | |||||||||||||||||||||
| Summenformel | C21H24FN3O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 401,43 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkungsweise
Der Wirkmechanismus von Moxifloxacin ist mit dem anderer Fluorchinolone identisch, es bindet jedoch an zwei Topoisomerasen und hat so zwei Angriffspunkte. Chinolone allgemein binden an die Gyrase, wodurch diese gehemmt wird. Durch die Bindung der Fluorchinolone an die Gyrase entstehen stabile Komplexe, die eine Vielzahl von enzymatischen Reaktionen auslösen, die letzten Endes zum Tod der Bakterienzelle führen. Der exakte bakterizide Wirkmechanismus der Fluorchinolone ist bislang ungeklärt.[4][5]
Anwendung
Moxifloxacin wird therapeutisch verwendet bei einer Verschlimmerung einer bereits länger bestehenden (chronischen) Bronchitis, bei Lungenentzündungen und bei akuten Entzündungen der Nasennebenhöhlen. Allerdings soll Moxifloxacin bei diesen Indikationen nicht mehr als Mittel der ersten Wahl eingesetzt werden. Zur Begründung heißt es, die genannten Atemwegsinfektionen wären überwiegend selbstlimitierend und Moxifloxacin sei mit einem erhöhten Risiko für schwerwiegende Nebenwirkungen verbunden.[6]
Aufgrund der guten Gewebegängigkeit des Wirkstoffs[7] ist Moxifloxacin auch bei komplizierten Haut- und Weichgewebsinfektionen (etwa beim diabetischen Fuß) zugelassen.
Auch bei Chlamydieninfektionen und anderen atypischen Keimen, wie Mykoplasmen und Legionellen ist es gut wirksam. Die Wirksamkeit gegenüber Haemophilus influenzae und Moraxella catarrhalis ist wie bei allen Chinolonen sehr gut, gegenüber Pneumokokken ausgezeichnet. Gegen Pseudomonas aeruginosa wirkt Moxifloxacin nicht („Pseudomonaslücke“).
Nebenwirkungen
Häufige Nebenwirkungen von Moxifloxacin (1–10 %) sind Störungen des Magen-Darm-Traktes, insbesondere Übelkeit, Durchfall, Erbrechen und Verdauungsstörungen, Kopfschmerzen und Benommenheit, durch resistente Bakterien oder Pilze verursachte Superinfektionen, ferner QT-Verlängerungen mit dem Risiko von gefährlichen Herzrhythmusstörungen v. a. bei bekannter Hypokaliämie sowie erhöhte Leberwerte.[8] Seltener treten psychiatrische Symptome, Blutbildveränderungen oder Allergien auf. Sehr selten (< 1/10.000), aber besonders schwerwiegend, sind fulminante Hepatitis bis hin zu lebensbedrohlichem Leberversagen und bullöse Hautreaktionen wie Stevens-Johnson-Syndrom oder möglicherweise lebensbedrohliche toxische epidermale Nekrolyse.[9] Ebenfalls wurden Fälle von Tendinitis nach der Gabe von Moxifloxacin und anderen Fluorchinolonen beschrieben.[10][11] Laut klinischen Studien aus Deutschland und den USA liegt die Nebenwirkungsinzidenz von Moxifloxacin bei 25 %.[12] Nebenwirkungen können verzögert auftreten, nach dem Absetzen persistieren, mit der Zeit an Intensität zunehmen sowie dauerhafte Behinderungen verursachen.[13] Im Vergleich zu anderen gängigen Antibiotika sind Fluorchinolone für die meisten dauerhaften Behinderungen verantwortlich.[14]
Anwendungsbeschränkung durch die Europäische Arzneimittel-Agentur
Im Jahr 2008 schränkte die Europäische Arzneimittel-Agentur EMA wegen des ungünstigen Nutzen-Risiko-Verhältnisses die Anwendung von Moxifloxacin auf Fälle ein, in denen andere Antibiotika nicht benutzt werden können.[15][16] Von der Anwendungsbeschränkung ist nur die orale Darreichungsform betroffen. Dem Beschluss der EMA ging ein Rote-Hand-Brief zu teils tödlich verlaufenden Leberschädigungen und lebensbedrohlichen Hautreaktionen voraus.[9] Die EMA empfahl neben der Einsatzbeschränkung bei akuter Exazerbation einer chronischen Bronchitis, akuter bakterieller Sinusitis und Lungenentzündungen eine Aufnahme stärkerer Warnhinweise in die Gebrauchs- und Fachinformation Moxifloxacin-haltiger Arzneimittel. Daraufhin erschien ein weiterer Rote-Hand-Brief mit entsprechenden Indikationseinschränkungen und neuen Hinweisen auf erhöhte kardiale Risiken bei Frauen und älteren Patienten, vorübergehenden Bewusstseinsverlust, Verschlimmerung der Symptome einer bestehenden Myasthenia gravis und Rhabdomyolyse.[17]
Handelsnamen
Actira (A), Avalox (D, CH), Avelox (A), Octegra (A), Vigamox (D, CH), Avelon (Südafrika) sowie Generika (D, A), Zivlox (Marokko)
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1087, ISBN 978-0-911910-00-1.
- Datenblatt Moxifloxacin hydrochloride bei Sigma-Aldrich, abgerufen am 5. Mai 2011 (PDF).
- Datenblatt MOXIFLOXACIN HYDROCHLORIDE CRS (PDF) beim EDQM, abgerufen am 14. Juni 2009.
- David C. Hooper: Mechanisms of Action of Antimicrobials: Focus on Fluoroquinolones. In: Clinical Infectious Diseases. Band 32, Supplement_1, 15. März 2001, S. S9–S15, doi:10.1086/319370.
- Karl Drlica, Muhammad Malik, Robert J. Kerns, Xilin Zhao: Quinolone-Mediated Bacterial Death. In: Antimicrobial Agents and Chemotherapy. Band 52, Nr. 2, 1. Februar 2008, S. 385–392, doi:10.1128/aac.01617-06, PMID 17724149.
- BfArM – Risikobewertungsverfahren – Moxifloxacin (Actimax®, Actira®, Avalox®): Anwendungsbeschränkungen und zusätzliche Warnhinweise beschlossen. Abgerufen am 12. März 2018.
- C. Joukhadar, H. Stass, U. Müller-Zellenberg, E. Lackner, F. Kovar: Penetration of moxifloxacin into healthy and inflamed subcutaneous adipose tissues in humans. In: Antimicrobial Agents and Chemotherapy. Band 47, Nr. 10, 2003, S. 3099–3103, PMID 14506015.
- Fachinformation Avalox, abgerufen am 4. Juli 2015.
- Moxifloxacin (Avalox® und Actimax®): Neue Risikohinweise auf schwerwiegende unerwünschte Wirkungen (Hepatotoxizität und bullöse Hautreaktionen). Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), 12. Februar 2008, abgerufen am 15. Juli 2013.
- O. Burkhardt, T. Köhnlein u. a.: Recurrent tendinitis after treatment with two different fluoroquinolones. In: Scandinavian Journal of Infectious Diseases. Band 36, Nr. 4, 2004, S. 315–316, PMID 15198194.
- A. De Sarro, G. De Sarro: Adverse reactions to fluoroquinolones. an overview on mechanistic aspects. In: Current Medicinal Chemistry. Band 8, Nr. 4, März 2001, S. 371–384, PMID 11172695.
- Peter Ball: Efficacy and safety of levofloxacin in the context of other contemporary fluoroquinolones: a review. In: Current Therapeutic Research, Clinical and Experimental. Band 64, Nr. 9, November 2003, S. 646–661, doi:10.1016/j.curtheres.2003.11.003, PMID 24944413, PMC 4053061 (freier Volltext).
- Drug Safety and Availability - FDA Drug Safety Communication: FDA updates warnings for oral and injectable fluoroquinolone antibiotics due to disabling side effects (en) In: www.fda.gov. Abgerufen am 10. Januar 2018.
- FDA: FDA/CDER Drug Information Webinar - Fluoroquinolone Safety Labeling Changes. In: www.fda.gov. FDA, April 2017, abgerufen am 22. Januar 2019.
- Moxifloxacin. Abgerufen am 4. Juli 2015.
- EMEA schränkt Anwendung von Moxifloxacin und Norfloxacin deutlich ein. (Nicht mehr online verfügbar.) In: aerzteblatt.de. 25. Juli 2008, archiviert vom Original am 13. Juli 2015; abgerufen am 4. Juli 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- BfArM – Rote-Hand-Briefe und Informationsbriefe – Rote-Hand-Brief zu Avalox®, Octegra®, Actimax®, Actira®: Einschränkung der Indikationen. Abgerufen am 14. März 2018.