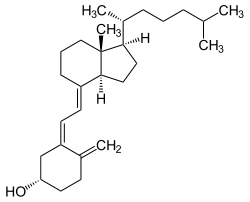
Vitamin D
Vitamin D ist eine Gruppe fettlöslicher Vitamine, die zu den Secosteroiden gehören und in der Physiologie vor allem für ihre Rolle beim Calciumstoffwechsel bekannt sind. Im Körper von Lebewesen kann der physiologisch wichtigste Vertreter Cholecalciferol (= Vitamin D3) auch mit Hilfe von UV-B-Strahlung (Dorno-Strahlung) in der Haut aus 7-Dehydrocholesterol gebildet werden. Daher ist die Bezeichnung als Vitamin nach der historischen Definition von Vitaminen nicht völlig zutreffend, denn diese Definition schließt aus, dass solche Stoffe in ausreichender Menge vom Körper selbst synthetisiert werden können.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Trivialname | Vitamin D3 | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C27H44O | |||||||||
| CAS-Nummer | 67-97-0 | |||||||||
| PubChem | 5280795 | |||||||||
| ATC-Code |
A11CC05 | |||||||||
| DrugBank | DB00169 | |||||||||
| Kurzbeschreibung | farbloser Feststoff | |||||||||
| Vorkommen | nicht-pflanzliche Eukaryoten | |||||||||
| Physiologie | ||||||||||
| Funktion | Vorstufe des Calcitriol, als solches: Regulierung des Calcium-Haushalts, Reifung von Immunzellen | |||||||||
| Täglicher Bedarf | etwa 20 µg (800 IE) täglich (Summe aus Hautproduktion und Nahrungsaufnahme) | |||||||||
| Folgen bei Mangel | Rachitis, Osteomalazie | |||||||||
| Überdosis | siehe Hypervitaminose D | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 384,64 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
Zersetzung | |||||||||
| Löslichkeit | fettlöslich, im Blut zu 50–80 % proteingebunden (an VDBP) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
In der Nahrung kommt es vor allem in Fettfischen vor oder wird den Lebensmitteln als Nahrungsergänzungsmittel zugefügt. Es hat im Körper die Funktion eines Prohormons und wird über eine Zwischenstufe zum aktiven Steroidhormon Calcitriol umgewandelt.
Vitamin D spielt eine wesentliche Rolle bei der Regulierung des Calcium-Spiegels im Blut und beim Knochenaufbau. Ein Vitamin-D-Mangel führt mittelfristig bei Kindern zu Rachitis und bei Erwachsenen zu Osteomalazie. Mögliche weitere gesundheitliche Folgen eines Vitamin-D-Mangels (wie Osteoporose) sind Gegenstand aktueller wissenschaftlicher Forschung.
Für eine ausreichende Versorgung mit Vitamin D ist eine angemessene Sonnen- oder UV-B-Bestrahlung oder andernfalls eine zusätzliche Einnahme (Supplementierung) notwendig. In manchen Staaten werden zu diesem Zweck bestimmte Nahrungsmittel mit Vitamin D angereichert.
Geschichte
Die Entdeckung von Vitamin D ist mit der Suche nach einem Heilmittel für Rachitis verknüpft.[3] Im Jahre 1919 konnte gezeigt werden, dass die Heilung von Rachitis durch Bestrahlung mit künstlich erzeugtem UV-Licht möglich ist,[4] zwei Jahre später wurde dies ebenfalls durch die Bestrahlung mit normalem Sonnenlicht nachgewiesen.[5] Unabhängig von diesen Erkenntnissen war etwa zeitgleich der britische Mediziner Edward Mellanby (1884–1955) davon überzeugt, dass Rachitis durch ein Ernährungsdefizit ausgelöst werde, und konnte ebenfalls 1919 an Experimenten mit Hunden zeigen, dass Rachitis durch Butter, Milch und insbesondere Lebertran geheilt werden konnte. Er hielt daraufhin das erst kurz zuvor in Lebertran entdeckte Vitamin A für den auslösenden Faktor. Es war bekannt, dass Vitamin A durch Oxidation zerstört wird. Lebertran verliert deshalb nach oxidativer Behandlung die Fähigkeit, Nachtblindheit zu heilen. So behandelter Lebertran war jedoch weiterhin in der Lage, Rachitis zu kurieren. Der Chemiker Elmer Verner McCollum (in Zusammenarbeit mit dem Kinderarzt John Howland) schloss daraus, dass ein weiterer Stoff, unabhängig vom bekannten Vitamin A, diese Wirkung verursache.[6] Als das vierte gefundene Vitamin (nach den Vitaminen A, B und C) wurde es daraufhin „Vitamin D“ genannt.
Mellanbys Frau, eine Zahnärztin, nutzte Vitamin D zuerst in der Zahnmedizin. In Bonn wurde die Rachitisprophylaxe erstmals an Schulen zur Kariesprophylaxe genutzt.[7]
Es gibt eine Initiative, den 2. November zum Vitamin-D-Tag zu erklären und damit darauf hinzuweisen, wie groß das Vitamin-D-Mangel-Problem weltweit ist.[8]
Physiologie
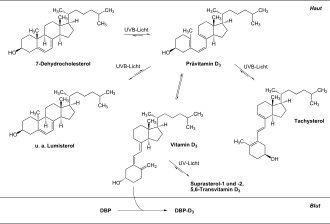
Biosynthese von Vitamin D3
Die meisten Wirbeltiere einschließlich des Menschen decken einen Großteil ihres Vitamin-D-Bedarfs durch Sonnenbestrahlung ihrer Haut; dies kommt auch bei bestimmten Planktonarten vor (Phytoplankton coccolithophor Emiliania huxleyi).[9]
Definitionsgemäß sind Vitamine Substanzen, die der Körper selbst nicht herstellen kann, aber zum Leben benötigt werden und daher zugeführt werden müssen. Die Vorstufen des sogenannten Vitamin D werden aber vom Körper selbst hergestellt. Zum im Körper vorhandenen Provitamin 7-Dehydrocholesterol (der Ausgangssubstanz der Vitamin-D-Synthese) muss dann allerdings noch Sonnenlicht hinzukommen. Vitamin D3 wird also aus historischen Gründen als Vitamin bezeichnet. Aufgrund seiner endogenen Synthese und der Tatsache, dass seine Wirkung neben dem Syntheseort auch andere Gewebe betrifft, müsste Vitamin D3 als Prohormon bezeichnet werden.
Ultraviolett-induzierte Synthese
In der Haut sind die höchsten Konzentrationen des 7-Dehydrocholesterols im Stratum spinosum und Stratum basale vorhanden. Beim Menschen und den meisten Säugetieren ist 7-Dehydrocholesterol für die Vitamin-D-Bildung reichlich vorhanden (eine Ausnahme sind z. B. Hauskatzen).
- Wird 7-Dehydrocholesterol mit UV-Strahlung mit Wellenlängen im Bereich 280–315 nm (UV-B-Strahlung) und mindestens 18 mJ/cm²[11] bestrahlt, kann im 7-Dehydrocholesterol durch eine fotochemisch induzierte 6-Elektronen-konrotatorische elektrocyclische Reaktion der B-Ring aufgebrochen werden: Es entsteht Prävitamin D3.[12]
- Das Prävitamin D3 ist thermodynamisch instabil und erfährt einen (1-7)sigmatropen Shift eines Protons von C-19 nach C-9 mit nachfolgender Isomerisation: Es entsteht Vitamin D3. Das Vitamin D3 gelangt in das Blut und wird dort vor allem an das Vitamin-D-bindende Protein (DBP) gebunden zur Leber transportiert, wo es weiter zu 25(OH)Vitamin D3 hydroxyliert wird. Im Reagenzglas sind nach drei Tagen 80 % des Prävitamin D3 zu Vitamin D3 isomerisiert, in der Haut ist dies nach acht Stunden geschehen.[9]
Selbstregulation der ultraviolett-induzierten Synthese
Wird eine bestimmte Menge 7-Dehydrocholesterol im Reagenzglasversuch simulierter äquatorialer Sonnenstrahlung ausgesetzt, ist nach einigen Minuten ca. 20 % der Ausgangsmenge zu Prävitamin D3 umgewandelt. Diese Menge an Prävitamin D3 bleibt bei weiterer Bestrahlung im Gleichgewicht, denn auch Prävitamin D3 ist photolabil und wird durch weitergehende UV-B-Bestrahlung während der nächsten acht Stunden zum physiologisch inaktiven Lumisterol und zu Tachysterol abgebaut, bevor es zu Vitamin D3 isomerisiert. In dieser Zeit sinkt das 7-Dehydrocholesterol auf ca. 30 % der Ausgangsmenge ab. Unter unnatürlicher Schmalspektrum-UV-B-Bestrahlung mit einer Wellenlänge von 290 bis 300 nm wird dagegen 65 % des ursprünglichen 7-Dehydrocholesterols in Prävitamin D3 umgewandelt.[9]
Auch das aus Prävitamin D3 entstandene Vitamin D3 ist photolabil: Kann das Vitamin D3 nicht schnell genug im Blut abtransportiert werden, entstehen aus ihm durch UV-B- und UV-A-Strahlung (bis zu 345 nm) mindestens drei weitere unwirksame Produkte: Suprasterol-1 und -2 und 5,6-Transvitamin D3.
So wird bei einer kurzen Sonnenbestrahlung (mit genügend hohem UV-B-Anteil) über einige Minuten ähnlich viel Vitamin D3 gebildet wie bei einer vergleichbaren Bestrahlung über längere Zeit. Hierdurch ist der Körper kurzfristig vor einer Vitamin-D-Intoxikation durch zu viel Strahlung geschützt.
Langfristig ergibt sich ein Schutz vor einer Vitamin-D-Intoxikation durch eine vermehrte Bildung von Melanin (Bräunung, dunkler Hauttyp in südlichen Ländern) in der Haut, welches Ultraviolett-Licht der Wellenlängen 290–320 nm absorbiert.
Der 7-Dehydrocholesterolgehalt der Haut sinkt mit dem Alter. Ferner nimmt beim Menschen im Alter die Fähigkeit der Haut, Vitamin D3 zu bilden, ungefähr um den Faktor 3 ab im Vergleich zu einem 20-jährigen Menschen.[9]
Für die blasse Haut eines hellhäutigen, jungen, erwachsenen Menschen ist die minimale Erythemdosis (MED) (wenn die Haut anfängt, rot zu werden) an einem sonnigen Sommermittag auf 42° Breite in Meereshöhe (entsprechend Boston, Barcelona oder Rom) nach 10 bis 12 Minuten erreicht, ein dunkelhäutiger Mensch benötigt entsprechend 120 Minuten. Wird die Haut dieser Menschen entsprechend ganzkörperbestrahlt, gibt sie innerhalb der nächsten 24 Stunden eine Menge vergleichbar mit 10.000 bis 20.000 IE (250 µg bis 500 µg) Vitamin D3 aus Nahrungsmitteln an das Blut ab, ein Vielfaches des Tagesbedarfs.[13] Eine starke Vitamin-D3-Bildung in der Haut ist also schon bei einer kurzen, aber intensiven Sonnenbestrahlung mit hohem UV-B-Anteil möglich.
Da die Knochendichte bei dunkelhäutigen Menschen trotz der etwas verminderten Vitamin-D-Bildung aufgrund der geringeren Durchlässigkeit der Haut für UV-Strahlen nicht vermindert ist, wird davon ausgegangen, dass Dunkelhäutige eine geringere Konzentration des Vitamin-D-bindenden Proteins aufweisen.[14]
Vitamin D3
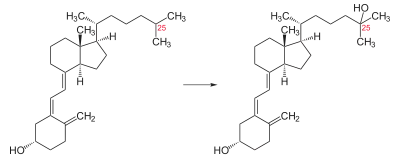
Vitamin D3 wird, vor allem gebunden an das Vitamin-D-bindende Protein, über das Blut in die Leber transportiert. Dort wird es von dem Enzym Cytochrom P450 2R1 in den Mikrosomen zu Calcidiol (25(OH)Vitamin D3) hydroxyliert. Eine frühere Vermutung, dass diese Reaktion auch in den Mitochondrien stattfindet, wurde inzwischen widerlegt.[15][16]
Calcidiol (25(OH)Vitamin-D3) wird in der Leber wieder an Vitamin-D-bindendes Protein gebunden und in das Blut abgegeben. Dort hat es eine Halbwertszeit von ca. 19 Tagen.
25(OH)Vitamin D3
25(OH)Vitamin D3 (Calcidiol) ist eine Speicherform des Vitamin D3. Eine solche muss es geben, um die großen Spitzen und Pausen der hauptsächlichen Vitamin-D-Versorgung durch das Licht abfangen zu können. Die mittel- bis längerfristige Vitamin-D-Versorgung eines Organismus lässt sich am besten über den Blutspiegel des 25(OH)Vitamin D3 bestimmen (Näheres siehe unten). Calcidiol lagert sich außerdem im Haar ab.[17]
Das so gebildete 25(OH)D3 gelangt nun, hauptsächlich wieder an das Vitamin-D-bindende Protein gebunden, zu seinen Zielgeweben, zum Beispiel zu den Nieren, wo es dann zum Calcitriol (1α,25(OH)2Vitamin D3) aktiviert wird (siehe unten). Dieses erst ist der hauptsächlich aktivierende Ligand für den Vitamin-D-Rezeptor. Dieser letzte Aktivierungsschritt ist auf vielen Ebenen redundant und von Gewebe zu Gewebe unterschiedlich reguliert, um immer an den momentanen Bedarf des Körpers und des Zielgewebes an die Vitamin-D-Wirkung angepasst zu sein.
25(OH)Vitamin D3 kann wahrscheinlich selbst auch, jedoch ca. hundertmal weniger als Calcitriol, den Vitamin-D-Rezeptor aktivieren. Dies kommt bei einer Vergiftung mit Vitamin D3 zum Tragen, wenn die letzte Regelung der Aktivierung des Vitamin D3 durch überhöhte 25(OH)Vitamin-D3-Spiegel übergangen wird.[18]
Aktivierung von 25(OH)Vitamin D3 zu Calcitriol
Die Vitamin-D-Metabolite werden als Komplex zusammen mit dem Vitamin-D-bindenden Protein (VDBP) im Blutplasma transportiert. In den Nierenkörperchen (Glomeruli) bindet dieser Komplex an Cubilin-Moleküle in der Zellmembran von proximalen Tubuluszellen und wird anschließend mithilfe des Megalins in die Zelle verfrachtet und dort freigesetzt. In den Lysosomen wird der Komplex durch Peptidasen wieder getrennt, wodurch 25(OH)Vitamin D3 frei im Zytosol diffundiert.[19]
In den Nieren kann das 25(OH)Vitamin D3 durch 1α-Hydroxylase an der mitochondrialen Plasmamembran der Zellen proximaler Tubuli zum biologisch aktiven 1,25(OH)2Vitamin D3 (Calcitriol) weiter hydroxyliert oder durch die gegensätzlich regulierte 24-Hydroxylase zum 24R,25(OH)2Vitamin D3 inaktiviert werden oder die Nierenzelle unverändert wieder in das Blut verlassen (um dort erneut an VDBP gebunden zu werden).
Die Bildung des 1,25(OH)2Vitamin D3 in der Niere ist fein reguliert: die wichtigsten Faktoren, die seine enzymatische Bildung über eine Aktivierung der 1α-Hydroxylase direkt fördern, sind unabhängig voneinander ein erhöhtes Parathormon, ein verringerter Calciumspiegel und ein niedriger Phosphatspiegel im Blut. 1,25(OH)2D3 selber hemmt die 1α-Hydroxylase und aktiviert die 24-Hydroxylase. Indirekt, zumeist über das Parathormon, beeinflussen unter anderem Calcium, Östrogen, Glucocorticoide, Calcitonin, Somatotropin und Prolactin die Calcitriolbildung. Glucocorticoide bewirken einen Mangel an Calcitriol. (Deshalb ist es während einer systemischen Corticoidtherapie, wenn Vitamin D genommen werden muss, notwendig, Vitamin D in aktiver Form als Alfacalcidol (derzeitige (2008) Medikamente in Deutschland: „EinsAlpha“, „Bondiol“, „Doss“), zu verwenden.) All diese Regulationen dienen dazu, gerade soviel aktives Vitamin D zu synthetisieren, dass der Körper in seiner momentanen Situation seinen Calcium- und Phosphatbedarf decken kann. Die Regulation der 24R,25(OH)2D3-Bildung erfolgt durch die gleichen Faktoren, jedoch in umgekehrter Richtung.[18]
In anderen Geweben wird die Aktivierung des 25(OH)Vitamin D3 zu 1α,25(OH)2Vitamin D3 durch andere Faktoren geregelt: Zytokine, Wachstumsfaktoren usw.[18]
1,25(OH)2D3 liegt in sehr viel geringerer Konzentration als 25(OH)D3 und auch hauptsächlich an VDBP gebunden im Blut vor. Die Konzentration insbesondere von freiem 1,25(OH)2D3 (Calcitriol) ist streng geregelt und weitgehend mit seiner Aktivität korreliert. Sie ist ferner weitgehend unabhängig von der Konzentration seines Vorläufers 25-Hydroxy-Cholecalciferol (Calcidiol) oder des VDBP.[18]
Funktion von Calcitriol
In den Zellen der Zielorgane wirkt 1,25(OH)2D3 (Calcitriol) wie ein Steroidhormon: Es wird an ein intrazelluläres Rezeptorprotein, den Vitamin-D-Rezeptor (VDR), gebunden und in den Zellkern transportiert. Dort assoziiert der Vitamin-Rezeptor-Komplex an die DNA und verändert die Transkription verschiedener hormonsensibler Gene, was schließlich zu Änderungen in der Proteinsynthese mit entsprechenden biologischen Wirkungen führt.
Abbau von Vitamin D3
1,25(OH)2D3 (Calcitriol) wird durch 24-Hydroxylase zur wasserlöslichen Calcitroinsäure abgebaut, die über die Galle ausgeschieden wird.[20] Die 24-Hydroxylase wird durch das Gen CYP24A1[21] codiert.
Vitamin-D-Stoffwechsel bei Erkrankungen
Patienten mit Tuberkulose, Sarkoidose und anderen granulomatösen Erkrankungen und gelegentlich auch Krebserkrankungen aktivieren das 25(OH)Vitamin D3 z. B. in den Makrophagen stärker zu 1,25(OH)2Vitamin D3 und können so funktionell in eine Vitamin-D-Hypervitaminose mit Hypercalcämie kommen.[22] Dem liegt ein ursprünglich zumeist sinnvoller Mechanismus der Immunologie zugrunde (näheres siehe unter Calcitriol).
Patienten mit Williams-Beuren-Syndrom haben zu 15 % eine Hypercalcämie. Es gab viele Vermutungen zu einem Zusammenhang mit dem Vitamin-D-Stoffwechsel, die Ergebnisse entsprechender Beobachtungen waren jedoch widersprüchlich.[23]
Bei Patienten mit Smith-Lemli-Opitz-Syndrom ist der Abbau des Vitamin-D-Vorläufers 7-Dehydrocholesterol zu Cholesterin durch Mutationen in der 7-Dehydrocholesterol-Reduktase gestört. In ihrem Stoffwechsel staut sich daher das 7-Dehydrocholesterol. Ihre Haut ist manchmal photosensibel und ihr Vitamin-D-Status ist erhöht im Vergleich zur Normalbevölkerung, ohne jedoch toxisch zu sein.[24]
Die „idiopathische infantile Hyperkalzämie“ wird verursacht durch eine Mutation im Gen CYP24A1, wodurch der Abbau von Vitamin D gehemmt wird. Betroffene Kinder haben eine erhöhte Empfindlichkeit gegenüber Vitamin D und im Fall einer zusätzlichen Einnahme ein erhöhtes Risiko einer Hyperkalzämie, die gekennzeichnet ist durch Wachstumsverzögerung, Erbrechen, Dehydratation, Fieberschübe und Nephrokalzinose.[25][26] Nachfolgende Forschungen zeigten, dass die Störung auch im Erwachsenenalter fortbesteht.[27]
Bildung in der menschlichen Haut durch Sonnenlicht
Die Vitamin-D3-Bildung durch Sonnenexposition wird durch den UV-B-Anteil im Sonnenlicht verursacht. Diverse Faktoren beeinflussen die Lichtintensität und die resultierende Vitamin-D3-Bildung in der Haut, wie z. B. der Sonnenstand, die Höhe über dem Meeresspiegel, die Beschaffenheit der Erdoberfläche, die Bewölkung, Smog oder das Ozon. Fensterglas absorbiert nahezu alle UV-B-Anteile im Sonnenlicht und Sonnencreme behindert die Vitamin-D3-Produktion.[28] Ein Solarienbesuch ist in der Regel nicht förderlich, da die Haut hier meist mit UV-A- und nicht mit UV-B-Licht bestrahlt wird.
Unter optimalen Bedingungen ist eine Viertelstunde Sonnenexposition von Gesicht, Händen und Unterarmen ausreichend für die Produktion von mehreren Tausend IE (40 IE entsprechen 1 μg) Vitamin D. Effizienter ist aber eine Ganzkörperbestrahlung.[29] Die genaue Länge der erforderlichen Exposition ist abhängig vom Hauttyp. Empfohlen wird eine kurze und intensive Exposition von einem Drittel bis zur Hälfte der minimalen Erythemdosis, also der Menge Sonnenlicht, ab der die Haut rot wird. Längeres Sonnen ist zwecklos, da ähnlich viel Vitamin D3 gebildet wird wie bei einer vergleichbaren Bestrahlung über kurze Zeit, führt aber zu höherem Hautkrebsrisiko.[30]
Einfluss des Sonnenstandes
Neben anderen Faktoren ist die Höhe des Sonnenstands entscheidend für die Vitamin-D3-Bildung.[9] In den gemäßigten Breiten steigt die Vitamin-D-Bildung in der Haut mit der Höhe des Sonnenstands stark an (Siehe AM-Spektrum) und ist daher maßgeblich von der Jahres- und Tageszeit abhängig. Bei niedrigem Sonnenstand mit vorwiegendem UV-A-Anteil des Sonnenlichts ist der Grenzbereich zwischen einer für effektive Vitamin-D-Bildung in der Haut ausreichenden Lichtdosis und einem Sonnenbrand schmal oder gar nicht vorhanden.
Grundvoraussetzung für einen ausreichenden UV-B-Anteil im Sonnenlicht ist, dass der Einfallswinkel der Sonnenstrahlen auf die Erde nicht zu gering ist. Demnach kann im Winter nördlich des 51. Breitengrads (Köln–Erfurt–Dresden) zeitweise selbst zur Mittagszeit kein Vitamin D3 in der Haut gebildet werden. Südlich des 37. Breitengrads (San Francisco–Algarve–südliches Sizilien–Antalya) sei dagegen eine ausreichende Vitamin-D-Biosynthese sicher über das ganze Jahr möglich.[9][31]
Einfluss der Hautbeschaffenheit
Je heller die Haut, desto besser kann UV-B-Strahlung für die Vitamin-D-Bildung genutzt werden. Menschen, die im Laufe der Ausbreitung des Menschen von Afrika in nördliche Breiten ausgewandert sind, entwickelten helle Haut.[13] Die einzige Ausnahme bilden die Inuit, die erst seit relativ kurzer Zeit die Arktis bewohnen und ihren Vitamin-D-Bedarf durch die Nahrung decken (Fettfische).
Wenn Menschen mit dunkler Haut heute in höheren Breiten leben, vergrößert sich ihr Risiko für einen Vitamin-D-Mangel zusätzlich. Besonders während der Schwangerschaft kann der Mangel entstehen. Die Supplementation von Vitamin D in der Schwangerschaft kann wegen des hohen Bedarfs unzureichend sein. Einen Mangel fanden Lisa Bodnar und Kollegen in einer Studie bei 80 Prozent der Afroamerikanerinnen und knapp der Hälfte der weißen US-amerikanischen Frauen, und dies, obwohl neun von zehn der insgesamt 400 Schwangeren eine Vitamin-Supplementation betrieben.[32]
Trotz eines im Mittel niedrigeren Vitamin-D-Spiegels bei Afroamerikanern ist deren Knochendichte durchschnittlich höher und das Risiko osteoporotischer Frakturen niedriger als bei Amerikanern mit europäischen Vorfahren. In einer amerikanischen Kohortenstudie mit über 2000 Teilnehmern, zur Hälfte aus beiden Ethnien, fand sich ein mittlerer 25-OH-Vitamin-D-Spiegel von 15,6 ng/ml bei den Afroamerikanern und von 25,8 ng/ml bei den weißen Amerikanern. Auch das Vitamin-D-bindende Protein (VDBP) war bei Afroamerikanern mit mittleren 168 µg/ml gegen 337 µg/ml deutlich niedriger, während das freie und bioverfügbare 25-OH-Vitamin D mit 2,9 ng/ml gegen 3,1 ng/ml bei beiden Ethnien fast identisch war und die Afroamerikaner eine signifikant höhere Schenkelhals-Knochendichte von mittleren 1,05 g/cm² gegen 0,94 g/cm² aufwiesen. Dabei können die drei Phänotypen des VDBP, die in beiden Ethnien sehr unterschiedlich verteilt sind, fast 80 % der Variationen des VDBP-Spiegels und 9,9 % der Variationen des Vitamin-D-Spiegels erklären, während die Ethnie für weitere 0,1 % bzw. 7,3 % der Variationen der Grund ist und die saisonalen Veränderungen weitere 10,5 % der Vitamin-D-Variationen erklären können. Somit lassen sich die angegebenen Grenzwerte nur eingeschränkt auf nichtweiße Ethnien übertragen.[33]
Aufnahme durch die Nahrung
Vitamin D3 ist kein gewöhnlicher Nahrungsbestandteil. Erst in den letzten 10 Jahren wurde zunehmend erkannt, mit welchen Zivilisationskrankheiten (außer der Rachitis und Osteomalazie) der endemische Lichtmangel der modernen Gesellschaften einhergeht (siehe unter Calcitriol). Daher wird der öffentlich zu empfehlende Tagesbedarf (RDA) an Vitamin D3 unter Wissenschaftlern und Verantwortlichen für die Gesundheitsversorgung lebhaft diskutiert.
Vitamin D in Muttermilch
Muttermilch enthält wenig Vitamin-D-wirksame Komponenten. Ihre Menge ist sehr vom Vitamin-D-Status der Mutter abhängig. Bereits hydroxyliertes 25(OH)Vitamin D3 macht den größten Anteil der antirachitischen Aktivität der Muttermilch aus. Der Vitamin-D-Gehalt in der fetthaltigeren Hintermilch (die der Säugling zuletzt trinkt) ist größer als in der Vordermilch. Wenn die in höheren Breiten lebenden Mütter 50 µg (2000 IE) Vitamin D3 täglich im Winter einnehmen, erreicht ihre Muttermilch die antirachitische Aktivität unsupplementierter Mütter im Sommer, die Antwort ist jedoch individuell sehr unterschiedlich.[34]
Vitamin D in Nahrungsmitteln
Gegenüber dem oben genannten – sich selbst begrenzenden – Maximalwert von bis zu 20.000 IE (250–500 µg) Vitamin-D-Produktion durch Sonnenexposition enthalten nur wenige Nahrungsmittel Vitamin D3 in vergleichbaren Mengen. Es findet sich vor allem in Fettfischen, Innereien, Eiern und in begrenztem Maße auch in Milchprodukten.
In Pilzen (z. B. Hefen) ist das Mycosterin Ergosterin enthalten, das sich bei ausreichender UV-Licht-Bestrahlung in biologisch aktives Ergocalciferol (Vitamin D2) umwandeln kann. In einer Studie der Universitätsklinik Freiburg konnte demonstriert werden, dass Zuchtchampignons, die mit UV-B-Strahlung behandelt wurden, signifikante Mengen an Vitamin D2 bildeten (491 μg oder 19.640 IE pro 100 g Zuchtchampignons). Die Verabreichung der so angereicherten Zuchtchampignons waren Vitamin D2-Supplementen ebenbürtig. Ähnliche Ergebnisse können auch mit Shiitake, Maitake, Shimeji oder anderen Pilzen erzielt werden. Im Falle von Shiitake konnten Werte von bis zu 267.000 IE pro 100 g Shiitakepilze bei 14 Stunden Sonnenlichtexposition erreicht werden.[35][36] Einige Pflanzen enthalten Ergosterin in Spuren.
Auch Milch kann in Abhängigkeit von den Haltungsbedingungen der Milchkühe von Natur aus reich an Vitamin D3 sein. Im Zusammenhang mit einem innovativen Lichtkonzept können Kühe ganzjährig viel Vitamin D3 bilden. Die Folge ist eine erhöhte Vitamin-D3-Konzentration im Blutplasma. Der Vitamin-D3-Gehalt im Blutplasma wiederum korreliert zeitversetzt mit der Vitamin-D3-Konzentration in der Milch. Werte von 2,0 µg pro 100 g Milch werden so erreicht.[37][38]
Der Vitamin-D3-Gehalt einiger ausgewählter Lebensmittel zeigt die meistens geringe Rolle der Nahrung für die Vitamin-D-Versorgung:
| Nahrungsmittel | µg pro 100 g | IE pro 100 g (1 µg ≙ 40 IE) | Referenz |
|---|---|---|---|
| Lebertran | 170 µg bis 3.800 µg | 6.800 IE bis 152.000 IE | [39] |
| Matjeshering, gesalzen | 27 µg | 1.080 IE | [40] |
| Aal (geräuchert) | 21 µg | 840 IE | [41] |
| Lachs | 16 µg | 640 IE | [41] |
| Sardine | 11 µg | 440 IE | [41] |
| Kalbfleisch (Freilandhaltung) | 3,8 µg | 152 IE | [42] |
| Hühnerei (Freilandhaltung) | 2,9 µg | 116 IE | [41] |
| industriell hergestellte Säuglingsmilch in Deutschland | 1–2 µg/100 kcal | 40–80 IE/100 kcal | [34] |
| Champignons | 1,9 µg | 76 IE | [41] |
| Leber (Rind Freilandhaltung) | 1,7 µg | 68 IE | [42] |
| Butter | 1,2 µg | 48 IE | [41] |
| Rahm (Sahne) | 1,1 µg | 44 IE | [42] |
| Emmentaler | 1,1 µg | 44 IE | [41] |
| Gorgonzola | 1 µg | 40 IE | [41] |
| Edamer 40 % Fett i. Tr. | 0,29 µg | 12 IE | [41] |
| Speisequark 40 % Fett i. Tr. | 0,19 µg | 8 IE | [41] |
| Vollmilch mind. 3,5 % Fett | 0,088 µg | 4 IE | [41] |
| Joghurt mind. 3,5 % Fett | 0,062 µg | 2 IE | [41] |
| Muttermilch | 0,01–0,12 µg | 0,4–4,8 IE | [34] |
Bei den Angaben muss berücksichtigt werden, dass nicht alle Lebensmittel in gleicher Menge konsumiert werden. Lebertran ist zwar eine reichhaltige Vitamin-D-Quelle, wird aber bekanntlich nur in ausgesprochen geringen Mengen verzehrt. Auf der Basis dieser Daten können neben fettreichen Fischen auch Pilze, Milchprodukte und angereicherte Speisefette einen guten Beitrag zur Vitamin-D3-Versorgung leisten.
Erweiterte Bedarfe und künstliche Zuführung
Die Deutsche Gesellschaft für Ernährung (DGE) hat Richtwerte für die Vitamin-D-Menge angegeben, die „bei fehlender endogener Synthese“,[43] also wenn kein Vitamin D durch Sonneneinstrahlung gebildet werden kann, abgedeckt werden sollte. Sie empfiehlt darin für Säuglinge im ersten Lebensjahr täglich 10 µg und für die anderen Kinder und Erwachsenen 20 µg (800 IE) Vitamin D3.[43] In Deutschland werden den meisten Säuglingen im ersten Lebensjahr und eventuell noch im zweiten Winter täglich eine Tablette mit 12,5 µg Vitamin D3 (500 IE) zur Rachitisprophylaxe gegeben.
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) hat die angemessene Aufnahmemenge für alle gesunden Personen über einem Jahr (also auch schwangere und stillende Frauen) auf 15 µg pro Tag festgelegt, für Kleinkinder im Alter von 7–11 Monaten auf 10 µg pro Tag. Die Behörde unterstreicht, dass diese Werte „auf der Annahme minimaler Sonneneinstrahlung und folglich begrenzter Mengen an vom Körper selbst gebildetem Vitamin D“ beruht.[44] Es handelt sich auch nicht um die Empfehlung, diese Menge an Vitamin D durch Nahrungsergänzungsmittel aufzunehmen, sondern um die Gesamtmenge an Vitamin D, welche dem Körper durch Nahrung, Sonnenstrahlung und gegebenenfalls Nahrungsergänzungsmittel täglich zur Verfügung stehen sollte.[44] Die EFSA geht außerdem davon aus, dass bei Kindern bis zu einem Jahr keine schädliche Wirkung durch übermäßige Zufuhr von Vitamin D zu erwarten ist, wenn sie nicht mehr als 25 µg Vitamin D pro Tag aufnehmen. Bei Kindern von 1–10 Jahren halten sie eine schädliche Wirkung bei Dosen von unter 50 µg und bei Jugendlichen bei Dosen von unter 100 µg für unwahrscheinlich.[45]
Aktuelle Leitlinien in den USA empfehlen 5 µg (200 IE) täglich für Kinder und jüngere Erwachsene, 10 µg (400 IE) für 50- bis 70-Jährige und 15 µg (600 IE) für über 70-Jährige. Allerdings gibt es auch neuere Studien, welche die übermäßige Gabe von Vitamin D in den USA und anderen Ländern kritisieren. Die Behauptung, dass große Teile der nordamerikanischen Bevölkerung und der anderer Länder einen Vitamin-D-Mangel hätten, beruhe auf einer Fehlinterpretation, welche sich negativ auf die Gesundheit der Patienten auswirken könne.[46] Das Bundesinstitut für Risikobewertung bewertet die Studienlage so, dass die langfristige und tägliche hochdosierte (50–100 µg, 2.000–4.000 IE) Einnahme von Präparaten ein erhöhtes gesundheitliches Risiko zur Folge haben könnte. Außerdem verweist es darauf, dass die tägliche Einnahme von 20 µg (800 IE) (ohne Sonnenexposition) für den Großteil der Bevölkerung ausreiche, um „den physiologischen Bedarf zur Erhaltung der Knochengesundheit“ zu decken.[47]
Die EsKiMo-Studie hat zwischen 2003 und 2006 das Ernährungsverhalten von 2500 Kindern im Alter von 6 bis 11 Jahren in ganz Deutschland untersucht. Dabei wurde für die tägliche Vitamin-D3-Aufnahme der niedrigste Wert aller untersuchten Nährstoffe in Bezug zum jeweils empfohlenen Wert gemessen. Demnach beträgt die tatsächliche Vitamin-D3-Aufnahme nur etwa 30 % der DGE-Empfehlung. Die Autoren folgern: „Die Zufuhr an Vitamin D ist … suboptimal und kann bei Kindern, die sich kaum im Freien aufhalten, schnell zu einer echten Mangelsituation mit langfristig negativen Folgen für die Knochengesundheit führen.“[48] Die im September 2008 veröffentlichte DONALD-Ernährungsstudie vom Forschungsinstitut für Kinderernährung (FKE) bestätigte die Vitamin-D3-Unterversorgung bei Kindern. Bei den 598 Studienteilnehmern im Alter von 1 bis 12 Jahren ergab die Auswertung nach Einzelprotokollen, dass acht von zehn Kindern die Empfehlung der DGE für Vitamin D nicht erreichen.[49]
Bislang wurde hierzulande neben industriell hergestellter Säuglingsmilch u. a. Margarine mit 2,5 µg Vitamin D3 pro 100 g angereichert, um eine ausreichende Versorgung der Bevölkerung sicherzustellen. Dagegen ist das fettlösliche Vitamin nicht in fertigen Multivitaminsäften erhältlich, sondern nur in (Brause-)Tabletten.
Die Unterversorgung mit Vitamin D3 ist in vielen Ländern mit mäßiger Sonneneinstrahlung, langen Wintern und nur mäßigem Fettfischkonsum ein rege diskutiertes Problem. Eine Lösung besteht darin, Vitamin-D-haltige Lebensmittel täglich aufzunehmen und in den Sommermonaten durch tägliche kurze und intensive Sonnenexposition eine Reserve aufzubauen. Darüber hinaus wird durch die Anreicherung von Lebensmitteln mit Vitamin D3 in vielen Ländern eine Erhöhung der Zufuhr aus der Nahrung angestrebt.
Die tägliche Vitamin-D-Aufnahme mit der Nahrung in verschiedenen Ländern ist ungefähr wie folgt (1 µg entspricht 40 IE Vitamin D3):
| Bevölkerungsgruppe | tägliche Vitamin-D3-Aufnahme | davon supplementiertes Vitamin D3 | Referenz |
|---|---|---|---|
| junge, weiße amerikanische Männer | 8,1 µg | 5,1 µg | [50] |
| junge, weiße amerikanische Frauen | 7,3 µg | 3,1 µg | [50] |
| schwarze amerikanische Erwachsene | 6,2 µg | 4,3 µg | [50] |
| britische Männer | 4,2 µg | 1,4 µg | [50] |
| britische Frauen | 3,7 µg | 1,1 µg | [50] |
| japanische Frauen | 7,1 µg | 0 µg | [50] |
| norwegische Männer | 6,8 µg | 2,9 µg | [50] |
| norwegische Frauen | 5,9 µg | 2,9 µg | [50] |
| spanische Männer | ca. 4 µg | [50] | |
| spanische Frauen | ca. 3 µg | [50] | |
| deutsche Männer | 2,9 µg | 0 µg | [34] |
| deutsche Frauen | 2,2 µg | 0 µg | [34] |
| italienische Haushalte | 3,0 µg | [34] |
Innerhalb dieser Bevölkerungsgruppen und zwischen den ausgewerteten Studien variieren diese Durchschnittsangaben aber erheblich.[50]
In Deutschland ist die Vitamin-D3-Supplementation bei Erwachsenen bislang nicht üblich. Die Ergebnisse der nationalen Verzehrstudie 2008 zeigen, dass nur etwa 3 % aller befragten Frauen und weniger als 2 % der befragten Männer zusätzlich 5 µg Vitamin-D3 pro Tag aufnehmen.[51]
In den USA und in Kanada wird die Trinkmilch regelmäßig mit 10 µg Vitamin D3 pro Liter supplementiert. In Großbritannien, Irland und Australien dürfen Frühstückscerealien und Margarine mit Vitamin D3 supplementiert werden. In Norwegen und Japan trägt der Fettfischkonsum zur Vitamin-D-Versorgung durch die Nahrung bei. In Norwegen ist darüber hinaus die Einnahme von Lebertran als Nahrungsergänzungsmittel noch immer sehr weit verbreitet. In den meisten anderen Ländern wird mit der Nahrung kaum Vitamin D3 aufgenommen.
Industriell hergestellte Säuglingsmilch muss in den USA mit 1 bis 2,5 µg / 100 kcal supplementiert sein. Säuglinge, die gestillt werden oder weniger als 500 ml dieser Formelnahrung trinken, sollen täglich 200 IE (5 µg) Vitamin D3 bekommen.[52]
Vitamin-D3-Mangel
Nach einer Metaanalyse von 2016 bezüglich der zusammengelegten (gepoolten) Daten von 55.844 Europäern verschiedener Länder wurde bei 13,0 % eine Mangelversorgung festgestellt, gemäß der definierten Grenze von 25(OH)D < 30 nmol/l (< 12 ng/ml) im Jahresdurchschnitt. Wurden die Proben von April bis November genommen, was in der Studie als ausgedehnter Sommer bezeichnet wurde, war dies bei 8,3 % der Fall, bei Probenentnahmen von Oktober bis März, dem „ausgedehnten“ Winter, wiesen 17,7 % einen Mangel auf.[53]
In Deutschland stellt sich die Situation so dar, dass laut DEGS1-Erhebung, auf die das Robert Koch-Institut bei dem Thema verweist, sich in den Monaten November bis April mindestens 25 % der Serumkonzentrationen der gesamten deutschen Bevölkerung innerhalb des von allen Seiten als schweren Vitamin-D-Mangel anerkannten Bereichs bis 30 nmol/l befindet. In den Monaten Februar und März befinden sich gemäß der genannten Erhebung mehr als 50 % der Konzentrationen in diesem schweren Mangelbereich.[54]
Ohne einen begründeten Verdacht sei es nach Einschätzung der Deutschen Gesellschaft für Ernährung (DGE) nicht sinnvoll, den eigenen Vitamin-D-Spiegel bestimmen zu lassen. Wenn man hingegen einer Risikogruppe angehört, könne es wegen der wichtigen Funktionen von Vitamin D3 im menschlichen Stoffwechsel jedoch auch angebracht sein, entsprechende Präparate zusätzlich zur Nahrung einzunehmen.[55]
Risikogruppen
Ältere Menschen ab 65 Jahren zählen zu den Risikogruppen, da im Alter die Fähigkeit der Vitamin-D-Syntheseleistung der Haut deutlich abnimmt. In kurzer Zeit kann so keine große Menge an Vitamin D mehr erzeugt werden.
Die erforderliche Sonnenexposition ist häufig nicht gewährleistet bei Menschen, die über einen längeren Zeitraum immobil bzw. bettlägerig sind und nicht ausreichend Zeit im Freien verbringen. Ebenso gehören Menschen, die sich nur mit gänzlich bedecktem Körper ans Tageslicht begeben, zu den Risikogruppen.
Angesichts des in Europa insbesondere unter Menschen in Pflegeheimen und unter Menschen außereuropäischer Herkunft verbreiteten Vitamin-D-Mangels empfehlen Wissenschaftler eine tägliche Vitamin-D-Supplementation für Personen, die zu einer Risikogruppe gehören.[56]
Säuglinge sind ebenfalls gefährdet, da sie wegen ihrer empfindlichen Haut und der unzureichenden Hitzeregulation nicht der direkten Sonne ausgesetzt werden dürfen. Unter gesunden Säuglingen, Kindern und Jugendlichen in Europa ist Vitamin-D-Mangel weit verbreitet. Zu den pädiatrischen Risikogruppen gehören:[57][58]
- gestillte Säuglinge ohne die empfohlene Vitamin-D-Gabe
- dunkelhäutige Kinder und Jugendliche in nördlichen Ländern
- Kinder und Jugendliche ohne ausreichende Sonnenexposition und
- übergewichtige Kinder.
Chronische Erkrankungen wie Leberkrankheiten und Nierenerkrankungen gelten ebenfalls als Hindernis für Vitamin-D-Aufnahme.[28] In Folge einer exokrinen Pankreasinsuffizienz kann es aufgrund einer verminderten bis fehlenden Produktion von Verdauungsenzymen zu einer mangelhaften Aufnahme von Vitamin D kommen.[59]
Symptome
Ein Vitamin-D-Mangel äußert sich im Allgemeinen unspezifisch.[60] Zu den Symptomen von Vitamin-D-Mangel bzw. der D-Avitaminose bei Erwachsenen gehören vor allem diffuse Knochen- und Muskelschmerzen sowie Muskelschwäche (Myopathie); zudem sind Frakturen (Knochenbrüche) möglich.[61]
Verschiedene Studien führen die unterschiedlichsten Gesundheitsprobleme auf einen Vitamin-D-Mangel zurück. Die US-Gesundheitsorganisation Institute of Medicine (IOM) hat über 1000 solcher Studien geprüft und kommt zu dem Ergebnis, dass sich in diesen Studien für fast keines dieser Probleme ausreichende Beweise finden lassen. Eine Ausnahme sieht das IOM bei Knochenleiden, für welche seiner Meinung nach die Beweislage eindeutig ist.[62]
Die eindrucksvollsten Symptome, die krankheitskennzeichnend sind, findet man am menschlichen Skelett. An erster Stelle stehen hier die Skelettschmerzen und Knochenverbiegungen, welche durch Diaphysenschäden aufgrund einer beeinträchtigten Knochenmineralisation entstehen. Des Weiteren kommt es zu Achsenabweichungen, die durch Knieverformungen zustande kommen, und Auftreibung bzw. Brechung der metaphysären Wachstumsfugen. Durch diese Veränderungen im Skelettsystem entstehen klinische Bilder wie die Skoliose, der Glockenthorax, der rachitische Rosenkranz (umschriebene Rippenschwellung an der Knorpel-Knochen-Grenze) oder die Kyphose. Es konnte auch ein wesentlicher Einfluss einer Vitamin-D3-Minderversorgung auf Überlastungsschäden am kindlichen Gelenk in Form der Osteochondrosis dissecans nachgewiesen werden. Hier führt das fehlende Vitamin D zu einem vermehrten Einbau von kalksalzfreiem Osteoid in wachsenden Knochen.
Der zweite Symptomkreis beruht auf Veränderungen im Nervensystem. Hier werden vor allem eine Neigung zur Tetanie, eine muskuläre Hypotonie und auch eine allgemeine motorische Entwicklungsverzögerung beobachtet. Darüber hinaus können Patienten mit Vitamin-D-Mangel epileptische Anfälle haben. Weitere Symptome sind Herzrhythmusstörungen, die durch eine Hypokalzämie entstehen können, eine allgemein erhöhte Infektanfälligkeit und eine Zahnfleischwucherung, die sogenannte Gingivahyperplasie.[63]
Folgen
Seit den 1990er Jahren wurde gezeigt, dass das Vitamin-D-System in verschiedenen anderen Geweben insbesondere intern steuernde (autokrine) Funktionen hat, welche die Zelldifferenzierung, die Hemmung der Zellproliferation, die Apoptose, die Immunmodulation und die Kontrolle anderer hormonaler Systeme umfasst. Daher wurde intensiv auf diesem Gebiet geforscht, wobei jene Studien teilweise zu sehr unterschiedlichen Ergebnissen kamen. Relativ unumstritten ist, dass ein guter Vitamin-D-Status Stürze und Knochenbrüche verhindern kann.[64] Die anderen Wirkungen sind trotz vieler Studien immer noch umstritten. Auffällig ist, dass viele Studien, die nach einem Zusammenhang zwischen Vitamin-D-Konzentration im Blut und Krankheiten suchten, diesen in der Regel fanden. Auf der anderen Seite kamen Studien, die untersuchten, ob Menschen, die zusätzlich Vitamin D einnehmen, mit geringerer Häufigkeit erkranken, häufig zu dem Schluss, dass kein Zusammenhang besteht. Eine Erklärungsmöglichkeit dafür wäre, dass nicht der niedrige Vitamin-D-Spiegel zu einer Krankheit führt, sondern dass die entzündlichen Prozesse, die mit vielen Krankheiten einhergehen, zu einem niedrigen Vitamin-D-Spiegel führen.[65]

Kardiovaskuläre Erkrankungen
Die Deutsche Gesellschaft für Ernährung (DGE) bewertete 2011 die Studienlage so, dass bei Gesunden wahrscheinlich kein Einfluss zwischen Vitamin-D-Supplementation und dem Blutdruck bestehe. Demgegenüber gebe es aber Hinweise darauf, dass bei bestehendem Bluthochdruck ein blutdrucksenkender Effekt eintrete.[67] Die DGE bewertete die Studienlage in Hinsicht auf kardiovaskuläre Erkrankungen als widersprüchlich. Trotzdem stufte sie einen Zusammenhang als „möglich“ ein.[68]
Auch in einer Übersichtsstudie von 2018 wurde festgestellt, dass die Forschung bis dato noch nicht zu eindeutigen Ergebnissen geführt hätte, die Empfehlungen hinsichtlich einer zusätzlichen Einnahme (Supplementation) von Vitamin D begründen könnten.[69]
Eine 2019 veröffentlichte Metaanalyse über 21 Studien mit insgesamt 83.291 Teilnehmern ergab, dass eine Vitamin-D-Supplementation keinen Herz-Kreislauf-Schutz bietet. Weder bei schweren kardiovaskulären Ereignissen (primärer Endpunkt) noch bei Herzinfarkt, Schlaganfall, Herz-Kreislauf-Sterblichkeit oder Gesamtsterblichkeit (sekundäre Endpunkte) zeigte sich ein Unterschied zwischen den Gruppen, die Placebo oder Verum erhalten hatten. Ausgangs-Vitamin-D-Spiegel, Geschlecht der Teilnehmer, Dosis und Formulierung der Vitamin-D-Supplemente sowie die zusätzliche Gabe von Calcium waren ohne Einfluss auf das Ergebnis.[70]
Infekte
Der mögliche Zusammenhang von Vitamin D und Virus-Infektionen ist Gegenstand der Forschung. Eine tägliche, niedrigdosierte Vitamin-D-Gabe (400–1000 IU/Tag) kann bei Kleinkindern oder Jugendlichen (1–16 Jahren) einen schwachen Schutzeffekt vor akuten Infektionen der Atemwege entfalten. Höhere Dosierungen zeigten keinen Vorteil, andere Altersgruppen profitieren nicht.[71]
Im Rahmen von COVID-19 geriet der mögliche Einfluss einer Vitamin-D-Supplementierung in den Fokus vieler Untersuchungen. Im Juni 2020 hatte das US-amerikanische National Institutes of Health keine Evidenzen für oder gegen eine Vitamin-D-Gabe gefunden, um COVID-19 zu behandeln oder davor zu schützen.[72] Dem schloss sich das britische National Institute for Health and Care Excellence (NICE) an.[73] Beide Organisationen halten an den vorausgegangenen Empfehlungen zur Vitamin-D-Supplementierung fest und weisen darauf hin, dass mehr Menschen Vitamin D benötigen, da sie während der Pandemie häufiger zu Hause waren.[72][73] Daher hat der National Health Service die Ausgabe von Vitamin D an Personen mit hohem Erkrankungsrisiko kostenlos zur Verfügung gestellt.[74] Im Dezember 2020 riet das NICE davon ab, mit Vitamin D zur alleinigen Behandlung oder Prävention vor COVID-19 zu supplementieren (außerhalb klinischer Prüfungen).[75] Ein Cochrane-Metareview[76] sowie das RKI[77] sehen ebenfalls keine ausreichende Evidenz für eine Behandlung mittels Vitamin D.
Einer neuen Metastudie zufolge hat Vitamin-D eine protektive Wirkung gegenüber Atemwegserkrankungen. Trotz nachgewiesen defizitärer Spiegel bei schweren COVID-Erkrankungen können die Autoren daraus aber keine generelle Empfehlung zu einer COVID-Prophylaxe ableiten.[78] Zu gleicher Einschätzung kommt das BfR in seiner jüngsten Revision zur Bewertung von Vitamin-D.[79] Allgemein wird für Personengruppen, die aufgrund einer Vitamin-D-Unterversorgung zur Risikogruppe zählen – z. B. Menschen mit dunkler Hautfarbe, ältere Menschen, Personen, die sich nicht oder kaum im Freien aufhalten oder dies gänzlich bedeckt tun – eine tägliche Supplementierung von 20 µg ≙ 800IE empfohlen.[80]
Ein systematischer Review vom November 2020 von 27 Publikationen zeigte, dass ein Vitamin-D-Mangel nicht mit einer erhöhten Infektanfälligkeit von COVID-19 assoziiert ist. Jedoch besteht eine positive Korrelation zwischen Vitamin-D-Mangel und der Schwere einer COVID-Infektion (inklusive Todesfälle).[81]
Eine schwerwiegende Komplikation von COVID-19 ist das sogenannte akute Lungenversagen, das durch einen Vitamin-D-Mangel verschlimmert werden kann.[82] Daher werden eine Reihe von klinischen Prüfungen in verschiedenen Ländern durchgeführt, um einen möglichen Nutzen einer Vitamin-D-Gabe zur Prävention und Behandlung von SARS-CoV-2-Infektionen zu untersuchen.[83]
Asthma und Autoimmunkrankheiten
Es wurde untersucht, ob eine Unterversorgung mit Vitamin D ein Risikofaktor für folgende Erkrankungen sein könnte:
- Autoimmunkrankheiten[84] (wie z. B. Multiple Sklerose,[85][86] Diabetes mellitus Typ 1,[87] Systemischer Lupus erythematodes[88]) möglicherweise.
- Asthma: Trotz intensiver Forschung ist immer noch unklar (Stand 2019), ob Vitamin-D-Zugabe bei Asthma einen Einfluss hat.[89]
- Für einen kausalen Zusammenhang zwischen einem Vitamin-D-Defizit und Diabetes mellitus Typ 2 gibt es keine Evidenz (Stand 2020).[60]
Erkrankungen mit Häufung bei älteren Menschen
Eine Unterversorgung mit Vitamin D scheint nach bisherigen Untersuchungen ein Risikofaktor für folgende Erkrankungen zu sein:
- Knochenerkrankungen: Osteopenie (umstritten) und Osteoporose[90]
- Sturzrisiko: Durch ergänzende Einnahme von Vitamin D lässt sich möglicherweise die Anzahl der Stürze von Menschen über 65 Jahren reduzieren. Die Einnahme von 700 bis 1000 IE reduzierte das Sturzrisiko um 19 Prozent.[91] Eine Metaanalyse von 2014 gelangte jedoch zu einem gegenteiligen Ergebnis.[92]
- Parkinson-Krankheit[93]
- Schlafstörungen wie obstruktives Schlaf-Apnoe-Syndrom,[94] verlängerte Einschlafphase[95] und Tagesmüdigkeit[96][97]
Krebs und weitere Erkrankungen
Das deutsche Krebsforschungszentrum hat 2014 in einer Metastudie mehrere europäische und US-amerikanische Beobachtungsstudien ausgewertet und kam zu dem Ergebnis, dass „Vitamin-D-Mangel wahrscheinlich keinen Einfluss auf die Krebsentstehung hat“, weshalb die Autoren nicht generell empfahlen, vorbeugend (prophylaktisch) Vitamin-D-Präparate einzunehmen. Gleichwohl könne sich ein niedriger Vitamin-D-Spiegel negativ auf den Verlauf einer bereits bestehenden Krebserkrankung auswirken.[98][99] Die Ergebnisse eines wahrscheinlich nicht vorhandenen Einflusses auf die Krebsentstehung wurden dann 2017 in einer umfangreichen Auswertung von genetischen und epidemiologischen Datenbanken bestätigt. So haben die Daten von über 70.000 Krebspatienten, die an sieben unterschiedlichen Krebsarten erkrankt waren, keinen kausalen Zusammenhang zwischen den Gen-Varianten, die den Vitamin-D-Spiegel im Blut beeinflussen, und dem Erkrankungsrisiko gezeigt.[100][101] Auch das RKI sieht bei einem Vitamin-D-Defizit keinen kausalen Zusammenhang für Krebserkrankungen.[102]
2017 endete die große randomisierte Placebo-kontrollierte Interventionsstudie VITAL[103] zur vorbeugenden Supplementation mit Vitamin D in der US-amerikanischen Allgemeinbevölkerung. Die Ergebnisse wurden im November 2018 veröffentlicht.[104] Dabei wurden 25.871 gesunde im Mittel 67-jährige Männer und Frauen untersucht, sie nahmen täglich entweder 2.000 IE Vitamin D oder Placebo ein. Im Vergleich zur Placebo-Einnahme konnte nach – im Median – 5,3 Jahren durch Vitamin-D-Einnahme das Risiko, an Krebs oder im Bereich Herz-Kreislauf zu erkranken, nicht gesenkt werden. Eine Vitamin-D-Gabe zur Prävention dieser Erkrankungen erwies sich als ungeeignet.[105]
Die Meta-Analyse von sechs randomisierten kontrollierten Studien über schwer erkrankte Patienten in Intensivpflege zeigte keine Linderung der Beschwerden bei einer Vitamin-D-Gabe. Hohe tägliche Dosen von mehr als 300.000 IE haben dabei auch die Mortalität nicht gesenkt.[106]
Drei Metaanalysen[107][108][109] klinischer Studien von 2019 kamen zu dem Ergebnis, dass eine Vitamin-D-Supplementierung bei einer Antikrebstherapie mit einer Verringerung der Sterberate an Krebs um etwa 13 Prozent einherging, jedoch nicht mit einem verringertem Krebsrisiko. So betrug beispielsweise die Sterberate einer parallelen Vitamin-D-Supplementierung 2,11 % im Vergleich zur Placebogruppe von 2,43 %.[109] Die Ergebnisse der Metaanalyse von N. Keum et al. übertrug das Deutschen Krebsforschungszentrum (DKFZ) im Jahr 2021 auf Deutschland[110] und errechnete, dass bei einer Vitamin-D-Supplementierung aller Deutschen über 50 Jahre möglicherweise bis zu 30.000 Krebstodesfälle pro Jahr vermieden und bei gleichzeitiger Kostenersparnis mehr als 300.000 Lebensjahre gewonnen werden könnten. Die Autoren betonen, dass die Supplementierung keinesfalls eine spezifische Antikrebstherapie ersetzt. Welche biologischen Mechanismen dem zugrunde liegen könnten, sei noch nicht genau geklärt. Eine routinemäßige Bestimmung des Vitamin-D-Spiegels wird für verzichtbar erachtet, da bei einer Supplementierung von 1.000 internationalen Einheiten eine Überdosierung nicht zu befürchten sei. Es verdichten sich weitere positive Gesundheitseffekte einer ausreichenden Vitamin-D-Versorgung, etwa bei den Sterberaten an Lungenerkrankungen.[80]
Eine Unterversorgung mit Vitamin D könnte nach bisherigen Untersuchungen allerdings ein Risikofaktor für folgende Erkrankungen sein:
- Muskelschwäche und -schmerzen und Fibromyalgie[111][112][113]
- Infektionskrankheiten wie Tuberkulose[114] oder Atemwegsinfekte[56]
- Parodontitis[115]
Vitamin-D-Bestimmung
Die Bestimmung des Vitamin-D3-Spiegels im Blutserum reflektiert nur die Vitamin-D-Aufnahme mit der Nahrung bzw. die Eigensynthese in der Haut während der letzten Stunden bis Tage. Für eine Untersuchung des längerfristigen Vitamin-D-Status ist die Bestimmung des 25(OH)Vitamin-D3-Spiegels im Blut, in das Vitamin D3 in der Leber rasch umgewandelt wird (siehe oben), sinnvoller. Die Halbwertszeit des 25(OH) Vitamins D3 in der Blutzirkulation ist je nach Vitamin-D-Gesamtstatus 1–2 Monate. Bis sich nach einer Änderung der täglichen Vitamin-D-Zufuhr ein neues Fließgleichgewicht mit einem dann wieder stabilen Serumwert einstellt, vergehen bis zu vier Monate.[34]
Das 25(OH)D3 lässt sich seit Anfang der 1980er Jahre bestimmen und ermöglichte ein weitergehendes Verständnis für die Physiologie des Vitamins D3. Die Angabe der Messwerte erfolgt entweder in Gewichts- oder molaren Konzentrationseinheiten, wobei 1 ng/ml etwa 2,5 nmol/l entspricht.
Die analytische Messung des 25(OH)Vitamin-D3-Spiegels im Serum kann nach HPLC-Trennung mittels massenspektrometrischer Detektion (MS) erfolgen. „Goldstandard“ ist der Radiorezeptor-Assay (RRA) unter Verwendung eines 3H-markierten Tracers, der jedoch in Deutschland so gut wie nicht mehr zur Anwendung kommt. Weniger aufwendig sind automatisierte, routinetaugliche immunologische Methoden, die jedoch als störanfällig gelten. Größere Messunsicherheit wird den in Apotheken erhältlichen Schnelltests zugeschrieben, da eine zuverlässige Qualitätskontrolle für solche nicht existiere.[116]
Bewertung des 25(OH)Vitamin-D3-Spiegels
Menschen aus südlichen Ländern, die viel der Sonne ausgesetzt sind und ihre Haut nicht komplett bedecken, haben häufig Serumkonzentrationen von 50 bis 90 ng/ml.[31] Bei den noch ursprünglich lebenden Massai und Hadza wurde ein mittlerer 25(OH)Vitamin-D3-Spiegel von 46 ng/ml gemessen.[117]
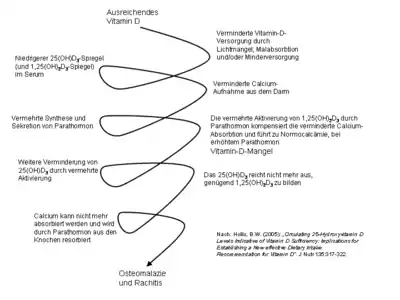
Ab einer Serumkonzentration von unter 30 ng/ml kompensiert der Körper mangelnde Vitamin-D-Wirkungen auf den Calciumhaushalt mit einem erhöhten Parathormon (s. u.). Die Calciumabsorption im Darm ist im Wesentlichen von der aktiven Form 1α,25(OH)2Vitamin D3 beeinflusst und unabhängig vom 25 (OH) Vitamin-D3 Spiegel.[118] Ältere Studien hatten angenommen, dass die Calciumabsorption im Darm ab einem 25(OH)Vitamin-D3-Spiegel unter 30 ng/ml gebremst wird.[119]
Die Definition des Vitamin-D-Mangels anhand des 25-OH-Vitamin-D-Spiegels ist weiterhin kontrovers, und das amerikanische Institute of Medicine benennt weiterhin als unteren Grenzwert 20 ng/ml.[120] Andere gehen von folgender Bewertung der Serumkonzentration für 25(OH)D3 aus:
- Werte unter 11 ng/ml bedeuten eine ernste Rachitisgefahr für Kleinkinder und Säuglinge sowie eine Osteomalaziegefahr für den Erwachsenen.
- Werte unter 20 ng/ml bedeuten einen langfristig relevanten Vitamin-D-Mangel (auch wenn eine manifeste Rachitis oder Osteomalazie nicht zwangsläufig auftritt).
- Werte zwischen 20 und 30 ng/ml bedeuten einen relativen Mangel („Insuffizienz“).
- Werte zwischen 30 und 60 ng/ml bedeuten eine physiologisch sicher ausreichende Versorgung.
- Werte über 88 ng/ml können eine Vitamin-D-Überversorgung bedeuten.
- Werte über 150 ng/ml bedeuten eine Vitamin-D-Intoxikation.[13][31]
- Werte über 280 ng/ml führen zu ernsthaften Störungen in der Calciumhomöostase.[121]
Bezüglich dieser Normwerte differieren die Literaturangaben. In der sechsten Auflage des Buches Labor und Diagnose werden folgende Referenzbereiche für Vitamin D 25 OH genannt: Alter bis 50 Jahre: 50 bis 175 nmol/l (20 bis 70 ng/ml), Alter ab 50 Jahre: 63 bis 175 nmol/l (26 bis 70 ng/ml).[122] Werte zwischen 50 und 100 ng/ml werden als gut bezeichnet.[123]
Der Blutspiegel wird über einen weiten Dosisbereich täglicher Vitamin-D-Zufuhr von 20 µg (800 IE) bis 250–500 µg (10.000–20.000 IE) bei Erwachsenen in einem Bereich von 30 bis 88 ng/ml gehalten und steigt erst bei noch höherer Zufuhr an. Diese obere Grenze (20.000 IE) entspricht der maximalen täglichen Bildung des Vitamins D3 in der Haut.[34]
Häufigkeit niedriger 25(OH)Vitamin-D3-Spiegel
Je nach Jahreszeit, geografischer Breite, Nahrungsgewohnheiten, Bevölkerungsgruppe und Lebensstil fällt der 25(OH)Vitamin-D3-Spiegel in Bereiche, bei denen man von einem Vitamin-D-Mangel ausgehen muss. Niedrige Vitamin-D-Spiegel sind ein unabhängiger und langfristiger Risikofaktor für eine Reihe von Krankheiten (Krebserkrankungen, Autoimmunerkrankungen, Infektanfälligkeit, brüchigere Knochen). Da (wie oben erklärt) ein niedriger Vitamin-D-Spiegel zivilisationsbedingt ist, ist er zwar oft normal, aber deshalb noch nicht gesund. Folgende Werte fanden sich in verschiedenen Studien:
| Ort | geogr. Breite | Gruppe, Alter | Sommer/Herbst (ng/ml ± SD) | Winter/Frühjahr (ng/ml ± SD) | Ref. |
|---|---|---|---|---|---|
| Miami (Florida) | 26° | über 18. Lj. | 26,8 ± 10,3 (Männer) 25,0 ± 9,4 (Frauen) | 23,3 ± 8,4 | [31] |
| Boston (Massachusetts) | 43° | weiße Frauen 20.–40. Lj. | 34,2 ± 13,2 | 24,0 ± 8,6 | [31] |
| Boston (Massachusetts) | 43° | schwarze Frauen 20.–40. Lj. | 16,4 ± 6,6 | 12,1 ± 7,9 | [31] |
| Paris | 49° | männliche Jugendliche | 23,4 ± 8,0 | 8,2 ± 2,8 | [31] |
| Calgary (Alberta) | 51° | 27.–89. Lj. | 28,6 ± 9,4 | 22,9 ± 8,5 | [31] |
Paris wurde als Vertreter mitteleuropäischer Verhältnisse bezüglich geografischer Breite, Nahrungsgewohnheiten und Supplementation in die Tabelle aufgenommen. Hier fällt insbesondere der äußerst niedrige Wert im Winter auf. Zu bedenken ist jedoch u. a. die Reduktion der UV-Strahlung durch Smog.
Die Auswirkung unterschiedlicher Hautpigmentierung wird am Beispiel aus Boston deutlich.
Zusätzliche Einnahme als Ausgleich oder Ergänzung
| Lebensmittelkategorie | Höchstmengen |
|---|---|
| NEM (für Jugendliche oder Erwachsene) | 20 µg |
| Milch und Milchprodukte, einschließlich Käse (pro 100 g) | 1,5 µg |
| Brot und Getreideprodukte (außer Feinbackwaren) (pro 100 g) | 5 µg |
| Streichfette und Speiseöle (pro 100 g) | 7,5 µg |
| UV-bestrahlte Speisepilze (pro 100 g) | 10 µg |
| UV-bestrahlte Milch (pro 100 g) | 3,2 µg |
| Sonstige Lebensmittel (pro 100 g) | kein Zusatz |
Eine Supplementierung von Vitamin D in Nahrungsergänzungsmittel (NEM) zählen zu den beliebtesten, in Deutschland wurden 2018 etwa 5,7 Millionen Packungen Nahrungsergänzungsmittel mit Vitamin D in Apotheken, Drogerien und Supermärkte verkauft.[60] Die Notwendigkeit einer Co-Supplementation mit Vitamin K ist jedoch nicht belegt.[125]
Das Bundesinstitut für Risikobewertung (BfR) empfiehlt für Vitamin D die in der Tabelle gelisteten Höchstmengen für den Zusatz zu NEM und für die Anreicherung vonsonstigen Lebensmitteln.[124]
In der Schwangerschaft
In Bezug auf die Einnahme von Vitamin D während der Schwangerschaft ist die Studienlage nicht eindeutig. Das Bundesinstitut für Risikobewertung weist aber darauf hin (Stand: 2004), dass eine Überdosierung von Vitamin D in der Schwangerschaft schwerwiegende Folgen haben kann. Es könne z. B. „zu körperlicher und geistiger Retardierung, supravalvulärer Aortenstenose und Retinopathie des Kindes“ kommen.[126] Daher sollten schwangere Frauen „Tagesdosen über 12,5 μg (500 IE)/Tag nur nach strenger Indikationsstellung einnehmen“.[126]
Die generelle Empfehlung für Schwangere, zusätzliches Vitamin D als Ausgleich einzunehmen, wird auch durch eine Großstudie an 3.960 Mutter-Kind-Paaren in Frage gestellt, in der der mütterliche Calciferol-Spiegel nahezu keinen Einfluss auf die kindliche Knochendichte hatte.[127][128][129]
Zwei systematische Übersichtsarbeiten von 2017 und 2018 fanden keinen Zusammenhang zwischen dem Vitamin-D-Status während der Schwangerschaft und späteren Allergien oder Asthma des Kindes.[130][131]
Allgemeinbevölkerung
Ein statistischer Zusammenhang zwischen niedrigen Vitamin-D-Werten und verminderter Lebenserwartung ergab sich in einer sehr großen Zahl von Untersuchungen. Bislang (Stand 2019) war es jedoch nicht möglich zu klären, inwieweit niedrige Vitamin-D-Werte zu einem früheren Tod beitragen oder inwieweit ein schlechterer Gesundheitszustand zu niedrigeren Vitamin-D-Werten führt. Das Verhältnis von Ursache und Wirkung blieb also unklar. Eine konkrete Möglichkeit zur Klärung dieser Frage zeichnet sich jedoch ab. Sie besteht durch umfassende genetische Studien vom Typ der Mendelschen Randomisierung. Erste Ergebnisse solcher Studien liegen bereits vor. Sie lassen noch keine sicheren Schlussfolgerungen zu, zeigen jedoch, dass solche wahrscheinlich in naher Zukunft möglich sein werden.[132]
Die Absenkung des Risikofaktors Vitamin-D-Mangel durch Einnahme von Vitamin-D-Präparaten (Supplementation) bei deutlichem Vitamin-D-Mangel lässt in der Summe eher einen Rückgang der Sterberate (Mortalität) erwarten.[133]
In Ländern wie USA, Kanada, Schweden und Finnland werden bestimmte Lebensmittel bereits seit Jahren durch staatliche Vorgaben mit Vitamin D supplementiert. In vielen Ländern wird aufgrund der neuen Erkenntnisse in den letzten Jahren die Supplementation per Regularien angedacht, z. B. sogar im äquatornahen Indien.[134]
In einer randomisierten, kontrollierten Studie bei fast 400 Personen über 70 Jahren konnte man keine Erhöhung der Knochendichte nach Vitamin-D-Einnahme beobachten.[135] Sie hatten über ein Jahr 24.000 oder 48.000 IE Vitamin D monatlich eingenommen.
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) veröffentlichte auf seiner laufend aktualisierten Online-Plattform Gesundheitsinformation.de hinsichtlich Osteoporose folgende Schlussfolgerung (Stand März 2019):
„Nahrungsergänzungsmittel mit Vitamin D haben nach aktuellen Forschungsergebnissen jedoch keinen Nutzen.“[136]
D-A-CH-Referenzwerte der DGE, ÖGE, SGE/SVE
Die Deutsche Gesellschaft für Ernährung sieht trotz vergleichsweise niedrig angenommener Referenzwerte die Vitamin-D-Versorgung in Deutschland als insgesamt nicht ausreichend an (2017).[137] Sie rät in der bestehenden Empfehlung von 2012 bislang dennoch davon ab, ohne speziellen Grund Vitamin-D-Präparate zu sich zu nehmen. Eine Supplementierung sei nur zu empfehlen, wenn „eine unzureichende Versorgung nachgewiesen wurde und wenn eine gezielte Verbesserung der Versorgung, weder durch die Ernährung noch durch die körpereigene Vitamin-D-Bildung durch Sonnenbestrahlung zu erreichen ist.“[138] In der Regel werde in Deutschland durch diese Maßnahmen eine ausreichende Versorgung gewährleistet. Bei fehlender endogener Synthese, wenn also Menschen dauerhaft ohne Sonnenbestrahlung leben, empfiehlt die DGE, durch Nahrung und Vitamin-D-Präparate die folgenden Mengen an Vitamin D zu sich zu nehmen:[139] Sie gibt diese nun als „Schätzwerte für eine angemessene Zufuhr bei fehlender endogener Synthese“ an; die bis 2012 geltenden „Zufuhrempfehlungen“ wurden ohne Berücksichtigung der Eigensynthese ausgesprochen und waren im Mittel um den Faktor 4 geringer. Im Jahr 2012 wurden die folgenden Werte veröffentlicht:
- Säuglinge (0 bis unter 12 Monaten): 10 µg / 400 IE pro Tag (Schätzwert)
- Kinder (1 Jahr bis unter 15 Jahre): 20 µg / 800 IE pro Tag
- Jugendliche und Erwachsene (15 Jahre bis unter 65 Jahren): 20 µg / 800 IE pro Tag
- Erwachsene ab 65 Jahren: 20 µg / 800 IE pro Tag
- schwangere Frau: 20 µg / 800 IE pro Tag
- stillende Frau: 20 µg / 800 IE pro Tag
Zusammengefasst: Alle Personen 20 µg / 800 IE, Säuglinge bis 1 Jahr alt, die Hälfte dieser Dosis; 1 µg = 40 Internationale Einheiten (IE); 1 IE = 0,025 µg
Institute of Medicine
Die US-Gesundheitsorganisation Institute of Medicine (IOM) untersuchte zwischen 2008 und 2010 das bis dato vorhandene Datenmaterial über Vitamin D und seine Folgen für die menschliche Gesundheit. Ziel der Studie war es, konkrete, auf wissenschaftlichen Studien basierte Empfehlungen bezüglich Vitamin D zu geben. Die Studie ergab, dass gesundheitliche Vorteile über die Knochengesundheit hinaus für Vitamin-D-Werte höher als 20 μg/l wissenschaftlich umstritten sind. Der Tagesbedarf (RDA) an Vitamin D wurde damit auf etwa 15 µg / 600 IE festgelegt, wobei die maximale tägliche Dosis (Tolerable Upper Intake Level) auf 100 µg / 4.000 IE angehoben wurde. Die Empfehlung basiert auf dem Studium von mehr als 1000 Veröffentlichungen zu Vitamin D und ist damit die größte Vitamin-D-Untersuchung des letzten Jahrzehnts.[140]
In den Jahren nach Veröffentlichung der Studie des IOM berechneten die Forscher Paul J. Veugelers und John Paul Ekwaru eine andere Höchstmenge der täglichen Vitamin-D-Aufnahme.[141] Dieser liegt für Erwachsene bis 70 Jahren bei fast 9.000 IE/Tag. Diese berechneten Mengen werden kritisiert, da derart hohe Mengen weder durch die Nahrung noch durch die Sonne erreicht werden können.[142] Ohne Nahrungsergänzungsmittel würden damit alle Menschen als unterversorgt gelten.
Fachgesellschaften wie das National Institutes of Health vertreten weiterhin die Einschätzung des IOM.[143]
Tolerierbare obere Einnahmemenge
Die Europäische Behörde für Lebensmittelsicherheit nennt folgende tolerierbare obere Einnahmemenge (Tolerable Upper Intake Level):[144]
- Säuglinge (0 bis unter 12 Monaten): 25 µg/Tag (1.000 IE)
- 1–10 Jahre: 50 µg/Tag (2.000 IE)
- 11–17 Jahre: 100 µg/Tag (4.000 IE)
- 17+: 100 µg/Tag (4.000 IE)
- schwangere, stillende Frau: 100 µg/Tag (4.000 IE)
Vitamin-D-Überdosierung und -Toxizität
Eine akute oder chronische Vitamin-D-Überdosierung kann zu einer Vitamin-D-Hypervitaminose führen. Der Wissenschaftliche Lebensmittelausschuss der Europäischen Kommission hat 2002 folgendermaßen zu der Sicherheit des Vitamin D3 Stellung genommen:
„Eine maximale tägliche Dosis von 50 µg (2000 IE) für Jugendliche und Erwachsene (inklusive Schwangere und stillende Mütter) und 25 µg (1000 IE) für Kinder in den ersten zehn Lebensjahren sind von Gesunden ohne Risiko von Nebenwirkungen auch ohne medizinische Aufsicht langfristig einnehmbar.
Diese Angabe ist zumindest für Erwachsene vorsichtig und mit einem Sicherheitsfaktor von 2 versehen, das heißt, dass erst bei über doppelt so hohen Dosen Nebenwirkungen beobachtet wurden. Gemessen an den üblichen Vitamin-D-Dosierungen scheint diese Stellungnahme für Erwachsene einen ausreichenden Spielraum zu lassen. Bei Kleinkindern ist dieser Sicherheitsbereich geringer.“[34]
Von den meisten Autoren wird für Erwachsene eine tägliche Zufuhr bis zu 100 µg (4000 IE) Vitamin D3 über sechs Monate als sicher angesehen, das heißt ohne nachprüfbare Nebenwirkungen wie eine erhöhte Calciumausscheidung im Urin.[31][121] Bei postmenopausalen Frauen hat sich gezeigt, dass eine tägliche Supplementierung von 10 µg (400 IE; zusammen mit 1000 mg Calcium) assoziiert war mit einem 17-prozentigen Anstieg des Risikos von Nierensteinen über einen Zeitraum von sieben Jahren.[145] Hingegen hat eine Studie, welche über einen Zeitraum von 2011 bis 2018 durchgeführt wurde, bei der kein zusätzliches Calcium verabreicht wurde, gezeigt, dass wesentlich höhere Dosen Vitamin D3 verabreicht werden können (5000 IE bis 50000 IE) ohne jegliche negativen Auswirkungen auf die Nierengesundheit.[146]
Eine Serumskonzentration von Vitamin D3 von über 500 nmol/l (das entspricht über 200 ng/ml) gilt als möglicherweise toxisch.[145] Vereinzelt traten lebensbedrohliche Komplikationen auf, wenn dieser Wert überschritten wurde.[147]
Die Packungsbeilagen von apothekenpflichtigen Vitamin-D-Präparaten geben dagegen für Erwachsene mit normaler Funktion der Nebenschilddrüsen eine Überdosierungschwelle zwischen 40.000 und 100.000 IE (entspricht 1000 bis 2500 µg) pro Tag über ein bis zwei Monate an. Säuglinge und Kleinkinder können schon auf weitaus geringere Dosen empfindlich reagieren.
Siehe auch
- Hypovitaminose (Unterversorgung mit Vitaminen)
Literatur
- J. Haas: Vigantol – Adolf Windaus und die Geschichte des Vitamin D. Stuttgart 2007, ISBN 978-3-8047-2223-1.
- Birte Hintzpeter: Vitamin D Status in Germany: Prevalence of Vitamin D Deficiency, Determinants and Potential Health Implications. Der Andere Verlag, Tönning/ Lübeck/ Marburg 2008, ISBN 978-3-89959-782-0.
- A. S. Dusso, A. J. Brown, E. Slatopolsky: Vitamin D. In: American Journal of Physiology-Renal Physiology. 289, 2005, S. F8–F28 (Review). PMID 15951480
- Hajo Zeeb, Rüdiger Greinert: Bedeutung von Vitamin D in der Krebsprävention. In: Deutsches Ärzteblatt International. Band 107, Nr. 37, Köln 2010, S. 638–643.
- Armin Zittermann: Vitamin D in der Präventivmedizin. 2. Auflage. UNI-MED-Verlag, Bremen 2012, ISBN 978-3-8374-1249-9.
- Philippe Autier, Mathieu Boniol, Cecile Pizot, Patrick Mullie: Vitamin D status and ill health: a systematic review. In: The Lancet Diabetes & Endocrinology. 2, 2014, S. 76–89, doi:10.1016/S2213-8587(13)70165-7
- P. Pludowski, M. F. Holick u. a.: Vitamin D supplementation guidelines. In: The Journal of steroid biochemistry and molecular biology. Band 175, 01 2018, S. 125–135, doi:10.1016/j.jsbmb.2017.01.021, PMID 28216084, (Review), PDF.
- D. Steinhilber: Vitamin D – Kritische Betrachtung. Pharmazeutische Zeitung, 19. April 2020.
- Rachel E Neale et al.: The D-Health Trial: a randomised controlled trial of the effect of vitamin D on mortality. The Lancet Februar 2022, DOI. thelandet.com: Summary (Zusammenfassung).
Weblinks
- Cholecalciferol. In: KEGG.
- Deutsche Gesellschaft für Ernährung e. V.: Vitamin D (Calciferole): Schätzwerte für eine angemessene Vitamin-D-Zufuhr bei fehlender endogener Synthese.
- Bundesinstitut für Risikobewertung (BfR): Ausgewählte Fragen und Antworten zu Vitamin D
- Stella Marie Hombach: Das Sonnenscheinpräparat im Schatten des Geldes. In: MedWatch. 11. Mai 2021, abgerufen am 12. Mai 2021.
Einzelnachweise
- Eintrag zu Colecalciferol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. August 2016. (JavaScript erforderlich)
- Eintrag zu Cholecalciferol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Kumaravel Rajakumar: Vitamin D, Cod-Liver Oil, Sunlight, and Rickets: A Historical Perspective, Pediatrics, August 2003, Volume 112 / Issue 2, Artikel (englisch); Webseite mit ähnlichem Inhalt (deutsch).
- K. Huldschinsky: tg. In: Deutsche Medizinische Wochenschrift. 45, 1919, S. 712–713.
- A. Hess, L. Unger: Cure of infantile rickets by sunlight. Preliminary Notes. In: JAMA. 77, 1921, S. 39–41; doi:10.1001/jama.1921.02630270037013.
- E. V. McCollum, Nina Simmonds, J. Ernestine Becker, and P. G. Shipley: Studies on Experimental Rickets. XXI. An Experimental Demonstration of the Existence of a Vitamin Which Promotes Calcium Deposition, J. Biol. Chem. 53, 1922, S. 293–312, (PDF).
- Ali Vicdani Doyum: Alfred Kantorowicz unter besonderer Berücksichtigung seines Wirkens in İstanbul (Ein Beitrag zur Geschichte der modernen Zahnheilkunde). Medizinische Dissertation, Würzburg 1985, S. 215 f.
- Vitamin D Day - November 2nd is the day.. In: www.vitamindday.net. Archiviert vom Original am 16. Oktober 2013. Abgerufen am 3. Februar 2014.
- M. F. Holick: Environmental factors that influence the cutaneous production of vitamin D. In: Am J Clin Nutr. Band 61 (3 Suppl), 1995, S. 638S–645S.
- A. W. Norman: Sunlight, season, skin pigmentation, vitamin D, and 25-hydroxyvitamin D: integral components of the vitamin D endocrine system. In: Am J Clin Nutr. Band 67(6), 1998, S. 1108–1110.
- L. Y. Matsuoka, J. Wortsman, J. G. Haddad, B. W. Hollis: In vivo threshold for cutaneous synthesis of vitamin D3. In: The Journal of Laboratory and Clinical Medicine. Band 114, Nr. 3, 1989, S. 301–305, PMID 2549141.
- Rudi Hutterer: Fit in Biochemie. Springer, 2009, ISBN 978-3-8348-9379-6, S. 501. eingeschränkte Vorschau in der Google-Buchsuche
- B. W. Hollis: Circulating 25-Hydroxyvitamin D Levels Indicative of Vitamin D Sufficiency: Implications for Establishing a New Effective Dietary Intake Recommendation for Vitamin D. In: J Nutr. Band 135(2), 2005, S. 317–322.
- Camille E. Powe, Michele K. Evans, Julia Wenger, Alan B. Zonderman, Anders H. Berg, Michael Nalls, Hector Tamez, Dongsheng Zhang, Ishir Bhan, S. Ananth Karumanchi, Neil R. Powe, Ravi Thadhani: Vitamin D–Binding Protein and Vitamin D Status of Black Americans and White Americans. In: New England Journal of Medicine. 369, 2013, S. 1991–2000, doi:10.1056/NEJMoa1306357.
- R. Shinkyo, T. Sakaki, M. Kamakura, M. Ohta, K. Inouye: Metabolism of vitamin D by human microsomal CYP2R1. In: Biochem. Biophys. Res. Commun. Band 324, Nr. 1, November 2004, S. 451–457, doi:10.1016/j.bbrc.2004.09.073, PMID 15465040.
- J. B. Cheng u. a.: De-orphanization of Cytochrome P450 2R1, a microsomal Vitamin D 25-Hydroxylase. In: J Biol Chem. Band 278(39), 2003, S. 38084–38093.
- L. Zgaga, E. Laird, M. Healy: 25-Hydroxyvitamin D Measurement in Human Hair: Results from a Proof-of-Concept study. In: Nutrients. Band 11, Nummer 2, Februar 2019, S. , doi:10.3390/nu11020423, PMID 30781610 (freier Volltext).
- A. S. Dusso u. a.: Vitamin D. (Memento vom 15. Mai 2007 im Internet Archive) In: Am J Physiol Renal Physiol. Band 289, 2005, S. F8–F28.
- A. L. Negri: Proximal tubule endocytic apparatus as the specific renal uptake mechanism for vitamin D-binding protein/25-(OH)D3 complex. In: Nephrology (Carlton). Band 11, Nr. 6, Dezember 2006, S. 510–515, doi:10.1111/j.1440-1797.2006.00704.x, PMID 17199789.
- G. S. Reddy, K. Y. Tserng: Calcitroic acid, end product of renal metabolism of 1,25-dihydroxyvitamin D3 through C-24 oxidation pathway. In: Biochemistry. Band 28, Nr. 4, 21. Februar 1989, S. 1763–1769, PMID 2719932.
- CYTOCHROME P450, FAMILY 24, SUBFAMILY A, POLYPEPTIDE 1; CYP24A1. In: Online Mendelian Inheritance in Man. (englisch)
- E. S. Kang u. a.: Hypercalcemia in granulomatous disorders: a clinical review. In: Curr Opin Pulm Med. 6(5), Sep 2000, S. 442–447. PMID 10958237.
- A. L. Lameris, C. L. Geesing, J. G. Hoenderop, M. F. Schreuder: Importance of dietary calcium and vitamin D in the treatment of hypercalcaemia in Williams-Beuren syndrome. In: Journal of pediatric endocrinology & metabolism : JPEM. Band 27, Nummer 7–8, Juli 2014, S. 757–761, doi:10.1515/jpem-2013-0229, PMID 24572979 (Review), PDF.
- M. Movassaghi, S. Bianconi, R. Feinn, C. A. Wassif, F. D. Porter: Vitamin D levels in Smith-Lemli-Opitz syndrome. In: American journal of medical genetics. Part A. Band 173, Nummer 10, Oktober 2017, S. 2577–2583, doi:10.1002/ajmg.a.38361, PMID 28796426, PMC 5603413 (freier Volltext).
- K. P. Schlingmann, M. Kaufmann, S. Weber, A. Irwin, C. Goos, U. John, J. Misselwitz, G. Klaus, E. Kuwertz-Bröking, H. Fehrenbach, A. M. Wingen, T. Güran, J. G. Hoenderop, R. J. Bindels, D. E. Prosser, G. Jones, M. Konrad: Mutations in CYP24A1 and idiopathic infantile hypercalcemia. In: The New England Journal of Medicine. Band 365, Nummer 5, August 2011, S. 410–421, doi:10.1056/NEJMoa1103864, PMID 21675912 (freier Volltext).
- E. De Paolis, G. L. Scaglione, M. De Bonis, A. Minucci, E. Capoluongo: CYP24A1 and SLC34A1 genetic defects associated with idiopathic infantile hypercalcemia: from genotype to phenotype. In: Clinical chemistry and laboratory medicine. [elektronische Veröffentlichung vor dem Druck] Juni 2019, doi:10.1515/cclm-2018-1208, PMID 31188746 (Review).
- T. Jobst-Schwan, A. Pannes, K. P. Schlingmann, K. U. Eckardt, B. B. Beck, M. S. Wiesener: Discordant Clinical Course of Vitamin-D-Hydroxylase (CYP24A1) Associated Hypercalcemia in Two Adult Brothers With Nephrocalcinosis. In: Kidney & blood pressure research. Band 40, Nummer 5, 2015, S. 443–451, doi:10.1159/000368520, PMID 26304832 (Review) (freier Volltext).
- Gesundheitsamt Bremen (Hrsg.): Vitamin D-Mangel im Alter. In: Umwelt: Ernährung: Vitamin D-Mangel. Gesundheitsamt Bremen; abgerufen am 26. März 2015.
- Sven Siebenand: Das Hormon der Streithähne. In: Pharmazeutische Zeitung online. 06/2012, Hg. v. ABDA – Bundesvereinigung Deutscher Apothekerverbände, Govi-Verlag, Berlin 2012; abgerufen am 26. März 2015.
- Annette Mende: Vitamin D: Mangel ist weit verbreitet. In: Pharmazeutische Zeitung online. 16/2011, Hg. v. ABDA – Bundesvereinigung Deutscher Apothekerverbände. Govi-Verlag, Berlin 2011; abgerufen am 26. März 2015.
- W. B. Grant, M. F. Holick: Benefits and Requirements of Vitamin D for Optimal Health: A Review. (Memento vom 17. April 2012 im Internet Archive) (PDF; 262 kB). In: Altern Med Rev. Band 10(2), 2005, S. 94–111.
- L. M. Bodnar, H. N. Simhan, R. W. Powers, M. P. Frank, E. Cooperstein, J. M. Roberts: High prevalence of vitamin D insufficiency in black and white pregnant women residing in the northern United States and their neonates. In: The Journal of Nutrition. Band 137, Nummer 2, Februar 2007, S. 447–452. PMID 17237325.
- Camille E. Powe, Michele K. Evans, Julia Wenger, Alan B. Zonderman, Anders H. Berg, Michael Nalls, Hector Tamez, Dongsheng Zhang, Ishir Bhan, S. Ananth Karumanchi, Neil R. Powe, Ravi Thadhani: Vitamin D–Binding Protein and Vitamin D Status of Black Americans and White Americans. In: New England Journal of Medicine. 2013, Band 369, Ausgabe 21, 21. November 2013, S. 1991–2000. doi:10.1056/NEJMoa1306357.
- Wissenschaftlicher Lebensmittelausschuss der Europäischen Kommission: Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Vitamin D. 2002 (englisch; PDF; 385 kB).
- P. Urbain, F. Singler, G. Ihorst, H.-K. Biesalski, H. Bertz: Bioavailability of vitamin D2 from UV-B-irradiated button mushrooms in healthy adults deficient in serum 25-hydroxyvitamin D: a randomized controlled trial. In: European Journal of Clinical Nutrition. 65, 2011, S. 965–971, doi:10.1038/ejcn.2011.53. DRKS-ID der Studie: DRKS00000195
- Paul Stamets: Place Mushrooms in Sunlight to Get Your Vitamin D. fungi.com, 08/06/2012; abgerufen am 29. April 2014.
- Dustmann, H.; Gnann, T.:Native Vitamin-D-Milch: Höhere Wertschöpfung durch nativ angereicherten Inhaltsstoff In: Deutsche Molkerei Zeitung. 2013, 134. Jg., Heft 6, S. 24-27.
- Deutsches Patent- und Markenamt (2019, 4. April): Verfahren zur Herstellung von Milch mit hohem Gehalt an nativen Vitamin D. Online: Stand [04.07.2019], o. S.
- Gerhard G Habermehl, Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie: Eine Einführung. 2008, S. 70.
- Nährwerte Matjeshering gesalzen. (Nicht mehr online verfügbar.) In: Nährwertrechner.de. Archiviert vom Original am 14. März 2012; abgerufen am 26. April 2013.
- Souci, Fachmann, Kraut: Nährwerttabellen. medpharm, Stuttgart 2008 Souci-Fachmann-Kraut-Datenbank. (Memento vom 30. Dezember 2007 im Internet Archive)
- Joachim Gärtner, Andrea Servatius: Vitamin D: Symptome, Wirkung, Blutspiegel, Gehalt in Lebensmitteln, Nahrungsergänzung, Medikamente.
- Vitamin D (Calciferole). In: Deutsche Gesellschaft für Ernährung e.V. Abgerufen am 24. Dezember 2018 (Referenzwerte für die Vitamin-D3-Zufuhr).
- Vitamin D: EFSA legt Referenzwerte für Aufnahme fest. Europäische Behörde für Lebensmittelsicherheit, 2016.
- Opinion on the tolerable upper intake level of Vitamin D. (PDF; 385 kB) European Commission – Scientific Committee on Food, 2002.
- JoAnn E. Manson, Patsy M. Brannon, R.D., Clifford J. Rosen, Christine L. Taylor: Vitamin D Deficiency – Is There Really a Pandemic? In: New England Journal of Medicine. Band 375, 10. November 2016, S. 1817–1820, doi:10.1056/NEJMp1608005.
- Vitamin D: Einnahme hochdosierter Nahrungsergänzungsmittel unnötig, vom 31. Juli 2020, doi:10.17590/20200731-141633
- G. Mensink: Die aktuelle Nährstoffversorgung von Kindern und Jugendlichen in Deutschland. Ergebnisse aus EsKiMo. In: Ernährungsumschau. Band 11, 2007, S. 636–646.
- Die Kalzium- und Vitamin-D-Zufuhr von Kindern (Peer-Review-Beitrag). (Nicht mehr online verfügbar.) In: Ernährungsumschau 09/2008. 2008, archiviert vom Original am 12. Januar 2009; abgerufen am 24. Dezember 2018.
- M. S. Calvo u. a.: Vitamin D Intake: A Global Perspective of Current Status. In: J Nutr. 135, S. 310–316.
- Nationale Verzehrstudie II 2008. Max Rubner-Institut und Bundesforschungsinstitut für Ernährung und Lebensmittel.
- L. M. Gartner, F. R. Greer: Section on Breastfeeding and Committee on Nutrition: Prevention of Rickets and Vitamin D Deficiency: New Guidelines for Vitamin D Intake. In: Pediatrics. Band 111, 2003, S. 908–910.
- K. D. Cashman, K. G. Dowling u. a.: Vitamin D deficiency in Europe: pandemic? In: The American Journal of Clinical Nutrition. Band 103, Nummer 4, April 2016, S. 1033–1044, doi:10.3945/ajcn.115.120873, PMID 26864360, PMC 5527850 (freier Volltext).
- Martina Rabenberg, Christa Scheidt-Nave, Markus A. Busch, Nina Rieckmann, Birte Hintzpeter: Vitamin D status among adults in Germany – results from the German Health Interview and Examination Survey for Adults (DEGS1). In: BMC Public Health. Band 15, Nr. 1, Dezember 2015, ISSN 1471-2458, S. 1–15, doi:10.1186/s12889-015-2016-7 (biomedcentral.com [abgerufen am 10. Januar 2021]).
- Ausgewählte Fragen und Antworten zu Vitamin D - Gemeinsame FAQ des BfR, der DGE und des MRI vom 22. Oktober 2012. In: www.dge.de.
- A. Zittermann, S. Pilz, H. Hoffmann, W. März: Vitamin D and airway infections: a European perspective. In: European Journal of Medical Research. Band 21, März 2016, S. 14, doi:10.1186/s40001-016-0208-y, PMID 27009076, PMC 4806418 (freier Volltext) (Review).
- C. Braegger, C. Campoy, V. Colomb, T. Decsi, M. Domellof, M. Fewtrell, I. Hojsak, W. Mihatsch, C. Molgaard, R. Shamir, D. Turck, J. van Goudoever: Vitamin D in the healthy European paediatric population. In: Journal of Pediatric Gastroenterology and Nutrition. Vol. 56, Nr. 6, 2013, S. 692–701. PMID 23708639, PDF
- J. Y. Lee, T. Y. So, J. Thackray: A review on vitamin d deficiency treatment in pediatric patients. In: The Journal of Pediatric Pharmacology and Therapeutics : JPPT : the official journal of PPAG. Band 18, Nummer 4, Oktober 2013, S. 277–291, doi:10.5863/1551-6776-18.4.277, PMID 24719588, PMC 3979050 (freier Volltext) (Review).
- Silke Klapdor, Eva Richter, Rainer Klapdor: Fettlösliche Vitamine bei Erkrankungen der Bauchspeicheldrüse. In: Ernährungs-Umschau, Ausgabe 08/2012, Seite 436–441.
- Sina Horsthemke: Vitamin D: Genügt die Sonne für den Knochenschutz? In: Spektrum.de. 25. September 2020, abgerufen am 8. November 2020.
- Alexandra Jungert u. a.: Vitaminsubstitution im nichtkindlichen Bereich. Notwendigkeit und Risiken. In: Deutsches Ärzteblatt. Band 117, Heft 1–2, 6. Januar 2020, S. 14–22, hier: S. 17.
- Dietary Reference Intakes for Calcium and Vitamin D (PDF; 6,7 MB)
- S1-Leitlinie 174-007: Vitamin-D-Mangel-Rachitis. (PDF) DGKED, März 2016.
- Vitamin D – der aktuelle D-A-CH-Referenzwert aus Sicht der Risikobewertung (PDF; 523 kB) Bundesinstitut für Risikobewertung, 2013, S. 15.
- Philippe Autier, Mathieu Boniol u. a.: Vitamin D status and ill health: a systematic review In: The Lancet. Volume 2, No. 1, Januar 2014, S. 76–89.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 152.
- Stellungnahme: Vitamin D und Prävention ausgewählter chronischer Krankheiten. (PDF) DGE, 2011.
- Stellungnahme: Vitamin D und Prävention ausgewählter chronischer Krankheiten (PDF) DGE, 2011.
- B. Kheiri, A. Abdalla, M. Osman, S. Ahmed, M. Hassan, G. Bachuwa: Vitamin D deficiency and risk of cardiovascular diseases: a narrative review. In: Clinical Hypertension. Band 24, 2018, S. 9, doi:10.1186/s40885-018-0094-4, PMID 29977597, PMC 6013996 (freier Volltext) (Review).
- JoAnn E. Manson, Mohammad Luay Alkotob, Ghassan Bachuwa, Saira Sundus, Anitha Yelangi: Vitamin D Supplementation and Cardiovascular Disease Risks in More Than 83 000 Individuals in 21 Randomized Clinical Trials: A Meta-analysis. In: JAMA Cardiology. 19. Juni 2019, doi:10.1001/jamacardio.2019.1870 (jamanetwork.com [abgerufen am 24. Juni 2019]).
- Scientific Advisory Committee on Nutrition: Update of rapid review: Vitamin D and acute respiratory tract infections. (PDF) UK government, 17. Dezember 2020, abgerufen am 5. Januar 2021 (englisch).
- Vitamin D. In: NIH. 17. Juli 2020, abgerufen am 4. Januar 2021 (englisch).
- Advisory statement on likely place in therapy COVID-19 rapid evidence summary: vitamin D for COVID-19 Advice NICE. In: www.nice.org.uk. Abgerufen am 2. Oktober 2020.
- Get vitamin D supplements if you're at high risk from coronavirus (COVID-19). In: NHS. 18. Dezember 2020, abgerufen am 4. Januar 2021 (englisch).
- COVID-19 rapid guideline: vitamin D. In: National Institute for Health and Care Excellence. 17. Dezember 2020, abgerufen am 5. Januar 2021 (englisch).
- Julia Kristin Stroehlein et al.: Vitamin D supplementation for the treatment of COVID-19: a living systematic review. In: The Cochrane Database of Systematic Reviews. Band 5, 24. Mai 2021, S. CD015043, doi:10.1002/14651858.CD015043, PMID 34029377.
- Medikamentöse Therapie bei COVID-19 mit Bewertung durch die Fachgruppe COVRIIN am Robert-Koch-Institut. In: Fachgruppe COVRIIN (Hrsg.): RKI. 20. Oktober 2021, S. 15, doi:10.25646/7743.14.
- David A. Joliffe et al.: Vitamin D supplementation to prevent acute respiratory infections: a systematic review and meta-analysis of aggregate data from randomised controlled trials, The Lancet, 1. Mai 2021, doi:10.1016/S2213-8587(21)00051-6
- Bundesinstitut für Risikobewertung Vitamin D, das Immunsystem und COVID-19, BfR, 14. Mai 2021
- DKFZ Pressemitteilung: Vitamin D-Supplementierung: möglicher Gewinn an Lebensjahren bei gleichzeitiger Kostenersparnis, DKFZ, 11. Februar 2021, abgerufen am 21. Februar 2021
- Marcos Pereira et al.: Vitamin D deficiency aggravates COVID-19: systematic review and meta-analysis. In: Critical Reviews in Food Science and Nutrition. Band 0, Nr. 0, 4. November 2020, S. 1–9, doi:10.1080/10408398.2020.1841090, PMID 33146028.
- Jose Manuel Quesada-Gomez et al.: Vitamin D receptor stimulation to reduce acute respiratory distress syndrome (ARDS) in patients with coronavirus SARS-CoV-2 infections: Revised Ms SBMB 2020_166. In: The Journal of Steroid Biochemistry and Molecular Biology. Band 202, 1. September 2020, S. 105719, doi:10.1016/j.jsbmb.2020.105719.
- International clinical trials assessing vitamin D in people with COVID-19. ClinicalTrials.gov, US National Library of Medicine. Mai 2020. Abgerufen am 5. September 2020.
- C. Y. Yang, P. S. Leung, I. E. Adamopoulos, M. E. Gershwin: The implication of vitamin D and autoimmunity: a comprehensive review. In: Clinical Reviews in Allergy & Immunology. Band 45, Nummer 2, Oktober 2013, S. 217–226, doi:10.1007/s12016-013-8361-3, PMID 23359064, PMC 6047889 (freier Volltext) (Review).
- D. Häusler, M. S. Weber: Vitamin D Supplementation in Central Nervous System Demyelinating Disease-Enough Is Enough. In: International Journal of Molecular Sciences. Band 20, Nummer 1, Januar 2019, S. , doi:10.3390/ijms20010218, PMID 30626090, PMC 6337288 (freier Volltext) (Review).
- M. B. Sintzel, M. Rametta, A. T. Reder: Vitamin D and Multiple Sclerosis: A Comprehensive Review. In: Neurology and Therapy. Band 7, Nummer 1, Juni 2018, S. 59–85, doi:10.1007/s40120-017-0086-4, PMID 29243029, PMC 5990512 (freier Volltext) (Review).
- K. Rak, M. Bronkowska: Immunomodulatory Effect of Vitamin D and Its Potential Role in the Prevention and Treatment of Type 1 Diabetes Mellitus-A Narrative Review. In: Molecules. Band 24, Nummer 1, Dezember 2018, S. , doi:10.3390/molecules24010053, PMID 30586887, PMC 6337255 (freier Volltext) (Review).
- F. Dall'Ara, M. Cutolo, L. Andreoli, A. Tincani, S. Paolino: Vitamin D and systemic lupus erythematous: a review of immunological and clinical aspects. In: Clinical and Experimental Rheumatology. Band 36, Nummer 1, 2018 Jan-Feb, S. 153–162, PMID 29148401 (Review), PDF.
- S. C. Hall, D. K. Agrawal: Vitamin D and Bronchial Asthma: An Overview of Data From the Past 5 Years. In: Clinical Therapeutics. Band 39, Nummer 5, Mai 2017, S. 917–929, doi:10.1016/j.clinthera.2017.04.002, PMID 28449868, PMC 5607643 (freier Volltext) (Review).
- P. Alonso-Coello, A. L. García-Franco, G. Guyatt, R. Moynihan: Drugs for pre-osteoporosis: prevention or disease mongering? In: BMJ. Band 336, Nummer 7636, Januar 2008, S. 126–129, doi:10.1136/bmj.39435.656250.AD, PMID 18202066, PMC 2206291 (freier Volltext).
- H. A. Bischoff-Ferrari, B. Dawson-Hughes, H. B. Staehelin u. a.: Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. In: BMJ. Band 339, 2009, S. b3692, doi:10.1136/bmj.b3692, PMID 19797342, PMC 2755728 (freier Volltext).
- M. J. Bolland, A. Grey, G. D. Gamble, I. R. Reid: Vitamin D supplementation and falls: a trial sequential meta-analysis. In: The lancet. Diabetes & endocrinology. Band 2, Nummer 7, Juli 2014, S. 573–580, doi:10.1016/S2213-8587(14)70068-3, PMID 24768505.
- Z. Zhou, R. Zhou, Z. Zhang, K. Li: The Association Between Vitamin D Status, Vitamin D Supplementation, Sunlight Exposure, and Parkinson's Disease: A Systematic Review and Meta-Analysis. In: Medical science monitor: international medical journal of experimental and clinical research. Band 25, Januar 2019, S. 666–674, doi:10.12659/MSM.912840, PMID 30672512, PMC 6352758 (freier Volltext) (Review).
- K. Archontogeorgis, E. Nena, N. Papanas, P. Steiropoulos: The role of vitamin D in obstructive sleep apnoea syndrome. In: Breathe. Band 14, Nummer 3, September 2018, S. 206–215, doi:10.1183/20734735.000618, PMID 30186518, PMC 6118887 (freier Volltext) (Review).
- X. Ji, M. A. Grandner, J. Liu: The relationship between micronutrient status and sleep patterns: a systematic review. In: Public health nutrition. Band 20, Nummer 4, 03 2017, S. 687–701, doi:10.1017/S1368980016002603, PMID 27702409, PMC 5675071 (freier Volltext) (Review).
- D. E. McCarty, A. Reddy u. a.: Vitamin D, race, and excessive daytime sleepiness. In: Journal of Clinical Sleep Medicine: JCSM: official publication of the American Academy of Sleep Medicine. Band 8, Nummer 6, Dezember 2012, S. 693–697, doi:10.5664/jcsm.2266. PMID 23243403. PMC 3501666 (freier Volltext).
- E. A. Shipton, E. E. Shipton: Vitamin D and Pain: Vitamin D and Its Role in the Aetiology and Maintenance of Chronic Pain States and Associated Comorbidities. In: Pain research and treatment. Band 2015, 2015, S. 904967, doi:10.1155/2015/904967, PMID 26090221, PMC 4427945 (freier Volltext) (Review).
- B. Schöttker, R. Jorde u. a.: Vitamin D and mortality: meta-analysis of individual participant data from a large consortium of cohort studies from Europe and the United States. In: BMJ. Band 348, Juni 2014, S. g3656, doi:10.1136/bmj.g3656, PMID 24938302, PMC 4061380 (freier Volltext).
- Ungünstige Krebs-Prognose bei niedrigem Vitamin-D-Spiegel, abgerufen am 21. November 2016.
- V. I. Dimitrakopoulou et al.: Circulating vitamin D concentration and risk of seven cancers: Mendelian randomisation study. In: BMJ. Band 359, 10 2017, S. j4761, doi:10.1136/bmj.j4761, PMID 29089348, PMC 5666592 (freier Volltext).
- Ärzte Zeitung: Kein Beleg gefunden: Vitamin D schützt wohl nicht vor Krebs. Abgerufen am 26. März 2018.
- Antworten des Robert Koch-Instituts auf häufig gestellte Fragen zu Vitamin D. In: RKI. 25. Januar 2019, abgerufen am 8. November 2020.
- About the Vital Study. In: www.vitalstudy.org.
- JoAnn E. Manson et al.: Vitamin D Supplements and Prevention of Cancer and Cardiovascular Disease. In: The New England Journal of Medicine. 10. November 2018, doi:10.1056/NEJMoa1809944, PMID 30415629., PDF.
- Vitamin D – kein Schutz vor Krebs und Herz-Kreislauf-Erkrankungen. In: arznei-telegramm. Band 49, Nr. 103, 2018 (arznei-telegramm.de).
- Pascal L. Langlois et al.: Vitamin D supplementation in the critically ill: A systematic review and meta-analysis. In: Clinical Nutrition (Edinburgh, Scotland). Band 37, Nr. 4, August 2018, S. 1238–1246, doi:10.1016/j.clnu.2017.05.006, PMID 28549527.
- Keum N, Lee DH, Greenwood DC, Manson JE, Giovannucci E. Vitamin D supplementation and total cancer incidence and mortality: a meta-analysis of randomized controlled trials. Ann Oncol. 2019;30(5):733-43. doi:10.1093/annonc/mdz059
- Haykal T. et al.: The role of vitamin D supplementation for primary prevention of cancer: meta-analysis of randomized controlled trials. J Community Hosp Intern Med Perspect. 2019;9(6):480-8. doi:10.1080/20009666.2019.1701839
- Zhang X, Niu W.: Meta-analysis of randomized controlled trials on vitamin D supplement and cancer incidence and mortality. Biosci Rep. 2019;39(11) doi:10.1042/BSR20190369
- Tobias Niedermaier et al.: Potential for cost-saving prevention of almost 30,000 cancer deaths per year by vitamin D supplementation of the older adult population in Germany. Molecular Oncology 2020, doi:10.1002/1878-0261.12924
- M. Helde-Frankling, L. Björkhem-Bergman: Vitamin D in Pain Management. In: International Journal of Molecular Sciences. Band 18, Nummer 10, Oktober 2017, S. , doi:10.3390/ijms18102170, PMID 29057787, PMC 5666851 (freier Volltext) (Review).
- E. Wintermeyer, C. Ihle, S. Ehnert, U. Stöckle, G. Ochs, P. de Zwart, I. Flesch, C. Bahrs, A. K. Nussler: Crucial Role of Vitamin D in the Musculoskeletal System. In: Nutrients. Band 8, Nummer 6, Juni 2016, S. , doi:10.3390/nu8060319, PMID 27258303, PMC 4924160 (freier Volltext) (Review).
- S. Karras, E. Rapti, S. Matsoukas, K. Kotsa: Vitamin D in Fibromyalgia: A Causative or Confounding Biological Interplay? In: Nutrients. Band 8, Nummer 6, Juni 2016, S. , doi:10.3390/nu8060343, PMID 27271665, PMC 4924184 (freier Volltext) (Review).
- A. P. Ralph, R. M. Lucas, M. Norval: Vitamin D and solar ultraviolet radiation in the risk and treatment of tuberculosis. In: The Lancet. Infectious diseases. Band 13, Nummer 1, Januar 2013, S. 77–88, doi:10.1016/S1473-3099(12)70275-X, PMID 23257233 (Review), PDF.
- R. A. Khammissa, R. Ballyram, Y. Jadwat, J. Fourie, J. Lemmer, L. Feller: Vitamin D Deficiency as It Relates to Oral Immunity and Chronic Periodontitis. In: International journal of dentistry. Band 2018, 2018, S. 7315797, doi:10.1155/2018/7315797, PMID 30364037, PMC 6188726 (freier Volltext) (Review).
- Jens Heidrich: Vitamin D messen - Wie bestimmt und interpretiert man den Serumspiegel richtig?, Deutsche Apotheker Zeitung, 2016, Nr. 11, S. 44, vom 17. März 2016.
- M. F. Luxwolda u. a.: Traditionally living populations in East Africa have a mean serum 25-hydroxyvitamin D concentration of 115 nmol/l. In: Br J Nutr. 23, Jan 2012, S. 1–5. PMID 22264449.
- Aloia u. a.: Vitamin D intake to attain a desired serum 25-hydroxyvitamin D concentration. In: Am J Clin Nutr. 87(6), 2008, S. 1952–1958. PMID 18541590
- Heaney u. a.: Functional indices of vitamin D status and ramifications of vitamin D deficiency. In: Clin Nutr. 80(6 suppl), 2004, S. 1706S-1709S. PMID 15585791.
- Michael F. Holick: Bioavailability of Vitamin D and its metabolites in black and white adults. In: New England Journal of Medicine. Band 369, Ausgabe 21 vom 21. November 2013, S. 2047–2048; doi:10.1056/NEJMe1312291.
- R. Vieth: Critique of the Considerations for Establishing the Tolerable Upper Intake Level for Vitamin D: Critical Need for Revision Upwards. In: J Nutr. Band 136, 2006, S. 1117–1122.
- L. Thomas (Hrsg.): Labor und Diagnose. TH-Books, 2005.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 30 f.
- Höchstmengenvorschläge für Vitamin D in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, abgerufen am 7. November 2021.
- Vitamin D nicht ohne Vitamin K? In: Arznei-Telegramm. 15. März 2019, abgerufen am 27. November 2020.
- Verwendung von Vitaminen in Lebensmitteln. (PDF; 1,3 MB) Bundesinstitut für Risikobewertung, 2004.
- D. A. Lawlor, A. K. Wills, A. Fraser, A. Sayers, W. D. Fraser, J. H. Tobias: Association of maternal vitamin D status during pregnancy with bone-mineral content in offspring: a prospective cohort study. In: The Lancet. Band 381, Nummer 9884, Juni 2013, S. 2176–2183, doi:10.1016/S0140-6736(12)62203-X, PMID 23518316, PMC 3691477 (freier Volltext).
- Zweifel an grundsätzlichen Vitamin-D-Gaben in der Schwangerschaft. In: Deutsches Ärzteblatt. 19. März 2013.
- S. N. Karras, H. Fakhoury, G. Muscogiuri, W. B. Grant, J. M. van den Ouweland, A. M. Colao, K. Kotsa: Maternal vitamin D levels during pregnancy and neonatal health: evidence to date and clinical implications. In: Therapeutic advances in musculoskeletal disease. Band 8, Nummer 4, August 2016, S. 124–135, doi:10.1177/1759720X16656810, PMID 27493691, PMC 4959630 (freier Volltext) (Review).
- E. K. Willits, Z. Wang, J. Jin, B. Patel, M. Motosue, A. Bhagia, J. Almasri, P. J. Erwin, S. Kumar, A. Y. Joshi: Vitamin D and food allergies in children: A systematic review and meta-analysis. In: Allergy and asthma proceedings. Band 38, Nummer 3, Mai 2017, S. 21–28, doi:10.2500/aap.2017.38.4043, PMID 28441981 (Review).
- R. M. Pacheco-González, L. García-Marcos, E. Morales: Prenatal vitamin D status and respiratory and allergic outcomes in childhood: A meta-analysis of observational studies. In: Pediatric allergy and immunology : official publication of the European Society of Pediatric Allergy and Immunology. Band 29, Nummer 3, 05 2018, S. 243–253, doi:10.1111/pai.12876, PMID 29444346 (Review).
- A. K. Heath, I. Y. Kim, A. M. Hodge, D. R. English, D. C. Muller: Vitamin D Status and Mortality: A Systematic Review of Observational Studies. In: International Journal of Environmental Research and Public Health. Band 16, Nummer 3, Januar 2019, S. , doi:10.3390/ijerph16030383, PMID 30700025, PMC 6388383 (freier Volltext) (Review).
- S. Pilz, M. Grübler, M. Gaksch, V. Schwetz, C. Trummer, B. Hartaigh, N. Verheyen, A. Tomaschitz, W. März: Vitamin D and Mortality. In: Anticancer Research. Band 36, Nummer 3, März 2016, S. 1379–1387, PMID 26977039 (freier Volltext) (Review).
- R. G, A. Gupta: Fortification of foods with vitamin D in India. In: Nutrients. Band 6, Nummer 9, September 2014, S. 3601–3623, doi:10.3390/nu6093601, PMID 25221975, PMC 4179178 (freier Volltext) (Review).
- Terry J. Aspray et al.: Randomized controlled trial of vitamin D supplementation in older people to optimize bone health. In: The American Journal of Clinical Nutrition. 8. Januar 2019, doi:10.1093/ajcn/nqy280.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - Gesundheitsinformation.de: Osteoporose vorbeugen, abgerufen am 26. März 2019.
- Wie sind die Deutschen mit Nährstoffen versorgt?. In: www.dge.de.
- Ausgewählte Fragen und Antworten zu Vitamin D Gemeinsame FAQ des BfR, der DGE und des MRI vom 22. Oktober 2012; abgerufen am 11. Dezember 2016.
- Vitamin-D-Bedarf bei fehlender endogener Synthese. Deutsche Gesellschaft für Ernährung, Januar 2012; abgerufen am 19. Juli 2012.
- Dietary Reference Intakes for Vitamin D and Calcium vom 30. November 2010, The Institute of Medicine of the National Academy of Sciences, abgerufen am 25. Juni 2020
- Paul J. Veugelers und John Paul Ekwaru: A Statistical Error in the Estimation of the Recommended Dietary Allowance for Vitamin D. In: Nutrients. Band 6, Nr. 10, Oktober 2014, S. 4472–4475, doi:10.3390/nu6104472, PMID 25333201, PMC 4210929 (freier Volltext).
- Dheeraj Shah und Piyush Gupta: Vitamin D Deficiency: Is The Pandemic for Real? In: Indian Journal of Community Medicine : Official Publication of Indian Association of Preventive & Social Medicine. Band 40, Nr. 4, 2015, S. 215–217, doi:10.4103/0970-0218.164378, PMID 26435592, PMC 4581139 (freier Volltext).
- Vitamin D - Fact Sheet for Health Professionals. In: National Institutes of Health. 9. Oktober 2020, abgerufen am 4. Januar 2021 (englisch).
- EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA): Scientific Opinion on the Tolerable Upper Intake Level of vitamin D. In: EFSA Journal. Band 10, Nr. 7, 2012, S. 2813, doi:10.2903/j.efsa.2012.2813.
- Office of Dietary Supplements - Vitamin D. (nih.gov [abgerufen am 3. Oktober 2018]).
- Patrick J. McCullough, Douglas S. Lehrer, Jeffrey Amend: Daily oral dosing of Vitamin D3 using 5000 TO 50,000 international units a day in long-term hospitalized patients: Insights from a seven year experience. In: The Journal of Steroid Biochemistry and Molecular Biology. 3. Januar 2019, doi:10.1016/j.jsbmb.2018.12.010, PMID 30611908.
- Sara Kaptein et al.: Life-threatening complications of vitamin D intoxication due to over-the-counter supplements. In: Clinical Toxicology (Philadelphia, Pa.). Band 48, Nr. 5, Juni 2010, S. 460–462, doi:10.3109/15563650.2010.486382, PMID 20515399.