Angeborene Immunantwort
Die angeborene Immunantwort ist neben der adaptiven Immunantwort eine mögliche Reaktion des Immunsystems in allen Organismen auf als fremd eingestufte Stoffe und Lebewesen. Im Unterschied zur adaptiven Antwort ist die Struktur der beteiligten Proteine im Genom festgelegt und kann daher nicht angepasst werden. Hierbei stehen eine Vielzahl von Zelltypen und löslichen Faktoren zur Verfügung, die jeder für sich schnell und effizient wirken können: Nur Minuten nach dem Eindringen werden die meisten Erreger erkannt und angegriffen, und bereits nach wenigen Stunden sind sie vollständig beseitigt. Die angeborene Immunantwort ist also weit mehr als nur die erste Schutzreaktion in Tieren; in der Regel ist sie allein schon wirksam genug, um den Großteil der Infektionen zuverlässig abzuwehren.

| Übergeordnet |
| Immunantwort Abwehr (Biologie) |
| Untergeordnet |
| Antwort auf Typ-I/III/γ-Interferon Komplementsystem NK-vermittelte Immunität Koagulation Melanisierung Pflanzl. Immunantwort Vireninduziertes Gen-Silencing |
| Gene Ontology |
|---|
| QuickGO |
Bestandteile der angeborenen Immunantwort in Tieren
Die Bestandteile des angeborenen Immunsystems sind
- Zellen, wie zum Beispiel Granulozyten oder natürliche Killerzellen (NK-Zellen). Sie sind in allen Organen zu finden.
- Proteine, die im Blutplasma zirkulieren und als Botenstoffe oder zur Abwehr von Krankheitserregern dienen.
Zelluläre Bestandteile
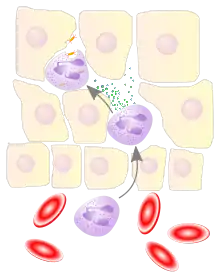
Die Zellen der angeborenen Immunantwort zirkulieren in den Blutgefäßen und kommen in den Geweben des Körpers vor. Dringt ein Krankheitserreger in den Körper ein, so können die Abwehrzellen ihn bekämpfen. Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können beispielsweise durch Aufnahme und Verdauung (Phagozytose) den Erreger selbst vernichten oder durch die Produktion von Immunmodulatoren und Zytokinen die Immunreaktion des Organismus steuern und andere Abwehrzellen zum Ort der Entzündung locken.
Granulozyten
Granulozyten (von lat. Granulum: Körnchen) machen den Großteil der weißen Blutkörperchen (Leukozyten) aus. Sie können die Blutbahn verlassen und ins Gewebe einwandern. Granulozyten haben in ihrem Zytoplasma zahlreiche Bläschen (Vesikel oder Granula genannt), die aggressive Stoffe enthalten, mit denen Krankheitserreger unschädlich gemacht werden können.
Makrophagen
Makrophagen (Riesenfresszellen) stellen ebenfalls einen Teil der Patrouille des Immunsystems dar. Makrophagen reifen aus Monozyten (einkernige weiße Blutkörperchen = mononukleäre Leukozyten) heran, die die Blutbahn verlassen. Makrophagen halten sich im Gewebe auf, dort erkennen und fressen (phagozytieren) sie eingedrungene Erreger. Können die Erreger nicht durch die Makrophagen allein bekämpft werden, so können Makrophagen die adaptive Immunabwehr aktivieren. Makrophagen spielen außerdem bei der Bekämpfung und Beseitigung von schädlichen Substanzen und Abfallprodukten (beispielsweise Teer aus Zigarettenrauch in der Lunge) eine entscheidende Rolle, weshalb sie gelegentlich auch als „Müllabfuhr des Körpers“ bezeichnet werden.
Natürliche Killerzellen
Die 1975 entdeckten Natürlichen Killerzellen (NK-Zellen) sind Teil der angeborenen Immunabwehr. NK-Zellen sind eine der ersten Verteidigungslinien im Kampf gegen Infektionen und Krebs, weil sie infizierte Zellen vernichten können, ohne vorher mit dem Krankheitserreger selbst in Kontakt gewesen zu sein. Sie verwenden dazu einen Mechanismus, der in den 1980er Jahren von dem schwedischen Immunologen Klas Kärre entdeckt wurde und als „Fehlendes Selbst“ (engl. missing self) bezeichnet wird: NK-Zellen erkennen unter anderem den MHC-I-Komplex, der auf nahezu allen gesunden Körperzellen vorkommt. Wird eine Zelle durch Viren infiziert oder wandelt sie sich in eine Tumorzelle um, so geht unter Umständen der MHC-I-Komplex auf der Oberfläche verloren. Das fein ausbalancierte Gleichgewicht von inhibierenden und aktivierenden Rezeptorsignalen wird dadurch zugunsten der NK-Zell-Aktivierung verschoben und die erkrankte Zelle fällt einer durch NK-Zellen ausgelösten Immunreaktion zum Opfer.
Humorale Bestandteile
Die humoralen Bestandteile des Immunsystems (von lat. humor „Flüssigkeit“) bezeichnen verschiedene Plasmaproteine, die passiv im Blut, bzw. der Gewebsflüssigkeit zirkulieren. Sie sind im Gegensatz zu den Abwehrzellen nicht in der Lage, aktiv an den Ort einer Infektion zu wandern.
Komplementsystem
Das Komplementsystem ist Teil der angeborenen Immunantwort, es besteht aus einer Gruppe von über 30 Plasmaproteinen mit ganz unterschiedlichen Eigenschaften. Ein Teil der zum Komplementsystem gehörenden Proteine sind zum Beispiel Proteasen, die sich an Mikroorganismen binden können und die Zellwände des Eindringlings schädigen, wodurch der Eindringling zerstört wird. Andere Proteine des Komplementsystems, die Anaphylatoxine, haben gefäßerweiternde Wirkung und fördern die Entzündungsreaktion. Viele Komplementfaktoren können außerdem Abwehrzellen zum Ort der Infektion locken und sind in der Lage, Fresszellen zu aktivieren, die die Eindringlinge dann verschlingen.
Interleukine
Die zu den Zytokinen gehörenden Interleukine sind körpereigene Botenstoffe, die von den Zellen des Immunsystems gebildet werden. Man kennt heutzutage bereits eine große Zahl von Interleukinen (IL-1 bis IL-35; Stand November 2009), die jeweils auf ganz unterschiedliche Abwehrzellen wirken – manche regen beispielsweise Leukozyten zu Wachstum, Reifung und Teilung an oder sorgen für deren Aktivierung.
Pflanzliche Immunantwort
Pflanzen haben weder ein adaptives Immunsystem, noch mobile Abwehrzellen. Ihre Immunantwort basiert auf der Immunantwort des jeweils angegriffenen Gewebes. Diese so genannte induzierte Abwehr findet innerhalb von Minuten statt. Darüber hinaus können Stresssignale eine so genannte hypersensitive Reaktion veranlassen: Dabei sterben beschleunigt Zellen ab, die die Infektionsstelle umgeben, so dass dem Pathogen mit dem Entzug von Nährstoffen keine Ausbreitungsmöglichkeit mehr gegeben wird.
Erkennung von Erregern
Erreger weisen eine Reihe von unveränderlichen Merkmalen auf, die sie eindeutig von den körpereigenen Zellen des infizierten Gewebes unterscheiden. Einige Bestandteile der Bakterienhülle (z. B. Lipopolysaccharide) oder bestimmte Strukturmerkmale von Nukleinsäuren (z. B. die doppelsträngige RNA mancher Viren) kommen im Tier oder der Pflanze nicht vor und können daher leicht als fremd erkannt werden. Diese Merkmale werden als pathogen-associated molecular patterns (PAMPs) bezeichnet. Immunzellen erkennen diese PAMPs durch eine Fülle von verschiedenartigen Membranrezeptoren, die unter dem Begriff Pattern-Recognition Receptors (PRRs) zusammengefasst werden. Eine im Immunsystem weit verbreitete Untergruppe dieser Rezeptoren sind die Toll-like Receptors (TLRs), die Strukturen von fast allen Erregertypen erkennen und daraufhin Signale auslösen, welche Immunzellen zur Produktion von Zytokinen und anderen Abwehrstoffen anregen.[1]
Unterstützung bei der Erkennung von Erregern erhalten Immunzellen durch verschiedene lösliche Faktoren. Eine wichtige Rolle spielt bei Tieren dabei das Komplementsystem, dessen Faktoren sich an fremdartige Oberflächen binden und somit eingedrungene Erreger markieren bzw. opsonisieren. Eine andere Form der Opsonisierung erfolgt durch so genannte „natürliche Antikörper“, die im Unterschied zu den Antikörpern der adaptiven Immunantwort schon vorbeugend in großer Menge gebildet werden. Diese Opsonisierungen erleichtern es den Immunzellen, die markierten Erreger mit Hilfe unterschiedlicher Rezeptoren zu erkennen und effizient zu phagozytieren.
Es wird angenommen, dass circa 90 Prozent aller Infektionen durch die angeborene Immunabwehr erkannt und erfolgreich bekämpft werden können. Im Laufe der stammesgeschichtlichen (phylogenetischen) Entwicklung von einfachen Lebewesen bis hin zu komplexen Organismen wurden diese Abwehrstrategien daher fast unverändert übernommen. So ergibt zum Beispiel ein Vergleich der Immunabwehr von Insekten mit dem angeborenen Teil der menschlichen Immunabwehr vielerlei Gemeinsamkeiten.[2]
Ablauf der angeborenen Immunantwort
So unterschiedlich die eingedrungenen Erreger sind, so variabel ist auch der Ablauf der angeborenen Immunantwort. Welche Zellen und Faktoren beteiligt sind, in welcher Reihenfolge sie eingreifen und welche letztlich für den Erfolg entscheidend sind, das alles hängt stark von Art und Ort der jeweiligen Infektion ab. Dringen etwa Bakterien in eine Hautwunde ein, sind es vor allem Makrophagen, die als erste mit ihnen in Berührung kommen und eine Abwehrreaktion einleiten. Zwei Vorgänge sind dabei entscheidend: Die Makrophagen beginnen sofort mit der Phagozytose und Vernichtung der Erreger, und zeitgleich setzen sie eine Fülle von Botenstoffen frei, die eine Aktivierung der umliegenden Zellen und den Einstrom weiterer Immunzellen auslösen. Zu diesen Botenstoffen gehört das Zytokin TNF-α, das eine Entzündungsreaktion im umliegenden Gewebe hervorruft und dabei eine Vielzahl von Zellen aktiviert. Dazu zählen auch die Endothelzellen, die das Innere der Blutgefäße auskleiden und unter normalen Bedingungen auch dicht versiegeln. In Gegenwart von TNF-α jedoch rücken sie voneinander ab, die Gefäßwand wird durchlässiger und erlaubt den Ausstrom von zahlreichen Blutfaktoren. Antikörper und Komplementproteine gelangen so ins Gewebe und opsonisieren die Erreger, die dadurch leichter von Makrophagen phagozytiert werden können.
Makrophagen und neutrophile Granulozyten enthalten das Inflammasom, einen Proteinkomplex, der durch Bestandteile von Bakterien oder durch Harnsäurekristalle stimuliert wird. Dadurch wird eine Serie von Reaktionen angestoßen, die letztendlich zur Aktivierung des proinflammatorischen Zytokins Interleukin-1β führen. Dieses wird von den Makrophagen abgesondert und löst die Entzündungsreaktion aus. Wurde das Inflammasom durch Bakterienbestandteile aktiviert, spielt die Entzündungsreaktion eine wichtige Rolle bei der Abwehr der Infektion. Wurde die Entzündung dagegen durch Harnsäure-Kristalle ausgelöst, kommt es zum Gichtanfall. Die angeborene Immunabwehr ist daneben auch in der Lage, körpereigene Zellen von fremden Strukturen zu unterscheiden. Hierfür verfügt praktisch jede Zelle im Körper über den so genannten Haupthistokompatibilitätskomplex (MHC), der quasi den „Mitgliedsausweis“ der Zelle darstellt. Körperfremde oder erkrankte Zellen, die nicht über den MHC verfügen, werden so zwangsläufig erkannt und unweigerlich das Ziel einer Abwehrreaktion.[3][4]
Weitere durch Makrophagen freigesetzte Botenstoffe sind Chemokine, eine Gruppe von Proteinen, die weitere Zellen aus dem Blut anlocken. Als erstes treffen Neutrophile ein, ebenfalls sehr potente Fresszellen, und unterstützen die Makrophagen bei der Beseitigung der Bakterien. Weiterhin wandern Monozyten ein, entwickeln sich vor Ort zu Makrophagen und erhöhen so zusätzlich die Anzahl der Fresszellen. Falls Bakterien in Gewebezellen eindringen, um so dem Angriff der Fresszellen zu entgehen, werden diese infizierten Zellen von NK-Zellen erkannt und abgetötet. Eine besondere Rolle spielen dendritische Zellen: Auch sie phagozytieren die Bakterien, präsentieren aber im Anschluss deren Bestandteile auf ihrer Zelloberfläche und ermöglichen so die Aktivierung von T-Zellen. Sollte also die angeborene Immunantwort eine Infektion nicht eigenständig abwehren können, wird auf diese Weise nahtlos die spezifische Immunantwort und somit die nächste Phase der Abwehr eingeleitet.
Einen Sonderfall der angeborenen Immunantwort bildet die Abwehr von Parasiten, an der im Wesentlichen Mastzellen, Eosinophile und Basophile beteiligt sind. Diese Zellen speichern toxische Substanzen in zahlreichen Granula, und auf ihrer Oberfläche finden sich Rezeptoren für Antikörper des IgE-Subtyps. Sie sind allerdings von der Vorarbeit des spezifischen Immunsystems abhängig, das einen Befall zuerst bemerkt und daraufhin spezifische IgE-Antikörper produziert, die an den Parasiten binden und ihn opsonisieren. Die Zellen erkennen nun den opsonisierten Parasiten und schütten in dessen unmittelbarer Nähe die toxischen Substanzen aus, die den Parasiten auf unterschiedliche Weisen schädigen und letztlich dessen Absterben herbeiführen.
Ein weiterer Prozess, der bei Infektionen vermittelt wird, ist die bei der Koagulation des Blutes in Gang kommende Freisetzung antimikrobieller Stoffe durch die Blutplättchen (beta-Lysin, Akute-Phase-Proteine). Nicht zuletzt wird bei Keimbefall außerdem Laktoferrin ausgeschüttet und durch Zurückhaltung von Eisen im RES ein künstlicher Eisenmangel herbeigeführt.
Im Allgemeinen reagiert die angeborene Immunantwort zwar äußerst schnell auf eine Infektion, sie verändert sich dabei aber nicht und wird nach einer erneuten Infektion mit demselben Erreger genauso wirksam – oder auch unwirksam – ablaufen wie beim ersten Mal. Ein „immunologisches Gedächtnis“, das eine wirksamere Reaktion auf einen erneuten Befall ermöglicht und auf dem die schützende Wirkung einer Impfung beruht, kann von der angeborenen Immunantwort nicht ausgebildet werden, sondern bleibt ein exklusives Merkmal der erworbenen Immunantwort, jedoch können einige Zellen des angeborenen Immunsystems trainiert werden und auf einen zweiten Stimulus stärker reagieren als auf den ersten.[5]
Literatur
- Diethard Gemsa, Joachim Robert Kalden, Klaus Resch: Immunologie. Begründet von Karl Otto Vorländer. Thieme 1991
- Christine Schütt, Barbara Bröker: Grundwissen Immunologie. 3. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2646-8.
- J. D. Jones, J. L. Dangl: The plant immune system. In: Nature. Band 444, Nummer 7117, November 2006, S. 323–329. doi:10.1038/nature05286. PMID 17108957. (Review)
- L. C. Van Loon: Plant Innate Immunity. Band 51 von Advances in Botanical Research Academic Press, 2009, ISBN 978-0-12-374834-8.
- P. Schopfer, A. Brennecke: Pflanzenphysiologie. Spektrum Akademischer Verlag, Heidelberg 2005, ISBN 3-8274-1561-6.
Einzelnachweise
- A. M. Armant, M. J. Fenton: Toll-like receptors: a family of pattern-recognition receptors in mammals. In: Genome Biol. Nr. 3(8), 2002, S. reviews3011.1–reviews3011.6. PMID 12186654
- C. Martinelli, J. M. Reichhart: Evolution and integration of innate immune systems from fruit flies to man: lessons and questions. In: J Endotoxin Res. Nr. 11(4), 2005, S. 243–248. PMID 16176662
- Joost P. H. Drenth, Jos W. M. van der Meer: The Inflammasome – A Linebacker of Innate Defense. In: New England Journal of Medicine. Nr. 355, 2006, S. 730–732. PMID 16914711
- Sanjeev Mariathasan, Denise M. Monack: Inflammasome adaptors and sensors: intracellular regulators of infection and inflammation. In: Nature Reviews Immunology. Nr. 7, 2007, S. 31–40. PMID 17186029
- Sadia Saeed,* Jessica Quintin,* Hindrik H. D. Kerstens,* NageshaA.Rao,* AliAghajanirefah,* Filomena Matarese, Shih-Chin Cheng, Jacqueline Ratter, KimBerentsen, Martijn A. van der Ent, Nilofar Sharifi, Eva M. Janssen-Megens, Menno TerHuurne, Amit Mandoli, Tom van Schaik, Aylwin Ng, Frances Burden, Kate Downes, Mattia Frontini, Vinod Kumar, Evangelos J. Giamarellos-Bourboulis, Willem H. Ouwehand, Jos W. M. van der Meer, Leo A. B. Joosten, Cisca Wijmenga, Joost H. A. Martens, Ramnik J. Xavier, Colin Logie, Mihai G. Netea, Hendrik G. Stunnenberg: Epigenetic programming of monocyte-to-macrophage differentiation and trained innate immunity. In: Science. Band 345, Nr. 6204, 26. September 2014, ISSN 0036-8075, S. 1251086, doi:10.1126/science.1251086, PMID 25258085, PMC 4242194 (freier Volltext).