Hirsche
Die Hirsche (Cervidae) oder Geweihträger sind eine Säugetierfamilie aus der Ordnung der Paarhufer (Artiodactyla). Die Familie umfasst mehr als 80 Arten, von denen unter anderem der Rothirsch, der Damhirsch, das Reh, das Ren und der Elch auch in Europa verbreitet sind. Darüber hinaus kommen Hirsche in Asien, Nord- und Südamerika und mit einem Vertreter in Afrika vor. Markantestes Kennzeichen der Hirsche sind die an Gestalt variantenreichen, meist nur von den Männchen getragenen Geweihe, die jährlich abgeworfen und neu gebildet werden. Die hauptsächliche Nahrung der Tiere besteht aus Pflanzen, wobei weiche und harte Pflanzenteile im unterschiedlichen Maß konsumiert werden. Reine Grasfresser wie bei den Hornträgern kommen bei den Hirschen aber nicht vor, was mit der Ausbildung des Geweihs zusammenhängt. Das Sozialverhalten der Tiere ist sehr unterschiedlich und reicht von einzelgängerischen Individuen bis zur Bildung großer, weit umherwandernder Herden. Die Fortpflanzungsphase ist von charakteristischen Dominanzkämpfen geprägt.
| Hirsche | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rothirsch (Cervus elaphus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cervidae | ||||||||||||
| Goldfuss, 1820 |
Die systematische Einteilung der Hirsche war und ist Gegenstand zahlreicher Debatten. Häufig wurde eine Aufteilung in mehrere Unterfamilien vorgeschlagen. Bereits in der zweiten Hälfte des 19. Jahrhunderts erkannte man, dass sich die Hirsche auf anatomischen Weg in zwei große Gruppen einteilen lassen, wovon eine mehr oder weniger auf Eurasien, die andere auf Amerika beschränkt ist. In jüngerer Zeit konnte durch molekulargenetische Analysen diese Zweiteilung untermauert werden. Die Stammesgeschichte der Hirsche reicht bis in das Untere Miozän vor rund 20 Millionen Jahren zurück. Die frühesten Formen unterschieden sich aber teilweise deutlich von den heutigen Arten und wechselten ihre Stirnwaffen höchstwahrscheinlich nicht in einem jährlichen Zyklus. Das heutige Erscheinungsbild und Verhalten bildete sich erst im weiteren Verlauf des Miozän heraus.
Merkmale
Allgemeines


Die Größe der Hirsche variiert erheblich: die Kopf-Rumpf-Länge schwankt zwischen 70 und 310 cm, die Schulterhöhe zwischen 30 und 190 cm und das Gewicht zwischen 5,5 und 770 kg. Der kleinste lebende Vertreter ist der Nordpudu (Pudu mephistophiles), der größte der Elch (Alces alces). Bei den meisten Arten mit Ausnahme des Muntjak (Muntiacus muntjak) herrscht ein Geschlechtsdimorphismus hinsichtlich der Größe vor. Dabei sind beim Tenasserim-Muntjak (Muntiacus feae) und beim Wasserreh (Hydropotes inermis) die Weibchen zumeist größer als die Männchen, bei allen anderen Vertretern wird das Männchen deutlich größer und schwerer als das Weibchen. Auch die Körperform ist variabel, innerhalb der Familie können zwei generelle Baupläne unterschieden werden. Der eine umfasst Tiere mit einem gedrungenen Körperbau, kurzem Nacken, gerundetem Rücken sowie kräftigen Hinterbeinen und weniger gut entwickelten Vorderbeinen. Hierbei handelt es sich um meist kleinere Vertreter wie die Pudus, die Muntjakhirsche oder die Spießhirsche, die noch an urtümliche Paarhufer erinnern und nur kurze, spießartige Geweihe besitzen. Es sind häufig Bewohner dichter Wälder oder von Landschaften mit üppiger Vegetation, in der sie sich schnell springend fortbewegen können. Daneben zeichnet sich der zweite Bauplan durch schlanke Tiere mit vergleichsweise langen Gliedmaßen und einem mehrfach gegliederten Geweih aus. Die Angehörigen bewohnen überwiegend offenere Landschaften und stellen gute Läufer dar. In beiden Bauplänen ist der Schwanz eher stummelartig kurz. Das Fell besitzt bei den Waldbewohnern überwiegend eine tarnende braune oder graue Färbung, bei einigen Arten offenerer Landschaften wie dem Prinz-Alfred-Hirsch (Rusa alfredi) oder dem Axishirsch (Axis axis) hat sich ein gepunktetes Fellkleid herausgebildet, ansonsten treten häufig Akzentuierungen des Kopfes und des Hinterteils auf. Der Kopf ist in der Regel langgestreckt, die Ohren sind groß und aufgerichtet. Darüber hinaus besitzen Hirsche drei Arten von Drüsen: Bei fast allen Vertretern sind Voraugendrüsen ausgebildet, zudem kommen außer bei den Muntjakhirschen Metatarsalbürsten an den Hinterbeinen vor. Die meisten Vertreter der Trughirsche verfügen zusätzlich auch über Interdigitaldrüsen.[1]
Geweih

Kennzeichnend für die Hirsche ist ihr Geweih, eine paarige Bildung, die am Stirnbein (Os frontale) aus zapfenförmigen Knochengebilden, „Rosenstöcke“ genannt, hervorwächst. Mit diesen ist das Geweih über eine knöcherne Verdickung, die sogenannte „Rose“, verbunden. Es besteht aus Knochensubstanz, den größten Anteil bildet dabei Hydroxylapatit, ein kristallisiertes Kalziumphosphat, das gut 30 % des Geweihs ausmacht.[2] Die Form des Geweihs hängt vom Alter und der Art ab; bei manchen Arten sind es einfache, spießförmige Gebilde, bei anderen weist es weitverzweigte oder schaufelförmige Formen mit zahlreichen Spitzen auf. Das größte Geweih heutiger Hirsche mit einem Gewicht von bis zu 35 kg besitzt der Elch. Vergleichbar den Langknochen formt bei den großen und komplexen Geweihen einiger Hirscharten eine kompakte Schicht mit lamellarem Aufbau den äußeren Mantel, während das Innere spongiös ist, allerdings fehlt eine Markröhre. Die spongiöse Beschaffenheit des Kerns erhöht die Elastizität der Struktur. Die Stangenspitzen und Sprossen bestehen allein aus kompakter Knochenmasse. Letzteres gilt auch für die einfachen und kleineren, wenig verzweigten Geweihe von verschiedenen Hirschvertretern wie den Muntjakhirschen.[3] Mit Ausnahme des Wasserrehs haben alle Hirscharten Geweihe. Doch ist es nur beim Ren (Rangifer tarandus) auch bei beiden Geschlechtern ausgebildet, ansonsten ist es ein exklusives Merkmal der Männchen. Bei diesen dient es dem Imponierverhalten und Kämpfen um das Paarungsvorrecht.[1]
Im Unterschied zu den Hörnern der Hornträger ist das Geweih keine permanente Bildung, sondern wird im jährlichen Zyklus erneuert. Die Bildung ist dabei an den Testosteronhaushalt der Männchen gekoppelt (beim Ren möglicherweise auch an das Estradiol, das in beiden Geschlechtern in größerer Menge produziert wird). Während der Wachstumsphase wird das Geweih von einer kurzbehaarten Haut, Bast genannt, überzogen, die reich an Arterien und Venen ist und die Struktur somit mit Blut und Nährstoffen versorgt. Abweichend von normaler Haut fehlen Schweißdrüsen und ähnliches.[3] Die Wachstumsrate des Geweihs ist dabei enorm und kann bei großen Hirschen wie dem Wapiti (Cervus canadensis) bei 2,8 cm täglich liegen oder beim Elch 417 g betragen,[2] womit das Geweih eines der am schnellsten wachsenden Organe innerhalb der Säugetiere darstellt. Allerdings ist die Ausbildung des Geweihes sehr kostenintensiv, da teilweise Mineralien aus dem Skelett mobilisiert werden müssen, was bei einigen Arten zu einer zeitweiligen Osteoporose führt. Sobald es seine volle Größe erreicht hat, trocknet die äußere Hautschicht durch Versiegen der Blutzufuhr ein und juckt, weswegen sie abgestreift oder gefegt wird. Zurück bleibt eine dunkle und weitgehend abgestorbene Knochenstruktur, die mit dem lebenden „Rosenstock“ verbunden ist und über mehrere Monate getragen wird.[1]

Das Geweih wird jedes Jahr nach der Paarungszeit abgeworfen und anschließend neu gebildet. Der Abwurf des Geweihs ist mit dem Absinken des Testosteronspiegels verbunden, wodurch kurzfristig Osteoklaste aktiviert werden, die den Knochen am Ende des „Rosenstocks“ (der „Rose“) auflösen. Die anschließende Verheilung der Wunde ist wohl der Auslöser des nächsten Geweihwachstums. Zwischen Abwurf und Neubildung liegt bei den meisten Hirschen ein zeitlicher Abstand von einem bis zwei Monaten, bei den Echten Hirschen kann dies unmittelbar aufeinander folgen. Bei Arten mit fester Paarungszeit fällt dieses Abwerfen in eine bestimmte Jahreszeit (beim Reh und beim männlichen Rentier in den Spätherbst, beim weiblichen Rentier und den anderen europäischen Arten in den Spätwinter oder Frühling); bei Arten in tropischen Regionen gibt es keinen festen Zeitpunkt hierfür. Die Bildung des Geweihs setzt bereits im juvenilen Stadium ein und beginnt bei den Trughirschen und den Muntjakhirschen im ersten Lebensjahr, bei den Echten Hirschen ab dem zweiten Lebensjahr. Dabei bilden sich zuerst kleinere Spieße, die komplexen Geweihstrukturen entstehen mit dem zunehmenden Lebensalter.[1] Der Prozess des periodischen Abwurfs und der Wiederausbildung des Geweihs war schon bei den frühesten Hirschen im Unteren Miozän ausgeprägt.[3]
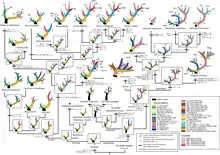
Phylogenetischen Analysen zufolge besaß der letzte gemeinsame Vorfahre der heutigen Hirsche ein zweigeteiltes Geweih mit der (unteren) Geweihstange und dem Augspross. Diese ursprüngliche Variante ist heute lediglich noch bei den Muntjakhirschen erhalten. Dreispitzige Geweihe entwickelten sich innerhalb der Echten Hirsche und der Trughirsche unabhängig voneinander. Dabei kam es auch zu einer vielfachen Umgestaltung. Innerhalb der Echten Hirsche entstand so auch das komplexe Geweih des Rothirschs (Cervus elaphus) und des Wapitis, das im Idealfall aus dem Augspross, dem Eisspross, dem Mittelspross und der Krone mit drei Enden besteht, die über den unteren und höheren Stangenabschnitt miteinander verbunden sind. Nahezu identisch findet sich dies beim Sikahirsch (Cervus nippon) wieder, der allerdings seinen Eisspross verlor. Der Damhirsch (Dama dama) bildete zusätzlich noch einen Leitspross aus sowie eine schaufelförmige Verbreiterung des höheren Stangenabschnitts. Die Barasinghas hingegen reduzierten den Eisspross und den höheren Stangenabschnitt, dafür entwickelten sich ein vertikaler und ein hinterer Stangenabschnitt mit zusätzlichen Sprossen. Bei den Leierhirschen und dem Davidshirsch (Elaphurus davidianus) wiederum fehlt der höhere Stangenabschnitt weitgehend, zusätzlich kommen aber mehrere kakuminale Sprossen und ein medialer Spross am unteren Stangenabschnitt vor, wie auch bei letzterer Art sich der Augspross vergrößerte und in zwei Enden aufteilte. Eine etwas andere Entwicklung nahm das Geweih innerhalb der Trughirsche, dessen ursprünglichste Form sich noch beim Reh (Capreolus capreolus) findet. Der komplexe höhere Stangenabschnitt fehlt, dafür setzte sich ein Stirnspross ab. Andere Formen besitzen anstatt des höheren einen sekundär ausgebildeten oberen Stangenabschnitt mit zusätzlichen Sprossen wie dem Rückspross und den Endsprossen, etwa beim Ren oder den Vertretern der Echten Trughirsche. Der Elch hingegen weist keinen Aug- und Frontalspross auf, dafür aber überdimensionierte Endsprossen. Lediglich das Wasserreh verlor das komplette Geweih.[4]
Skelettmerkmale
_skeleton_at_the_Royal_Veterinary_College_anatomy_museum.JPG.webp)
.jpg.webp)
Der Schädel besitzt allgemein einen langschmalen Bau mit langgestrecktem Rostrum. Der Tränen-Nasen-Gang (Ductus nasolacrimalis) ist gegabelt, am Vorderrand der Augenhöhle (Orbita) liegen zwei Tränenlöcher (Foramina lacrimalia). Die oberen Schneidezähne fehlen stets, im Unterkiefer sind pro Kieferhälfte drei vorhanden. Der obere Eckzahn ist bei Arten mit fehlendem oder kleinem Geweih (Wasserrehe, Muntjaks) vergrößert und ragt hauerartig aus dem Maul, bei den übrigen Arten ist er verkleinert oder fehlt ganz. Der untere Eckzahn ähnelt den Schneidezähnen und bildet mit diesen eine geschlossene Reihe. Pro Kieferhälfte sind drei Prämolaren und drei Molaren vorhanden, die eher niederkronig sind (brachyodont). Auf der Kauoberfläche ist hier ein mondsichelartiges, längsverlaufendes Schmelzmuster ausgebildet (selenodont). Insgesamt ergibt sich folgende Zahnformel: , es sind also 32 bis 34 Zähne ausgebildet. Der Unterkiefer ist sehr kräftig und besitzt einen breiten Winkelfortsatz als Ansatzstelle für die Kaumuskulatur.[1][5]
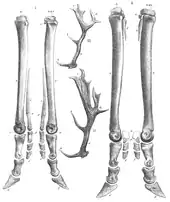
Wie bei allen Paarhufern liegt die Mittelachse des Fußes zwischen den Strahlen III und IV, die vergrößert sind und als einzige den Boden berühren, die Tiere stehen also auf den Zehen 3 und 4. Die jeweils entsprechenden dritten und vierten Mittelhand- und Mittelfußknochen sind zum so genannten Kanonenbein verwachsen. Die erste Zehe fehlt völlig, die zweite und fünfte Zehe sind stark verkleinert und berühren den Boden nicht mehr. Der Grad der Reduktion der zweiten und fünften Zehen am Vorderfuß ist ein wichtiges Kriterium zur Unterscheidung der beiden großen Entwicklungslinien: Cervinae (Echte Hirsche und Muntjakhirsche) sind „Plesiometacarpalia“ (von griechisch πλησίον (plesion) = „nahe“ und μετακάρπιον (metakarpion) = „Mittelhand“), das heißt, dass die proximalen (der Körpermitte nahen) Teile der 2. und 5. Metacarpalia (Mittelhandknochen) vorhanden sind, die jeweiligen drei Fingerglieder sind ebenfalls ausgebildet, werden von den Mittelhandknochen aber durch eine große Lücke getrennt. Dagegen stellen die Trughirsche (Capreolinae; Eigentliche Trughirsche, Rehe und der Elch) „Telemetacarpalia“ (von griechisch τήλε (tele) = „fern“ und μετακάρπιον (metakarpion) = „Mittelhand“) dar, das heißt, dass nur die distalen (von der Körpermitte entfernten) Bereiche der Metacarpalia ausgebildet sind, die zugehörigen Fingerglieder artikulieren direkt mit den Mittelhandknochen.[6] Form und Spreizbarkeit der Hufe sind abhängig von der bewohnten Landschaft und reichen von weiter auseinanderstehenden Hufen bei Bewohnern feuchter bis sumpfiger Biotope bis hin zu breiten bei solchen in schneereichen Gebieten.[1]
Verbreitung und Lebensraum
.jpg.webp)
Das natürliche Verbreitungsgebiet der Hirsche umfasst weite Teile Eurasiens und Amerikas, ihre höchste Vielfalt erreichen sie in Südamerika und Südostasien. In Afrika kommen sie nur im nordwestlichen Teil vor, in den Gebieten südlich der Sahara fehlen sie und werden dort durch die Hornträger ersetzt. Vom Menschen wurden Hirsche in einigen Regionen eingeführt, in denen sie nicht heimisch waren, darunter in Australien, Neuseeland, Neuguinea und auf einigen Karibischen Inseln. Hirsche bewohnen eine Vielzahl von Lebensräumen. Der Großteil der Arten bevorzugt geschlossene Wälder, offenere Waldlandschaften und Waldränder. Dabei sind einige Formen, etwa die Muntjakhirsche oder die Spießhirsche, generell in dichter Vegetation anzutreffen, andere wiederum zeigen ein eher plastisches Verhalten und treten zumeist in Waldrandlagen mit Übergang zu offeneren Landschaften auf. Nur wenige Vertreter wie das Ren oder der Pampashirsch (Ozotoceros bezoarticus) passten sich direkt an Offenlande an, darüber hinaus leben unter anderem der Sumpfhirsch (Blastocerus dichotomus) und das Wasserreh in Sumpf- oder Marschgebieten. Die Hirsche haben dabei sowohl Tiefländer als auch Hochlandlagen bis 5100 m erschlossen und bewohnen tropische Klimate ebenso wie die arktische Tundra.[1][5]
Lebensweise
Territorial- und Sozialverhalten

Hirsche sind standorttreu oder wandern regelmäßig. Strikt waldbewohnende Arten wie die Pudus, Mazamas oder der Schopfhirsch sind Einzelgänger und leben meist versteckt im Walddickicht. Fressfeinden entgehen sie durch schnelle Flucht mit weiten Sprüngen, was ihre oft stärkeren Hinterbeine ermöglichen. Die Tiere leben in Aktionsräumen, die beim Südpudu (Pudu puda) zwischen 15 und 20 ha, beim Großmazama (Mazama americana) oder beim Chinesischen Muntjak (Muntiacus reevesi) bis zu 100 ha groß sein können. Die Reviere werden teils territorial verteidigt, zur Kommunikation mit Artgenossen und zur Markierung der Grenzen der Territorien kommen Sekrete der Drüsen am Kopf sowie an den Füßen und auch Urin zum Einsatz, die Lautverständigung ist meist minimiert. Die Territorialität kann bei schlechten Nahrungsbedingungen auch eingeschränkt sein und ist dann auf Dominanz reduziert. Paarbildungen treten nur während der Paarungszeit auf oder finden sich in Mutter-Jungtier-Gruppen. Bei einigen Arten gibt es auch eine nur zeitweilige Territorialität, die sich auf die Fortpflanzungsphase beschränkt, etwa beim Reh (Capreolus capreolus).[1]

Ein Großteil der Arten lebt jedoch in Gruppen, deren Größe nach Art und Lebensraum variieren kann. Bei Gruppenbildungen kommen sowohl Herden aus Weibchen mit ihren Jungtieren und Junggesellengruppen jungadulter Männchen vor, gemischte Verbände entstehen in der Regel nur während der Paarungszeit. Die Wanderungen werden überwiegend durch die Suche nach den besten Nahrungsquellen ausgelöst. In den eher tropischen Regionen sind die Wanderungen generell kurz und finden überwiegend in Offenlandschaften statt, wo die Tiere während der Trockenzeit frischen Nahrungsbestand suchen oder Überschwemmungsgebiete verlassen. In Bergregionen kommt es häufig zu einem jahreszeitlich bedingten Höhenwechsel, der meist nur wenige Kilometer umfasst. Daneben gibt es aber vor allem in den gemäßigten und kühlen Klimazonen auch echte Migrationen, bei denen weite Distanzen zurückgelegt werden. Das Sibirische Reh (Capreolus pygargus) etwa vollführt Wanderungsbewegungen von bis zu 500 km im Jahresverlauf. Am spektakulärsten sind die des Rens (Rangifer taranduss), das Herdenverbände mit bis zu 500.000 Individuen bilden und innerhalb eines Jahrs rund 5000 km in den Tundrenregionen durchstreifen kann, wobei täglich 20 bis 50 km überwunden werden. Inwiefern Tiere sesshaft sind oder umherwandern ist abhängig von den äußeren Bedingungen. Rentiere in Waldregionen wandern seltener als solche der Tundra. Beim Wapiti (Cervus canadensis) gibt es sowohl standorttreue als auch migratorische Tiere. Wanderer sind dabei zwar einer höheren Mortalität ausgesetzt, erschließen aber oft die besseren Weidegründe.[1]
Ernährung

.jpg.webp)
Hirsche sind allgemein Pflanzenfresser, die Nahrungsaufnahme nimmt einen großen Teil des Tagespensums in Anspruch. Die Tiere fressen phasenweise, wobei ein Tag je nach Größe des Magens zwischen fünf und elf Fressphasen aufweist. Dazwischen befinden sich ausgedehnte Ruhezeiten, in der die Nahrung verdaut und wiedergekäut wird. Die Tiere ernähren sich von unterschiedlichen Pflanzenteilen wie Blättern, Rinde, Knospen und Zweigen, aber auch von Früchten und seltener von Gräsern. Sie sind sehr anpassungsfähig, im Vergleich zu den Hornträgern bevorzugen sie aber generell eher weichere Pflanzennahrung, was auch durch die durchschnittlich niedrigeren Zahnkronen und somit eher brachyodonten Zähne angezeigt wird. Dadurch gibt es innerhalb der Hirsche keine wirklichen Grasfresser wie bei den Hornträgern, wodurch kein Vertreter an extrem trockene Landschaften angepasst ist. Eine rein grasfressende Ernährungsweise ist auch mit der Geweihbildung nicht vereinbar, da Gräser sehr energiearm sind und zu wenige Mineralien enthalten, die für den Aufbau der vor allem größeren und schwereren Geweihe unabdingbar sind. Die Bewohner geschlossener Wälder mit noch relativ urtümlichen Körperbau wie die Muntjaks, Pudus und Rehe ernähren sich hauptsächlich von Blättern (browser), einige der Mazamaarten stellen Früchtefresser dar, wie es auch für die frühesten Formen der Hirsche und ihrer Vorfahren teilweise nachgewiesen ist. Der Anteil der Früchte kann dabei zwei Drittel der aufgenommenen Nahrungsmenge überschreiten. Die Blattfresser sind dabei eher opportunistisch und vertilgen eine große Vielfalt an Pflanzen, in der Regel aber nur die am leichtesten verdaulichen Pflanzenteile. Auf der anderen Seite stehen die Zackenhirsche, das Ren oder einige Edelhirsche wie der Wapiti und der Weißlippenhirsch, die zu einer grasfressenden Lebensweise tendieren (grazer). Allerdings nehmen auch diese zu einem gewissen Teil weichere Nahrung wie Wasserpflanzen, Kräuter oder Flechten zu sich. Der überwiegende Teil der Arten frisst eine gemischte Pflanzennahrung (mixed feeder) und kann so je nach Gegebenheit und teilweise jahreszeitlicher Verfügbarkeit weiche und harte Pflanzen verspeisen.[1]
Zahlreiche Vertreter nehmen darüber hinaus auch tierische Nahrung zu sich, etwa Krustentiere, Vögel oder Fische. Des Weiteren ist das Benagen von Knochen oder auch Geweihresten bekannt, was häufig bei männlichen Tieren beobachtet werden kann. Das Verhalten trägt zum Ausgleich oder zur Erhöhung des Mineralhaushaltes während des Geweihwachstums bei und kann auch die manchmal damit einhergehende Osteoporose abmildern oder unterdrücken.[2] Vor allem in temperierten und kalten Klimaten verbreitete Arten weisen einen jährlich ablaufenden Zyklus in der Nahrungsaufnahme auf, der unterschiedliche Mengen und Zusammensetzung beinhaltet. Dieser jährliche Zyklus beginnt im Frühjahr bei den Weibchen mit dem Ende der Tragzeit und dem Einsetzen der Milchproduktion für den Nachwuchs, was hohe Futtermengen erfordert. Männchen fressen sich in dieser Zeit einen hohen Anteil an Fett an, den sie im Herbst während der Brunftphase verbrauchen, in deren Verlauf sie kaum Nahrung zu sich nehmen. Im Winter konsumieren die Tiere allgemein eine geringere Nahrungsmenge, was mit einem Rückgang der Stoffwechselrate einhergeht und Energie spart für die Aufrechthaltung der Körpertemperatur.[1]
Fortpflanzung

Die Paarungszeiten der einzelnen Hirscharten, allgemein als Brunft bezeichnet, variieren je nach geographischer Region. In tropischen Landschaften kann die Fortpflanzung das ganze Jahr über erfolgen, in den gemäßigten Regionen findet diese meist im Herbst oder Winter statt und ist somit jahreszeitlich gebunden. Der Sexualzyklus variiert von 11 Tagen bei den Pudus bis zu 29 Tagen beim Axishirsch. Die weiblichen Tiere sind meist nur kurze Zeit empfangsbereit, die etwa 12 bis 24 Stunden dauert. Als zumeist polyöstrische Tiere findet der Eisprung zyklisch statt, bis die Befruchtung erfolgt. Eine Ausnahme bildet das Reh, bei dem die Paarung im Sommer (Juli/August) stattfindet, während der die Weibchen maximal 36 Stunden empfangsbereit sind; dabei unternehmen diese häufig ausschweifende Wanderungen weit ab von ihren Aktionsräumen, um die Möglichkeit der Paarung zu erhöhen. Die Tragzeit beträgt bei den Hirschen üblicherweise sechs bis neun Monate, auch hier stellt das Reh eine Ausnahme dar, da durch eine Keimruhe das Austragen des Nachwuchses auf zehn Monate verlängert wird. Die Wurfgröße liegt meist bei einem Jungen, nur bei den Trughirschen kommen zwei bis maximal fünf Jungtiere zur Welt. Diese sind Nestflüchter und tragen in der Regel ein geflecktes Fellkleid. Bei fast allen Hirscharten verstecken sich die Jungen anfangs in Dickicht (Ablieger).[7] Die Aufzucht wird meist vom Muttertier übernommen.[1]

Die Männchen kleinerer Arten sind nur selten polygyn. Während der Fortpflanzungsphase bilden sie mit einem oder zwei Weibchen temporäre Paare, die nur zwei oder drei Tage zusammenbleiben. Bei stark polygynen Arten gibt es verschiedene Fortpflanzungsstrategien. So dringen die Männchen in die Territorien der Weibchen ein und machen in Form von Markierungen mit Duftsekreten oder starken Vokalisierungen mit sich wiederholenden lauten Brunftschreien auf sich aufmerksam. Andere bilden Harems und verteidigen diese gegen Konkurrenten („Platzhirsch“), führen Dominanzkämpfe in gemischten Gruppen oder kämpfen auf Balzplätzen um das Paarungsvorrecht. Dabei können innerhalb einer Art unterschiedliche Strategien vorkommen, etwa beim Damhirsch oder beim Rothirsch, die ihr Verhalten der gegebenen Situation anpassen und befähigt sind, ihr Muster innerhalb eines Tages zu variieren. Die Kämpfe der Männchen werden mit den hauerartigen Eckzähnen oder dem Geweih ausgetragen. Sie sind ritualisiert und folgen einer vorgegebenen Choreographie, die bei geweihtragenden Tieren das Absenken des Kopfes mit anschließendem Verhaken der Geweihe und gegenseitigem Umkreisen beinhaltet. Beim Sambar sind auch Kollisionskämpfe ähnlich den Steinböcken bekannt. In der Regel vermeiden die Tiere schwere Verletzungen, diese können aber durchaus auftreten. In stark dimorphen Arten ist das Paarungsrecht durch die Kämpfe meist den größeren und stärkeren Männchen vorbehalten, beim Damhirsch decken so 3 % der Männchen durchschnittlich drei Viertel der empfangsbereiten Weibchen.[1]
Systematik
Äußere Systematik
| Innere Systematik der rezenten Cetartiodactyla nach Zurano et al. 2019[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Die Hirsche sind eine der sechs lebenden Familien der Unterordnung der Wiederkäuer (Ruminantia) innerhalb der Ordnung der Paarhufer (Artiodactyla). Innerhalb der Wiederkäuer wiederum bilden die Hirsche zusammen mit den Hornträgern (Bovidae), den Giraffenartigen (Giraffidae), den Moschustieren (Moschidae) und den Gabelhornträgern (Antilocapridae) das übergeordnete Taxon der Stirnwaffenträger (Pecora), denen die Hirschferkel (Tragulidae) als Schwestergruppe gegenüber stehen. Lange Zeit galten die Moschustiere als eng verwandt mit den Hirschen und wurden teilweise als Unterfamilie in diese integriert.[9] Aus molekulargenetischer Sicht bilden sie aber eine eigenständige Gruppe, wobei noch unklar ist, ob sie näher mit den Hornträgern[10][11] oder mit den Hirschen verwandt sind,[12][13] Erstere Variante scheint momentan die wahrscheinlichere.[14] Teilweise galten auch die Gabelhornträger mit dem Gabelbock (Antilocapra) aufgrund des Aufbaus des Tränenbeins als den Hirschen sehr nahestehend und wurden mit diesen zur Überfamilie der Cervoidea (Hirschartigen) zusammengefasst.[15] Dem widersprechen jedoch die molekulargenetischen Untersuchungen, die die Gabelhornträger eher an die Basis der Stirnwaffenträger einordnen.[13][11]
Innere Systematik
Das gemeinsame Merkmal aller Hirsche ist das Fehlen der Gallenblase und die Ausbildung eines Geweihs, das jährlich erneuert wird. Sie werden heute in zwei Unterfamilien mit insgesamt fünf Triben unterteilt, die sich unter anderem in der Anordnung der reduzierten Zehen (siehe oben), im Geweih und in Details des Schädelbaues unterscheiden. Die Unterfamilie der Cervinae umfasst dabei die Cervini (Echte Hirsche) und die Muntiacini (Muntjakhirsche), beide Gruppen sind durch die „plesiometacarpale“ Zehenstellung charakterisiert. Die zweite Unterfamilie, die Capreolinae, setzt sich aus den Capreolini, den Alceini den Rangiferini und den Odocoileini (Eigentliche Trughirsche) zusammen und entspricht der „Telemetacarpalia“-Gruppe. Die Alceini und die Odocoileini eint wiederum das Vorhandensein von Interdigitaldrüsen (Drüsen zwischen den Zehen), während die Odocoileini, häufig auch als Neocervines bezeichnet, dadurch gekennzeichnet sind, dass das Pflugscharbein vollständig in die Nasenscheidewand eingegliedert ist und so die Choane, den hinteren Abschnitt der Nasenöffnung, senkrecht teilt. Traditionell wurde das geweihlose Wasserreh (Hydropotes inermis) als urtümlichster Vertreter den anderen Hirschen gegenübergestellt. Molekulargenetische Untersuchungen ergeben aber eine nahe Verwandtschaft mit den Rehen (Capreolus), eine Ausgliederung aus den Trughirschen würde diese paraphyletisch erscheinen lassen. Demnach könnte das Fehlen des Geweihs beim Wasserreh möglicherweise kein ursprüngliches, sondern ein abgeleitetes Merkmal sein. Ähnliches gilt für die Muntjakhirsche, bei denen die genetischen Daten für eine enge Beziehung mit den Echten Hirschen sprechen.[16][15][17] Die Aufspaltung der Hirsche in die beiden Unterfamilien erfolgte laut molekulargenetischen Studien erst im Oberen Miozän vor rund 9 Millionen Jahren, eine rapide Radiation der einzelnen Linien ist daher für das ausgehende Miozän und das Pliozän anzunehmen.[17][11]
Überblick über die Gattungen und Arten der Hirsche
Innere Systematik der Cervidae nach Heckeberg 2020 (mtDNA und Kern-DNA kombiniert)[18]
| Cervidae |
| ||||||
| Cervinae |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Capreolinae |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bei einem rein mitochondrialen Kladogramm treten folgende Unterschiede auf:
- die Position des Elchs ist basal innerhalb der Capreolinae
- die Position des Nordpudus ist basal innerhalb der Blastocerina.
Der folgende Überblick basiert weitgehend auf den Arbeiten von Colin Peter Groves und Peter Grubb 2011 und auf S. Mattioli 2011,[1][19] bezieht aber auch einzelne neuere Arbeiten mit ein.[20] Die Einteilung oberhalb der Gattungsebene wurde im Jahr 2006 von Gilbert et al. vorgeschlagen:[17]
- Familie Cervidae Goldfuss, 1820
- Unterfamilie Cervinae Goldfuss, 1820
- Tribus Muntiacini Knottnerus-Meyer, 1907 (Muntjakhirsche)
- Gattung Elaphodus Milne-Edwards, 1872
- Schopfhirsch (Elaphodus cephalophus Milne-Edwards, 1872)
- Gattung Muntjaks (Muntiacus Rafinesque, 1815)
- Borneo-Muntjak (Muntiacus atherodes Groves & Grubb, 1982)
- Zentralindischer Muntjak (Muntiacus aureus (C. H. Smith, 1826))
- Schwarzer Muntjak (Muntiacus crinifrons (Sclater, 1885))
- Tenasserim-Muntjak (Muntiacus feae (Thomas & Doria, 1889))
- Gongshan-Muntjak (Muntiacus gongshanensis Ma, 1990)
- Malabar-Muntjak (Muntiacus malabaricus Lydekker, 1915)
- Sumatra-Muntjak (Muntiacus montanus Robinson & Kloss, 1918)
- Indischer Muntjak oder Muntjak (Muntiacus muntjak (Zimmermann, 1780))
- Schwarzfuß-Muntjak oder Hainan-Muntjak (Muntiacus nigripes G. M. Allen, 1930)
- Vietnam-Muntjak (Muntiacus puhoatensis Trai, 1997)
- Burma-Muntjak (Muntiacus putaoensis Amato, Egan & Rabinowitz, 1999)
- Chinesischer Muntjak (Muntiacus reevesi (Ogilby, 1839))
 Chinesischer Muntjak (Muntiacus reevesi)
Chinesischer Muntjak (Muntiacus reevesi) - Roosevelt-Muntjak (Muntiacus rooseveltorum Osgood, 1932)
- Annam-Muntjak (Muntiacus truongsonensis (Giao, Tuoc, Dung, Wikramanayake, Amato, Arctander & Mackinnon, 1997))
- Nordindischer Muntjak (Muntiacus vaginalis (Boddaert, 1785))
- Riesenmuntjak (Muntiacus vuquangensis (Do Tuoc, Vu Van Dung, Dawson, Arctander & Mackinnon, 1994))
- Tribus Cervini Goldfuss, 1820 (Echte Hirsche)
- Gattung Axishirsche oder Fleckenhirsche (Axis C. H. Smith, 1827)
- Hinterindischer Schweinshirsch (Axis annamiticus (Heude, 1888))
- Axishirsch oder Chital (Axis axis (Erxleben, 1777))
- Calamian-Hirsch oder Calamian-Schweinshirsch (Axis calamianensis (Heude, 1888))
- Bawean-Hirsch oder Bawean-Schweinshirsch (Axis kuhlii (Temminck, 1836))
- Schweinshirsch (Axis porcinus (Zimmermann, 1780))
- Gattung Damhirsche (Dama Frisch, 1775)
- Damhirsch (Dama dama (Linnaeus, 1758))
 Damhirsch (Dama dama)
Damhirsch (Dama dama) - Mesopotamien-Damhirsch (Dama mesopotamica (Brooke, 1875))
- Damhirsch (Dama dama (Linnaeus, 1758))
- Gattung Elaphurus Milne-Edwards, 1866
- Davidshirsch (Elaphurus davidianus Milne-Edwards, 1866)
- Gattung Barasinghas oder Zackenhirsche (Rucervus Hodgson, 1838)
- Hochland-Barasingha oder Mittelindischer Barasingha (Rucervus branderi Pocock, 1943)
 Hochland-Barasingha (Rucervus branderi)
Hochland-Barasingha (Rucervus branderi) - Tiefland-Barasingha oder Nordindischer Barasingha (Rucervus duvaucelii (G. Cuvier, 1823))
- Assam-Barasingha (Rucervus ranjitsinhi (Groves, 1982))
- † Schomburgk-Hirsch (Rucervus schomburgki (Blyth, 1863))
- Hochland-Barasingha oder Mittelindischer Barasingha (Rucervus branderi Pocock, 1943)
- Gattung Leierhirsche (Panolia Gray, 1843)
- Manipur-Leierhirsch (Panolia eldii (McClelland, 1842); auch Rucervus eldii)
- Thailand-Leierhirsch oder Siam-Leierhirsch (Panolia siamensis (Lydekker, 1915); auch Rucervus siamensis)
- Myanmar-Leierhirsch oder Birma-Leierhirsch (Panolia thamin (Thomas, 1918); auch Rucervus thamin)
- Gattung Edelhirsche oder Rothirsche (Cervus Linnaeus, 1758)
- Alashan-Wapiti (Cervus alashanicus Bobrinskii & Flerov, 1935)
- Weißlippenhirsch (Cervus albirostris Przewalski, 1883; auch Przewalskium albirostris)
- Prinz-Alfred-Hirsch (Cervus alfredi Sclater, 1870; auch Rusa alfredi)
- Nordhonshu-Sikahirsch (Cervus aplodontus (Heude, 1884))
- Mindoro-Sambar (Cervus barandanus (Heude, 1888); auch Rusa barandana)
- Wapiti (Cervus canadensis Erxleben, 1777)
 Wapiti (Cervus canadensis)
Wapiti (Cervus canadensis) - Korsischer Rothirsch oder Tyrrhenischer Rothirsch (Cervus corsicanus Erxleben, 1777)
- Rothirsch oder Westeuropäischer Rothirsch (Cervus elaphus Linnaeus, 1758)
- Sumatra-Sambar (Cervus equinus G. Cuvier, 1823; auch Rusa equina)
- China-Rothirsch (Cervus hanglu Wagner, 1844)
- Dybowski-Hirsch (Cervus hortulorum Swinhoe, 1864)
- Szetschuan-Hirsch (Cervus macneilli Lydekker, 1909)
- Kaukasushirsch oder Kaukasusmaral (Cervus maral Gray, 1850)
- Philippinenhirsch (Cervus mariannus Desmarest, 1822; auch Rusa marianna)
- Mindanao-Sambar (Cervus nigellus (Hollister, 1913); auch Rusa nigella)
- Sikahirsch oder Japanischer Sikahirsch (Cervus nippon Temminck, 1838)
- Osteuropäischer Rothirsch (Cervus pannoniensis Banwell, 1997)
- Vietnamesischer Sikahirsch (Cervus pseudaxis Gervais, 1841)
- Tsushima-Hirsch (Cervus pulchellus Imaizumi, 1970)
- Sichuan-Sikahirsch (Cervus sichuanicus Guo, Chen & Wang, 1978)
- Taiwan-Sikahirsch (Cervus taiouanus Blyth, 1860)
- Mähnenhirsch (Cervus timorensis de Blainville, 1822; auch Rusa timorensis)
- Sambar (Cervus unicolor Kerr, 1792; auch Rusa unicolor)
 Sambar (Cervus unicolor)
Sambar (Cervus unicolor) - Tibetischer Rothirsch oder Schou (Cervus wallichii G. Cuvier, 1823)
- Isubrahirsch (Cervus xanthopygus Milne-Edwards, 1867)
- Unterfamilie Capreolinae Brookes, 1828 (häufig auch Odocoileinae; Trughirsche)
- Tribus Capreolini Brookes, 1828
- Gattung Hydropotes Swinhoe, 1870
- Wasserreh oder Chinesisches Wasserreh (Hydropotes inermis Swinhoe, 1870)
- Gattung Rehe (Capreolus Gray, 1821)
- Reh (Capreolus capreolus (Linnaeus, 1758))
- Sibirisches Reh (Capreolus pygargus (Pallas, 1771))
 Sibirisches Reh (Capreolus pygargus)
Sibirisches Reh (Capreolus pygargus)
- Tribus Alceini Brookes, 1828
- Gattung Elche (Alces Gray, 1821)
- Europäischer Elch oder Eurasischer Elch (Alces alces (Linnaeus, 1758))
- Amerikanischer Elch oder Ostamerikanischer Elch (Alces americanus (Clinton, 1822))
- Tribus Rangiferini Brookes, 1828
- Gattung Rangifer C. H. Smith, 1827
- Ren oder Rentier (Rangifer tarandus (Linnaeus, 1758))
- Tribus Odocoileini Pocock, 1923 (Eigentliche Trughirsche)
- Gattung Amerikahirsche (Odocoileus Rafinesque, 1832)
- Maultierhirsch (Odocoileus hemionus (Rafinesque, 1817))
- Weißwedelhirsch (Odocoileus virginianus (Zimmermann, 1780))
- Gattung Blastocerus Wagner, 1844
- Sumpfhirsch (Blastocerus dichotomus (Illiger, 1815))
 Sumpfhirsch (Blastocerus dichotomus)
Sumpfhirsch (Blastocerus dichotomus)
- Sumpfhirsch (Blastocerus dichotomus (Illiger, 1815))
- Gattung Ozotoceros Ameghino, 1891
- Pampashirsch (Ozotoceros bezoarticus (Linnaeus, 1758))
- Gattung Andenhirsche (Hippocamelus Leuckart, 1816)
- Nördlicher Andenhirsch (Hippocamelus antisensis (d’Orbigny, 1834))
- Südlicher Andenhirsch (Hippocamelus bisulcus (Molina, 1782))
- Gattung Pudus (Pudu Gray, 1852)
- Gattung Spießhirsche (Mazama Rafinesque, 1817)
- Großmazama (Mazama americana (Erxleben, 1777))
- Nördlicher Zwergmazama oder Merioa-Mazama (Mazama bricenii Thomas, 1908)
- Südlicher Zwergmazama oder Kleinstmazama (Mazama chunyi Hershkovitz, 1959)
- Graumazama (Mazama gouazoubira (Fischer, 1814))
- Küstenwald-Mazama (Mazama jucunda Thomas, 1913)
- Kleinmazama (Mazama nana (Hensel, 1872))
- Amazonien-Mazama (Mazama nemorivaga (F. Cuvier, 1817))
- Yucatán-Mazama (Mazama pandora Merriam, 1901)
- Paraguay-Großmazama (Mazama rufa (Illiger, 1815))
- Roter Kleinmazama (Mazama rufina (Pucheran, 1851))
 Roter Kleinmazama (Mazama rufina)
Roter Kleinmazama (Mazama rufina) - Mexiko-Großmazama (Mazama temama (Kerr, 1792))
Die Systematik der neotropischen Hirsche (Odocoileini) ist momentan sehr problematisch und muss höchstwahrscheinlich in nächster Zeit neu arrangiert werden. Die Spießhirsche (Mazama) sind molekulargenetischen Untersuchungen zufolge paraphyletisch und verteilen sich auf zwei unterschiedliche Kladen, die einerseits die Andenhirsche, den Sumpfhirsch und den Pampashirsch, andererseits die Amerikahirsche beinhalten. Demzufolge ist eine Aufspaltung der Gattung der Spießhirsche in mehrere Gruppen notwendig. Innerhalb der Klade mit den Amerikahirschen ist aufgrund der engen genetischen Verwandtschaft eine Vereinigung mit Mazama möglich, vorgeschlagen wurde einerseits ein Zusammenschluss von Odocoileus mit Mazama,[21] andererseits auch nur mit „Mazama“ pandora. Problematisch ist, dass die Amerikahirsche offensichtlich auch keine geschlossene Gruppe bilden, da ein Teil der Unterarten des Maultierhirschs (Odocoileus hemionus) stärker mit „Mazama“ pandora gruppieren, ein anderer dagegen mit dem Weißwedelhirsch (Odocoileus virginianus).[22] Der Großmazama (Mazama americana) ist als Ergebnis weiterer Analysen als Artkomplex anzusehen. Ebenso stellen die Pudus (Pudu) wahrscheinlich keine gemeinsame Gruppe dar, da der Südpudu näher zum Sumpfhirsch und Pampashirsch steht, der Nordpudu dagegen das Schwestertaxon zu allen anderen Eigentlichen Trughirschen und zum Ren darstellt, für Letzteren wurde eine Verschiebung in die Gattung Pudella vorgeschlagen. Möglicherweise sind auch die Andenhirsche (Hippocamelus), die zwei hochvariable Arten beinhalten, als paraphyletisch zu betrachten.[23][24][25][22][18] Innerhalb der Cervinae müssen die Zackenhirsche als paraphyletisch eingestuft werden. Eine Gruppe ist mit den Axishirschen verbunden, die andere steht den Edelhirschen näher. Letztere umfasst die Leierhirsche und wurde daher in die Gattung Panolia verschoben. Der Weißlippenhirsch (Cervus albirostris) wurde ursprünglich der Gattung Przewalskium zugewiesen, die Sambarhirsche bildeten dagegen die Gattung Rusa. Allerdings zeigen genetische Studien eine tiefe Einbettung von Przewalskium und Rusa in die Gattung Cervus.[26][16][17] Alternativ wurde vorgeschlagen, auch die Leierhirsche und den Davidshirsch (Elaphurus davidianus) in Cervus einzugliedern.[11] Eine stärkere Aufgliederung der Rothirsche selbst wurde für den östlichen Artenkreis (Wapitis und Sikahirsche) bereits im Jahr 2006 vorgeschlagen.[27][19][28]
Stammesgeschichte

Der Ursprung der Hirsche wird in Eurasien vermutet. In ein sehr nahes Verwandtschaftsverhältnis zu den Hirschen werden die Dromomerycidae gestellt, die im Unteren und Mittleren Miozän in Nordamerika auftraten und sich durch ungewöhnlich gestaltete Stirnwaffen auszeichneten.[29][30] Etwa zur gleichen Zeit, vor rund 20 Millionen Jahren, traten auch die frühesten Hirsche auf, ihre evolutionäre Geschichte ist aber noch weitgehend ungeklärt. Teilweise wurden auch einzelne geweihlose Formen mit den frühen Hirschen in Verbindung gebracht, so das von zahlreichen europäischen Fundstellen des Unteren und Mittleren Miozäns überlieferte Amphimoschus, das aber heute als Verwandter des Gabelbocks gilt.[31] Die frühen Formen der Hirsche werden zumeist eigenen Unterfamilien wie den Lagomerycinae oder den Procervulinae zugewiesen. Sie trugen geweihähnliche Gebilde, die sich von denen der heutigen Hirsche deutlich unterschieden. Die Geweihe waren relativ klein, bestanden aus langen Stirnzapfen („Rosenstöcke“) und verzweigten sich erst kurz vor dem Ende. Sie ragten steil auf und traten ähnlich den heutigen Vertretern häufig nur bei Männchen auf. Lange Zeit war unklar, ob die Stirnwaffen aufgrund des Fehlens der „Rose“ bereits jährlich abgeworfen wurden oder permanent bestanden. Einige Fossilfunde und histologische Untersuchungen geben jedoch an, dass bereits bei den frühesten Hirschen im Unteren Miozän die oberen verzweigten Geweihabschnitte einem mehr oder weniger zyklischen Erneuerungsprozess unterlagen.[32][33][3] Skelettanatomisch ähnelten die frühen Hirsche den Moschustieren (Moschidae), wobei die Backenzähne schon weitgehend den Hirschen entsprachen, während noch ein großer, nach hinten gebogener Eckzahn auftrat. Zu den ältesten Formen gehören unter anderem Lagomeryx, Ligeromeryx oder Procervulus.[34][18] Allgemein wird für die frühen Hirsche eine blatt- bis fruchthaltige Ernährungsweise angenommen, Untersuchungen an Zähnen von Procervulus legen aber nahe, dass zumindest bei diesem auch ein gewisser Grasanteil eine Rolle spielte.[35][36]
.jpg.webp)
Im Verlauf des Mittleren und Oberen Miozän verkürzten sich die Stirnzapfen, der obere Teil des Geweihs verlängerte sich und es kam zur Ausbildung von „Rosen“. Zudem wanderte das Geweih etwas nach hinten am Schädel und die Hornzapfen ragten nicht mehr so steil auf. Auch das Gebiss durchlief einige Änderungen mit stärker molarisierten Prämolaren und höherkronigen hinteren Backenzähnen. Außerdem nahmen die Tiere deutlich an Körpergröße zu. Im ausgehenden Mittelmiozän vor 11 Millionen Jahren traten die ersten Hirsche auf, die den heutigen Arten schon stark ähnelten. Mit Euprox ist möglicherweise schon ein erster Vertreter der Muntjakhirsche aus dieser Zeit nachgewiesen, frühe Funde stammen aus Mitteleuropa und Ostasien.[37] In das späte Miozän vor etwa 9 bis 7 Millionen Jahren datieren Funde aus dem südöstlichen China, die zu Muntiacus und damit zu einer heute noch vorkommenden Form gehören.[38] Etwa zeitgleich sind auch Procapreolus als Verwandter der Rehe[39] und Cervavitus als Vorläufer des Elches nachgewiesen. Auch die ersten großförmigen Vertreter der Megacerotini (auch Megalocerotini[40]) treten in dieser Periode erstmals auf, die vor allem aus dem Pleistozän durch Formen mit auffallend großem Geweih bekannt sind, darunter Eucladoceros und der „Riesenhirsch“ Megaloceros – der zwar von der Körpergröße einem großen Elch vergleichbar war, aber ein deutlich breiteres Geweih als alle heute lebenden Hirscharten hatte.[36][41]
Der früheste Nachweis von Hirschen in Nordamerika stammt aus dem Unteren Pliozän vor rund 5 Millionen Jahren mit Eocoileus aus der Palmetto fauna von Florida.[42] Südamerika erreichten sie erst, als sich vor 3 Millionen Jahren die Landverbindung des Isthmus von Panama schloss. Die ersten Einwanderer waren zumeist mittelgroße Tiere mit mehrfach gegabelten Geweihen wie Antifer, das vor rund 2 Millionen Jahren im westlichen Südamerika auftrat.[43]
Forschungsgeschichte

Die systematische Gliederung der Hirsche hat eine kontroverse Vergangenheit und ist bis heute nicht vollständig geklärt. Als Namensgeber der Familie gilt heute August Goldfuß, der im Jahr 1820 den Begriff „Cervina“ (von lateinisch cervus „Hirsch“) prägte und darunter die „Hirschthiere“ vereinte. Diese umfassten nach Goldfuß neben der Gattung Cervus, der er nicht nur den Rothirsch, sondern auch das Reh, den Damhirsch, das Ren und den Elch zuordnete, zusätzlich noch die Giraffen und die Moschustiere.[44] Nur ein Jahr später benutzte John Edward Gray erstmals die heute gebräuchliche Bezeichnung Cervidae, innerhalb der er Cervus, Alces und Capreolus unterschied. Zusammen mit anderen Paarhufern verwies er die Hirsche zur Gruppe der Ruminantia (Wiederkäuer).[45] Über 50 Jahre darauf, 1872, hatte Gray in einem Katalogwerk des British Museum die Hirsche bereits in vier Familien aufgespalten, in die Cervidae (Hirsche), Alceidae (Elche), Rangiferidae (Ren) und Cervulidae (Muntjakhirsche). Das Wasserreh verwies er damals in die Moschustiere (Moschidae).[46] In einem bedeutenden Klassifizierungsversuch der Hirsche von Victor Brooke aus dem Jahr 1878 unterschied dieser die Familie in die „Plesiometacarpalia“ und den „Telemetacarpalia“, wobei er als Kriterium die Ausbildung des jeweils zweiten und fünften Zehs des Vorderfußes heranzog. Dabei erkannte Brooke, dass sich die fundamentale Zweiteilung der Hirsche teilweise auch in den Schädelmerkmalen, etwa in der Ausbildung des Pflugscharbeins, wiederholte. Zudem ergab sie sich auch geographisch, da die „Plesiometacarpalia“ überwiegend auf Eurasien beschränkt sind (mit Ausnahme des nordamerikanischen Wapiti), die „Telemetacarpalia“ aber weitgehend nur in Amerika vorkommen (mit Ausnahme des eurasischen Rehs sowie des Elchs und des Rens, die zirkumpolar auftreten).[6]
Spätere Autoren berücksichtigten Brookes Erkenntnis teilweise, die Gliederung der Hirsche blieb dabei kontrovers, spiegelte aber in vielen Fällen Brookes zentrale Aufteilung wider. Reginald Innes Pocock wies 1923 insgesamt acht Unterfamilien aus, die er überwiegend anhand von Schädelmerkmalen festlegte.[47] In seiner generellen Klassifikation der Säugetiere teilte George Gaylord Simpson die heutigen Hirsche 1945 in drei Unterfamilien (Muntiacinae, Cervinae und Odocoloinae), stellte ihnen aber auch die Moschustiere als vierte zur Seite. Die drei Unterfamilien der Hirsche spaltete er zusätzlich in sechs Triben auf. Insgesamt ähnelte das System sehr stark dem von Brooke, die Muntjakhirsche sah Simpson in seiner Gliederung als die urtümlichste Gruppe an.[9] Konstantin K. Flerov wiederum kritisierte Simpsons Systematik der Hirsche 1952 und führte mit den Hydropotinae für das Wasserreh eine weitere Unterfamilie ein. Bereits 1974 wies Colin Peter Groves darauf hin, dass die Muntjakhirsche ebenfalls einen „plesiometacarpalen“ Vorderfuß besitzen und deshalb zuzüglich einiger weiterer Schädelmerkmale mit den Cervinae zu vereinen seien.[48] Die Auffassung wurde später von Don E. Wilson und DeeAnn M. Reeder für ihr 2005 erschienenes Werk Mammal Species of the World adaptiert, in dem sie mit den Cervinae, den Capreolinae und den Hydropotinae drei Unterfamilien herausstellten.[49]
Die gegen Ende des 20. Jahrhunderts aufgekommenen molekulargenetischen Analyseverfahren stellten ebenfalls eine Zweiteilung der Hirsche heraus. Diese ließ erkennen, dass die Muntjakhirsche tatsächlich mit den Echten Hirschen nahe verwandt sind, das Wasserreh dagegen eine enge Verbindung zu den Rehen hat.[16][15][17] Konsequenterweise werden heute deshalb nur zwei Unterfamilien der Hirsche anerkannt, die weitgehend der klassischen Unterteilung nach Victor Brooke entsprechen.[1][11]
Hirsche und Menschen
Benennung
Das Wort Hirsch geht über althochdeutsch hir(u)z sowie lateinisch cervus und griechisch κέρας auf die indogermanischen Wurzeln kerud- (Gehörnter, Geweihter, Hirsch) und *ker, was „Horn“ oder „Geweih“ bedeutet, zurück.[50] Insofern ist das männliche Tier der Hirsch, nicht fälschlicherweise der Bulle. Die Benennung der Geschlechter ist biologisch nicht eindeutig. Bei Arten, deren Name auf -hirsch endet, werden Weibchen oft Hirschkuh genannt; veraltete Bezeichnungen hierfür sind Hinde oder Hindin. Jungtiere werden als Hirschkalb bezeichnet. Bei den als Rehe bezeichneten Hirscharten tragen Männchen hingegen die Bezeichnung Bock; Weibchen heißen Ricke oder Geiß und Jungtiere Kitz. Für Rentiere wiederum werden manchmal die samischen Bezeichnungen Sarves für das Männchen und Vaia für das Weibchen verwendet.
Nutzen und Bedrohung
Schon seit der Frühzeit wurden Hirsche vom Menschen aus verschiedensten Gründen gejagt. Dazu zählt einerseits der Nutzen, indem ihr Fleisch gegessen und ihr Fell verarbeitet wird. Andererseits ist es oft eine Jagd aus rein sportlichen Gründen, von der hauptsächlich die Männchen ihres Geweihes wegen betroffen sind. Eine Art, das Ren, wurde domestiziert und dient nicht nur als Fleisch- und Felllieferant, sondern wird auch als Milch- und Lasttier gehalten. Als Jagd- und Parktier wurden mehrere Arten in anderen Regionen eingeführt, so finden sich heute beispielsweise Damhirsche in Nord- und Mitteleuropa, Wasserrehe in Westeuropa und Rothirsche in Australien und Neuseeland.
Dieser Vergrößerung des Verbreitungsgebietes einiger Arten steht die Bedrohung von etlichen Arten gegenüber, die einerseits in der Jagd und andererseits in der Zerstörung ihres Lebensraumes liegt. Eine Art, der Schomburgk-Hirsch, ist im 20. Jahrhundert ausgestorben, eine zweite Art, der Davidshirsch, entging diesem Schicksal nur durch die Nachzucht in europäischen Gehegen, gilt aber immer noch als vom Aussterben bedroht. Die IUCN listet vier Arten als stark gefährdet (endangered) und sechs Arten gefährdet (endangered), für einige Arten fehlen allerdings genaue Daten.[51]
Hirsche in der Kultur

Hirsche flossen auch in verschiedensten Völkern in die Mythologie und Kultur ein. Schon in paläolithischen Felszeichnungen werden sowohl die Tiere als auch Personen mit Hirschgeweih dargestellt. In der Keltischen Mythologie stellt Cernunnos eine Verkörperung des „Hirschgottes“ dar, ein Typus, der sich auch in anderen Religionen findet. In der griechischen Antike war der Hirsch der Jagdgöttin Artemis heilig. Eine solche Hirschkuh erlegte Agamemnon in Aulis, worauf Artemis eine Windstille schickte und als Sühneopfer Agamemnons älteste Tochter Iphigenia forderte. Eine andere heilige Hirschkuh war die Kerynitische Hirschkuh, die ein goldenes Geweih hatte und in Arkadien lebte. Herakles musste sie als dritte Aufgabe lebend fangen. Auch die nordische Mythologie kennt Hirsche, so fressen vier dieser Tiere die Knospen der Weltesche Yggdrasil.
Im christlichen Kontext findet sich der Hirsch infolge des Psalmverses 42,2 („Wie der Hirsch lechzt nach frischem Wasser, so lechzt meine Seele, Gott, nach dir.“) als Darstellung der nach Heil suchenden oder in der Taufe geretteten Seele und ist deshalb auch häufig auf Taufbecken und in Taufkapellen dargestellt. Heiligenlegenden erzählen von Begegnungen mit Hirschen mit einem Kruzifix im Geweih, so bei den Heiligen Eustachius oder Hubertus von Lüttich. In der Bibel ist der Hirsch auch häufig ein Symbol für Schnelligkeit und Gewandtheit, wie in Psalm 18,34 („Er ließ mich springen schnell wie Hirsche“) oder in Jesaja 35,6 („Dann springt der Lahme wie ein Hirsch“). Unter Bezugnahme auf Psalm 42,2 sowie den Physiologus ist die Feindschaft zur Schlange bzw. zum Drachen seit der Antike ein wesentliches Merkmal des Hirsches.[52] Damit kommt dem Hirsch in seiner Rolle als Gegner der Schlange, also des Teufels, eine christologische Bedeutung zu, auch wenn er in der christlichen Symbolik seltener als Stellvertreter Christi auftaucht als der Fisch oder das Lamm. Gemäß der christlichen Tradition zählt der Hirsch, da er sich ausschließlich von Pflanzen ernährt, als besonders reines Tier, weshalb sein Fleisch als reinigend gilt. Auch Hildegard von Bingen charakterisiert in ihrer Physica den Hirsch als Feind der „unke“ und verweist auf die heilende und reinigende Wirkung von Hirschfleisch.[53] Aufgrund des jährlichen Abwurfs und der Neuentwicklung seines Geweihs ist der Hirsch außerdem Symbol der Auferstehung und Erneuerung.[54]
In zahlreichen mittelalterlichen Texten wird von wunderbaren Hirschjagden erzählt, von Hirschen, die den Helden ins Feenland führen, um dort die Liebe einer Fee zu gewinnen, aber auch von Hirschen, die Verstorbenen den Weg ins Totenreich weisen.[55]
Im außereuropäischen Bereich erscheinen Hirsche unter anderem im Shintō, wo sie als göttliche Boten gelten und beispielsweise um den Kasuga-Schrein gehalten werden. Auch in der Mythologie der Indianer spielen Hirsche – vorrangig Wapitis – eine Rolle und werden mit Eigenschaften wie Sanftmütigkeit und Dankbarkeit in Verbindung gebracht.
Literatur
- Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4.
- Hubert Hendrichs, Roland Frey: Cervidae, Hirsche. In: Wilfried Westheide, Reinhard Rieger (Hrsg.): Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. Spektrum Akademischer Verlag, Heidelberg/Berlin 2004, ISBN 3-8274-0307-3, S. 628–630.
- S. Mattioli: Family Cervidae (Deer). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Band 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 350–443.
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore 1999, ISBN 0-8018-5789-9.
Einzelnachweise
- S. Mattioli: Family Cervidae (Deer). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Band 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 350–443.
- C. Barrette: Antler eating and antler growth in wild Axis deer. In: Mammalia. Band 49, Nr. 4, 1985, S. 491–499.
- Gertrud E. Rössner, Loïc Costeur und Torsten M. Scheyer: Antiquity and fundamental processes of the antler cycle in Cervidae (Mammalia). In: The Science of Nature. Band 108, 2021, S. 3, doi:10.1007/s00114-020-01713-x.
- Yuusuke Samejima und Hiroshige Matsuoka: A new viewpoint on antlers reveals the evolutionary history of deer (Cervidae, Mammalia). In: Scientific Reports. Band 10, 2020, S. 8910, doi:10.1038/s41598-020-64555-7.
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa. Band 6: Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 115–120.
- Victor Brooke: On the classification of the Cervidae, with a synopsis of the existing species. In: Proceedings of the Zoological Society. Jahrgang 1878, S. 883–928 (biodiversitylibrary.org).
- Peter C. Lent: Mother—Infant Relationships in Ungulates. In: V. Geist und F. Walther (Hrsg.): The behaviour of ungulates and its relation to management. IUCN Publications new series Band 24, Morges, 1974, S. 14–55.
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. In: Molecular Phylogenetics and Evolution. Band 133, 2019, S. 256–262.
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. In: Bulletin of the American Museum of Natural History. Band 85, 1945, S. 1–350 (S. 270–272).
- A. Hassanin und E. J. P. Douzery: Molecular and morphological phylogenies of ruminants, and the alternative position of the Moschidae. In: Systematic Biology. Band 52, 2003, S. 206–228.
- Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer, Bettine Jansen van Vuuren, Conrad Matthee, Manuel Ruiz-Garcia, François Catzeflis, Veronika Areskoug, Trung Thanh Nguyen und Arnaud Couloux: Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes. In: Comptes Rendus Palevol. Band 335, 2012, S. 32–50.
- Maureen A. O’Leary und John Gatesy: Impact of increased character sampling on the phylogeny of Cetartiodactyla (Mammalia): combined analysis including fossils. In: Cladistics. Band 24, 2008, S. 397–442.
- Michelle Spaulding, Maureen A. O’Leary und John Gatesy: Relationships of Cetacea (Artiodactyla) Among Mammals: Increased Taxon Sampling Alters Interpretations of Key Fossils and Character Evolution. In: PLoS ONE. Band 4, Nr. 9, 2009, S. e7062.
- Jonathan D. Marcot: Molecular Phylogeny of terrestrial artioidactyls. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 4–18.
- M. V. Kuznetsova, M. V. Kholodova und A. A. Danilkin: Molecular Phylogeny of Deer (Cervidae: Artiodactyla). In: Russian Journal of Genetics. Band 41, Nr. 7, 2005, S. 742–749.
- Christian Pitra, Joerns Fickel, Erik Meijaard und P. Colin Groves: Evolution and phylogeny of old world deer. In: Molecular Phylogenetics and Evolution. Band 33, 2004, S. 880–895.
- Clément Gilbert, Anne Ropiquet und Alexandre Hassanin: Mitochondrial and nuclear phylogenies of Cervidae (Mammalia, Ruminantia): Systematics, morphology, and biogeography. In: Molecular Phylogenetics and Evolution. Band 40, 2006, S. 101–117.
- Nicola S. Heckeberg: The systematics of the Cervidae: a total evidence approach. In: PeerJ. Band 8, 2020, S. e8114, doi:10.7717/peerj.8114.
- Colin Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. 71–107).
- Pedro H. F. Peres, Douglas J. Luduvério, Agda Maria Bernegossi, David J. Galindo, Guilherme B. Nascimento, Márcio L. Oliveira, Eluzai Dinai Pinto Sandoval, Miluse Vozdova, Svatava Kubickova, Halina Cernohorska und José Maurício Barbanti Duarte: Revalidation of Mazama rufa (Illiger 1815) (Artiodactyla: Cervidae) as a Distinct Species out of the Complex Mazama americana (Erxleben 1777). In: Frontiers in Genetics. Band 12, 2021, S. 742870, doi:10.3389/fgene.2021.742870.
- Luis A. Escobedo-Morales, Salvador Mandujanob, Luis E. Eguiarte, Marco A. Rodríguez-Rodríguez und Jesús E. Maldonado: First phylogenetic analysis of Mesoamerican brocket deer Mazama pandora and Mazama temama (Cetartiodactyla: Cervidae) based on mitochondrial sequences: Implications for Neotropical deer evolution. In: Mammalian Biology. Band 81, 2016, S. 303–313.
- Eliécer E. Gutiérrez, Kristofer M. Helgen, Molly M. McDonough, Franziska Bauer, Melissa T. R. Hawkins, Luis A. Escobedo-Morales, Bruce D. Patterson und Jesús E. Maldonado: A gene-tree test of the traditional taxonomy of American deer: the importance of voucher specimens, geographic data, and dense sampling. In: ZooKeys. Band 697, 2017, S. 87–131.
- José Maurício Barbanti Duarte, Susana González und Jesus E. Maldonado: The surprising evolutionary history of South American deer. In: Molecular Phylogenetics and Evolution. Band 49, 2008, S. 17–22.
- V. V. Abril, E. A. G. Carnelossi, S. González und J. M. B. Duarte: Elucidating the Evolution of the Red Brocket Deer Mazama americana Complex (Artiodactyla; Cervidae). In: Cytogenetic and Genome Research. Band 128, 2010, S. 177–187.
- Nicola S. Heckeberg, Dirk Erpenbeck, Gert Wörheide und Gertrud E. Rössner: Systematic relationships of five newly sequenced cervid species. In: PeerJ. Band 4, 2016, S. e2307, doi:10.7717/peerj.2307.
- Ettore Randi, Nadia Mucci, Françoise Claro-Hergueta, Amélie Bonnet und Emmanuel J. P. Douzery: A mitochondrial DNA control region phylogeny of the Cervinae: speciation in Cervusand implications for conservation. In: Animal Conservation. Band 4, 2001, S. 1–11.
- Colin P. Groves: The genus Cervus in eastern Eurasia. In: European Journal of Wildlife Research. Band 52, Nr. 2, 2006, S, 14–22.
- Colin Peter Groves: Current taxonomy and diversity of crown ruminants above the species level. In: Zitteliana. Band 32, 2014, S. 5–14.
- Donald R. Prothero und Matthew R. Liter: Family Palaeomerycidae. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 241–248.
- Israel M. Sánchez, Juan L. Cantalapiedra, María Ríos, Victoria Quiralte und Jorge Morales: Systematics and Evolution of the Miocene Three-Horned Palaeomerycid Ruminants (Mammalia, Cetartiodactyla). In: PLoS ONE. Band 10, Nr. 12, 2015, S. e0143034.
- Bastien Mennecart, Grégoire Métais, Loïc Costeur, Léonard Ginsburg und Gertrud E. Rössner: Reassessment of the enigmatic ruminant Miocene genus Amphimoschus ourgeois, 1873 (Mammalia, Artiodactyla, Pecora). In: PLoS ONE. Band 16, Nr. 1, 2021, S. e0244661, doi:10.1371/journal.pone.0244661.
- Nicola S. Heckeberg: Origination of antlerogenesis. In: Journal of Morphology. Band 278, Nr. 2, 2017, S. 182–202, doi:10.1002/jmor.20628.
- Nicola S. Heckeberg: Geweih oder nicht Geweih? – Nachweis der ersten abgeworfenen Geweihe. In: Freunde der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München e.V. - Jahresbericht 2017 und Mitteilungen. Band 46, 2017, S. 67–76.
- Kantapon Suraprasit, Yaowalak Chaimanee, Herve Bocherens, Olivier Chavasseau und Jean Jacques Jaeger: Systematics and Phylogeny of Middle Miocene Cervidae (Mammalia) from Mae Moh Basin (Thailand) and a Paleoenvironmental Estimate Using Enamel Isotopy of Sympatric Herbivore Species. In: Journal of Vertebrate Paleontology. Band 34, Nr. 1, 2014, S. 179–194.
- Daniel DeMiguel, Mikael Fortelius, Beatriz Azanza und Jorge Morales: Ancestral feeding state of ruminants reconsidered: earliest grazing adaptation claims a mixed condition for Cervidae. In: BMC Evolutionary Biology. Band 8, 2008, S. 13, doi:10.1186/1471-2148-8-13.
- Alan W. Gentry, Gertrud E. Rössner und Elmar P. J. Heizmann: Suborder Ruminantia. In: Gertrud E. Rössner und Kurt Heissig (Hrsg.): The Miocene land mammals of Europe. München, 1999, S. 225–257.
- Sukuan Hou: A new species of Euprox (Cervidae, Artiodactyla) from the upper Miocene of the Linxia Basin, Gansu Province, China, with interpretation of its paleoenvironment. In: Zootaxa. Band 3911, Nr. 1, 2015, S. 043–062.
- Dong Wei, Ji Xue-Ping, Nina G. Jablonski, Denise F. Su und Li Wen-Qi: New materials of the Late Miocene Muntiacusfrom Zhaotong hominoid site in southern China. In: Vertebrata Palasiatica. Band 52, Nr. 3, 2014, S. 316–327.
- Beatriz Azanza, Gertrud E. Rössner und Edgardo Ortiz-Jaureguizar: The early Turolian (late Miocene) Cervidae (Artiodactyla, Mammalia) from the fossil site of Dorn-Dürkheim 1 (Germany) and implications on the origin of crown cervids. In: Palaeobiodiversity and Palaeoenvironments. Band 93, 2013, S. 217–258.
- Peter Grubb: Valid and invalid nomenclature of living and fossil deer, Cervidae. In: Acta Theriologica. Band 45, Nr. 3, 2000, S. 289–307.
- Roman Croitor: Deer from Late Miocene to Pleistocene of Western Palearctic: matching fossil record and molecular phylogeny data. In: Zitteliana B. Band 32, 2014, S. 115–153.
- S. David Webb: Evolutionary history of New World Cervidae. In: Elisabeth S. Vrba und George B. Schalle (Hrsg.): Antelopes, Deer, and Relatives: Fossil Record, Behavioral Ecology, Systematics, and Conservation. Yale University Press, New Haven, 2000, S. 38–64.
- Rafael Labarca E. und M. Alejandra Alcaraz: Presencia de Antifer ultra Ameghino (= Antifer niemeyeri Casamiquela) en el Pleistoceno tardío-Holoceno temprano de Chile central (30-35ºS). In: Andean Geology. Band 38, Nr. 1, 2011, S. 156–170, doi:10.5027/andgeoV38n1-a09.
- August Goldfuß: Handbuch der Zoologie, Band 2. Nürnberg, 1820, S. 1–510 (S. 374–378) (reader.digitale-sammlungen.de).
- John Edward Gray: On the natural arrangement of vertebrose animals. In: London Medical Repository. Band 15, 1821, S. 297–310 (307).
- John Edward Gray: Catalogue of ruminant Mammalia (Pecora, Linnaeus), in the British Museum. London, British Museum (Natural History), 1872, S. 1–102 (biodiversitylibrary.org).
- Reginald Innes Pocock: On the external characters of Elaphurus, Hydropotes, Pudu, and other Cervidae. In: Proceedings of the Zoological Society. Jahrgang 1923, S. 181–207 (biodiversitylibrary.org).
- Colin Peter Groves: A note on the systematic position of the Muntjac (Artiodactyla, Cervidae). In: Zeitschrift für Säugetierkunde. Band 39, 1974, S. 369–372.
- Don E. Wilson und DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. The Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4 (departments.bucknell.edu).
- Friedrich Kluge und Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Aufl., hrsg. von Walther Mitzka, De Gruyter, Berlin / New York, 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 310 (Hirsch) und 316 (Horn).
- IUCN Red List of Threatened Species, abgerufen am 29. November 2006.
- Der Physiologus. Tiere und ihre Symbolik. Übertragen und erläutert von Otto Seel. 5. Auflage. Zürich/München 1987, S. 44.
- Hildegard von Bingen: Heilkraft der Natur. „Physica“. Das Buch von dem inneren Wesen der verschiedenen Naturen der Geschöpfe. Übersetzt von Marie-Louise Portmann. 2. Auflage. Christiana, Stein am Rhein 2005, ISBN 978-3-7171-1129-0, S. 434–435.
- Michel Pastoureau: Das mittelalterliche Bestiarium. Darmstadt 2013, S. 90.
- Leonie Franz: Wahre Wunder. Tiere als Funktions- und Bedeutungsträger in mittelalterlichen Gründungslegenden. Heidelberg 2011, S. 71–72.
Weblinks
- Darstellung der vermuteten neuen Abstammungsverhältnisse innerhalb der Wiederkäuer und der Hirsche (englisch) (Memento vom 25. August 2004 im Webarchiv archive.today)
