Thioketone
Thioketone (Thione) sind organische, chemische Verbindungen. Sie stellen die Schwefel-Analoga von Ketonen dar und gehören zu den Thiocarbonylverbindungen.[1]
| Thioketone |
|---|
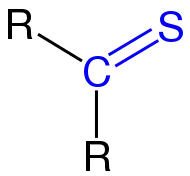 symmetrisches Thioketon |
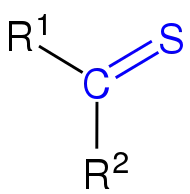 unsymmetrisches Thioketon |
| Die Thicoarbonylgruppe ist blau markiert. Die Reste R, R1 und R2 sind organische Reste (Alkyl, Aryl o. ä.). |
Ihre funktionelle Gruppe besteht aus einem Kohlenstoff- und einem Schwefelatom, welche durch eine Doppelbindung miteinander verbunden sind. Bei den Resten am Kohlenstoffatom der Thiocarbonylgruppe handelt es sich dabei um organische Reste (Alkylrest, Arylrest etc.). Thioketone sind ausnahmslos farbige Substanzen und zeichnen sich durch einen für organische Schwefelverbindungen typischen, intensiven Geruch aus.[2] Da ihre aliphatischen Monomere häufig instabil sind, tendieren sie zur Polymerisation. Dabei werden die Trimerisierungsprodukte bevorzugt gebildet.[3] Synthesen und Reaktionen von Thioketonen beziehen sich darum häufig auf stabilere, aromatische Thioketone.[4] Dennoch können heutzutage Thioketone jeder Art hergestellt werden.[5]
Nomenklatur
Zur Benennung von Thioketonen wird, wenn keine funktionelle Gruppen höherer Priorität vorhanden sind, das Präfix Thioxo- vor den Trivialnamen gestellt (z. B. Thioxoaceton, Thioxobenzophenon). Das Präfix Thio- ist gemäß der aktuellsten IUPAC-Nomenklatur veraltet, wird aber trotzdem häufig eingesetzt (z. B. Thioaceton, Thiobenzophenon). Wenn eine funktionelle Gruppe mit höherer Priorität vorliegt, wird das Suffix -thion angehängt (z. B. Cyclohexanthion). Deshalb werden Thioketone auch als Thione bezeichnet.[1]
Eigenschaften


Physikalische Eigenschaften
Thioketone sind ausnahmslos farbige Verbindungen, wobei die erscheinenden Farben unterschiedlich sind.[3] Während niedere, aliphatische Thioketone häufig als rote Öle beobachtet wurden, erscheinen aromatische Thioketone blau bis violett (z. B.erscheint Thiobenzophenon blau). Bei der Trimerisierung von z. B. aliphatisch substituierten Thioketonen entstehen hingegen farblose Derivate von Trithian.[2] Thioketone stehen im Gleichgewicht zu ihren Ennthiolderivaten (vgl. Keto-Enol-Tautomerie), die Verschiebung des Gleichgewichts ist sowohl temperaturabhängig als auch abhängig vom Lösungsmittel, und hat einen Einfluss auf die Farbintensität (Thermochromie). Unterschiedliche Thioketone weisen unterschiedliche Tendenzen zur Enthiolosierung auf.[5] Der Geruch von Thioketonen wird oft als besonders unangenehm beschrieben. Sie lösen sich gut in unpolaren Lösungsmitteln.[7] Die Stabilität der Thioketone ist von den gebundenen Resten abhängig und unterscheidet sich stark: während monomere Thioketone instabil sind und darum leicht polymerisieren, werden aromatische Thioketone durch ihre Reste stabilisiert. Darum sind Diaryl- und hereocyclische Thioketone stabiler, gut kristallisierbar und weisen keine Tendenz zur Polymerisation auf. Ihr Geruch ist etwas weniger unangenehm.[2][7] Zudem hängt die Stabilität und damit ihre Reaktivität mit der photometrischen Reaktionsfähigkeit zusammen.[8]
Chemische Eigenschaften
Obwohl Kohlenstoff und Schwefel in der charakteristischen C=S-Doppelbindung dieselbe Elektronegativität aufweisen, und die Doppelbindung darum als schwach polar aufgefasst werden könnte, ist sie leicht polarisierbar.[9] Das zeigt sich in ihrer Eigenschaft, als Dipolarophile in Cycloadditionsreaktionen zu reagieren.[10] Grundsätzlich reagieren Thiocarbonylverbindungen im Vergleich zu Carbonylverbindungen wesentlich schneller in Cycloadditionen.[11] Begründet durch die Festkörperstruktur können auch intramolekulare Diels-Alder-Reaktionen erfolgen.[12] Insgesamt handelt es sich um reaktionsfreudige Verbindungen, welche sowohl mit nucleophilen als auch in elektrophilen Reagenzien leicht umgesetzt werden können.[5] Die oben beschriebene Thioketo-Enthiol-Tautomerie hat erheblichen Einfluss auf die chemischen Eigenschaften von Thioketonen. Einige liegen, besonders in protischen Lösungsmitteln, nahezu vollständig als Enthiole vor. Andere bevorzugen den Zustand als Thioketon. Das ermöglicht vielfältige Reaktionen mit nucleophilen und mit elektrophilen Reagenzien (Kapitel: Reaktionen).[7] Zudem können Thioketone Komplexverbindungen mit Metallen der sechsten Nebengruppe bilden.[13] Die chemischen Eigenschaften α-β-ungesättigter Thioketone unterscheiden sich von den Eigenschaften gesättigter Thioketone. Das liegt zum einen an den kunjugierten C=C- und C=S-Doppelbindungen, welche Thioketone solcher Art zu besonders reaktionsfreudigen Dienen in Diels-Alder-Reaktionen machen. Zum anderen ist die Tautomerisierung zu Enthiolen ausgeschlossen. Dieser Effekt wird durch elektronenschiebende Substituenten in β-Stellung begünstigt (mesomerer Effekt).[5]
Synthese
Die Synthese von Thioketonen bereitet aufgrund der Instabilität der Monomere und des starken Geruchs Wissenschaftlern häufig Schwierigkeiten. Zunächst wurde angenommen, dass sich Thioketone durch die Pyrolyse der Trimere oder durch die Einwirkung von Schwefelwasserstoff auf Ketone im sauren Milieu gewinnen liesen.[14][15] Letztere Methode hat sich nur in Einzelfällen bewährt. Viele der in der Literatur zitierten Methoden haben den Nachteil, dass die Produkte unrein sind und anstatt von Thioketonen geminale Dithiole entstanden. Roland Mayer schlug darauf hin eine Synthese von Thioketonen aus geminalen Dithiolen vor:[7]
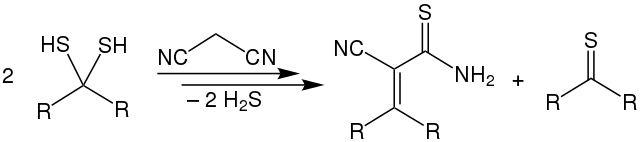
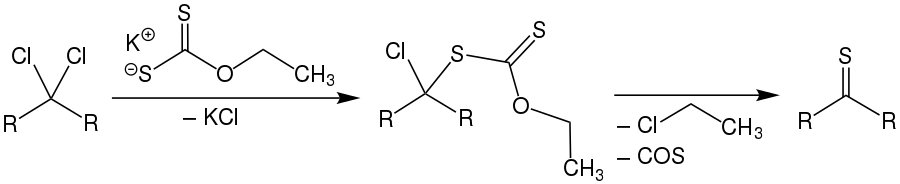
Dabei werden zwei Äquivalente des Dithiols mit Malonsäuredinitril umgesetzt, wobei unter Abspaltung eines Thioamids das entsprechende Thioketon gebildet wird.[5] Außerdem können arylsubstituierte, geminale Dichloride (Ketochloride) verwendet werden. Dieses, aus Ketonen leicht zugängliche Edukt, wird mit Kalium-O-ethyldithiocarbonat umgesetzt. Das entstehende Zwischenprodukt reagiert unter Abspaltung von Chlorethan und Carbonylsulfid zum entsprechenden Thioketon.[3][5][16]
Thiobenzophenon ist ein klassisches Beispiel für ein Thioketon. Bei beiden Resten handelt es sich um Arylreste, welche die Verbindung stabilisieren. Diese Stabilität macht das Thioketon handhabbar. Es kann auf unterschiedlichen Wegen synthetisiert werden, z. B. durch die Umsetzung von Benzophenon mit Schwefelwasserstoff und Salzsäure (Weg A), oder durch eine Schwefelvariante der Friedel-Crafts-Acylierung von Benzol mit einem Thiosäurechlorid (Weg B):[17][5]
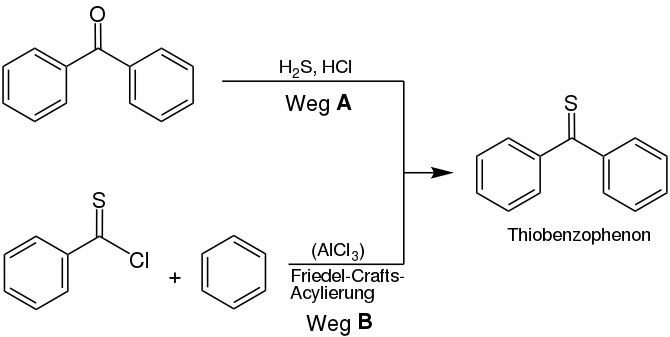
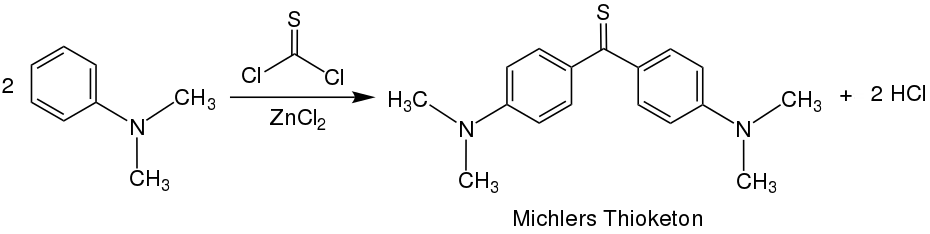
Alternativ kann Thioessigsäure mit Ketochloriden umgesetzt werden, wobei unter Abspaltung von Salzsäure ebenfalls Thiobenzophenon gebildet wird. Der Vorteil dieser Variante besteht darin, dass sie nicht im alkoholischen Medium stattfindet, sodass Nebenreaktionen (welche auf der Reaktion zwischen Ketochchloriden und Alkoholen beruhen) ausgeschlossen sind.[7] Analog zur Synthese von Michlers Keton kann Michlers Thioketon durch die Reaktion von Thiophosgen mit N,N-Dimethylanilin gebildet werden. Das Zinkchlorid fungiert dabei als Lewis-Katalysator.[11]
Heutzutage existieren jedoch effizientere Methoden zur Thionisierung. Diese beinhalten oft die Umsetzung von Ketonen mit Lawessons Reagenz. Andere Varianten setzen Ketone mit Phosphorpentasulfid um, wobei Aluminiumoxid als Katalysator fungiert.

Die Idee Phosphorpentasulfid als Reagenz zur Thioketonsynthese zu verwenden wurde früh vorgeschlagen und häufig als gutes Mittel zur Schwefelung von Ketonen beschrieben.[5] Der Zusatz von Aluminiumoxid ist eine moderne Variante, welche die Reaktion enorm beschleunigt und die Ausbeuten stark erhöht.[18] Darüber hinaus wurden weitere Methoden zur Herstellung von Thioketonen beschrieben.[19] Hierzu zählt die Synthese aus Alkinen mit Schwefelwasserstoff unter Lichteinwirkung, die Reaktion von Ketohydrazonen mit Dischwefeldichlorid oder durch die [3,3]-sigmatrope Thio-Claisen-Umlagerung von Allyl-vinyl-ethern.[5]
Reaktionen
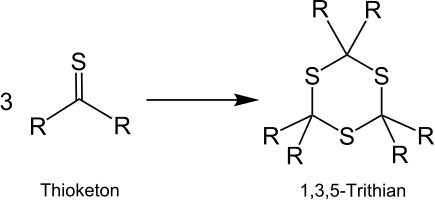
Vor allem aliphatische Thioketone neigen aufgrund von ihrer Reaktivität zur Trimerisierung.[2] Dabei werden substituierte 1,3,5-Trithiane gebildet. Die Derivate von 1,3,5-Trithian können in organischen Synthesen nützliche Zwischenprodukte darstellen.[20]
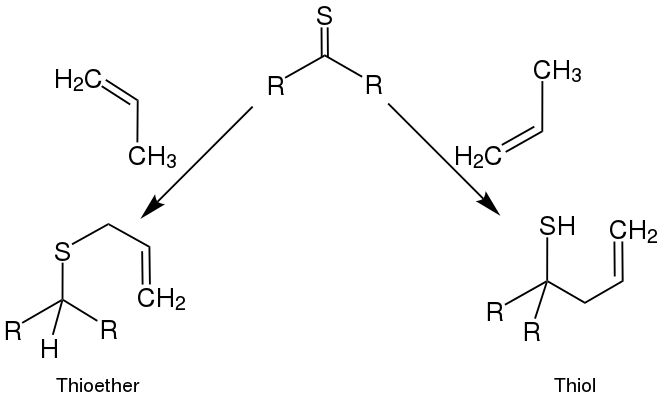
Die größten Unterschiede zwischen den Reaktionen von Thioketonen und Ketonen wurden bei der Reaktion mit Nucleophilen, Olefinen und konjugierten Dienen beobachtet. Während nucleophile Angriffe bei Carbonylverbindungen am Kohlenstoffatom der Carbonylgruppe erfolgen, können sie bei Thiocarbonylverbindungen sowohl am Kohlenstoff- als auch am Schwefelatom auftreten.[11] Mit Monoolefinen können Thioketone in En-Reaktionen zu acyclischen Verbindungen wie Thioethern oder zu Thiolen reagieren:
Cyclische Produkte können durch die Diels-Alder-Reaktion synthetisiert werden, indem z. B. ein konjugiertes Dien mit einem Thioketon zur Reaktion gebracht wird, wobei die C=S-Doppelbindung das Dienophil darstellt:

Auf diese Weise können heterocyclische Verbindungen synthetisiert werden. Cycloadditionsreaktionen laufen mit Thioketonen wesentlich schneller ab, als mit Ketonen.[11] Außerdem lassen sich durch diese Reaktion Dihydrothiopyrane herstellten.[21]
| Oxidationsprodukte von Thioketonen[9] |
|---|
 Thioketon |
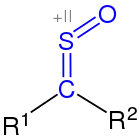 Thioketonoxid (Sulfin) |
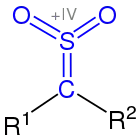 Thioketondioxid (Sulfen) |
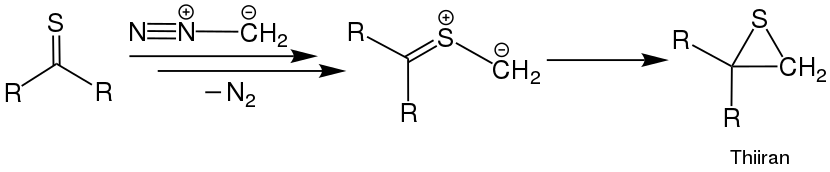
Heterocyclische Verbindungen können auch durch die Umsetzung von Thioketonen mit Diazomethan gewonnen werden. Dabei wird unter Abspaltung von Stickstoff (N2) ein dipolares Intermediat gebildet. Dieses kann erneut mit einem Thioketon umgesetzt werden, wobei durch Dimerisierung heterocyclische Verbindungen erhalten werden. Das Intermediat kann allerdings auch eine irreversible, intramolekulare Cycloaddition eingehen und Thiirane bilden.[22] Diese können in einem weiteren Reaktionsschritt in Alkene überführt werden.[9][23][24]
Des Weiteren können Thioketone oxidiert werden. Eine solche Oxidation führt zu Sulfinen, den S-Oxiden der Thioketone, und schließlich zu Sulfenen, den S,S-Dioxiden der Thioketone.[9] Die Bezeichnung Sulfine wurde von Sheppard und Diekmann geprägt, um die strukturelle Beziehung zu Sulfenen zum Ausdruck zu bringen.[25] Diese wurde hingegen eingeführt, um ihre Verwandtschaft mit Ketenen zu betonen.[26] Beide Bezeichnungen werden aus traditionellen Gründen verwendet. Sowohl die IUPAC als auch moderne Literatur empfiehlt die Bezeichnungen Thioketonoxid bzw. Thioketondioxid.[27] Während Sulfine früh als stabile Verbindungen dargestellt wurden, gelang dies mit Sulfenen relativ spät.[28][29] Letzteres ist in der Reaktivität von Sulfenen begründet, denn die Partialladungen der einzelnen Atome sind stärker ausgeprägt als bei Sulfinen, so dass elektrophile Angriffe auf das Kohlenstoffatom wesentlich leichter erfolgen können. Als Oxidationsmittel fungieren dabei meistens Wasserstoffperoxid oder Peroxycarbonsäuren, wobei Ozon oder Singulettsauerstoff in Einzelfällen ebenfalls eingesetzt wurden. Allerdings ist wichtig, dass der Sauerstoffüberträger nicht im Überschuss verwendet wird, weil Sulfine oxidationsempfindlich sind und darum leicht unter Abgabe von Schwefeldioxid zu den entsprechenden Carbonylverbindungen reagieren können.[4] Thioketone können auch mit organischen Aziden umgesetzt werden, wobei Imine als Zwischenprodukte gebildet werden. Wenn diese hydrolytisch gespalten werden, können Ketone und primäre Amine erhalten werden.[3]

Reaktionsübersicht
Die Folgenden Tabellen zeigen eine Übersicht von Reaktionen der Thioketone mit einigen nucleophilen und elektrophilen Reagenzien. Aliphatische Thioketone reagieren mit Nucleophilen unter Eliminierung von Schwefelwasserstoff weitestgehend analog zu Ketonen. Mit elektrophilen Reagenzien reagieren nahezu alle Thioketone am Schwefelatom zu Derivaten von Enthiolen, was einige präparative Möglichkeiten eröffnet. Vereinzelt sind Reaktionen am α-Kohlenstoffatom ebenfalls möglich. Die Tabelle ist beispielhaft auf aliphatische, symmetrische Thioketone bezogen, die Reaktionen können auch mit asymmetrischen Thioketonen durchgeführt werden.[7]
 Allgemeine Strukturformel von symmetrischen Thioketonen Thioketon (z. B. R = CH3) | Reagenz | Produkt |
|---|---|---|
| H2O Wasser | 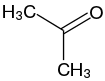 Aceton (Keton) | |
| HOCH3 Methanol (primärer Alkohol) | 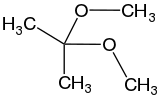 Acetondimethylacetal (Ketal) | |
| H2S Schwefelwasserstoff | 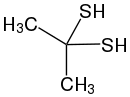 2,2-Propandithiol (geminales Dithiol) | |
| H2NOH Hydroxylamin | 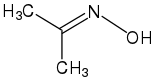 Acetonoxim (Ketoxim) | |
| N2H4 Hydrazin | 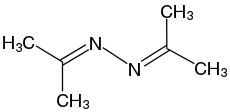 Acetonazin (Ketazin) | |
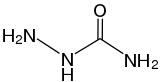 Semicarbazid Semicarbazid | 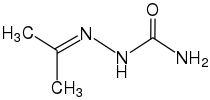 Acetonsemicarbazon (Semicarbazon) | |
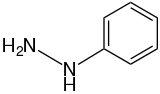 Phenylhydrazin Phenylhydrazin | 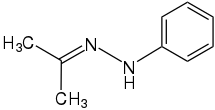 Phenylhydrazon (Hydrazon) | |
| H2NCH3 Methylamin (primäres Amin) | 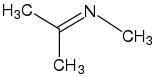 N-Methylpropan-2-imin (Imin) | |
| Reduktionsmittel (z. B. LiAlH4) | Unterschiedliche Produkte möglich (z. B. Aromaten, primäre Amine) [30] | |
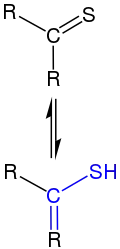 Enthiol (z. B. R = CH3 bzw. CH2) | Reagenz | Produkt |
|---|---|---|
| BrCH3 Brommethan (Halogenalkan) | 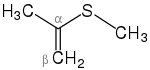 2-(Methylsulfanyl)-1-propen 2-(Methylsulfanyl)-1-propen (α-β-ungesättigter Thioether) | |
| N2CH2 Diazomethan (Diazoverbindung) | ||
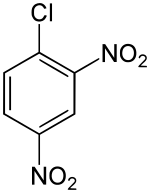 Strukturformel von 2,4-Dinitrochlorobenzene 2,4-Dinitrochlorbenzol | 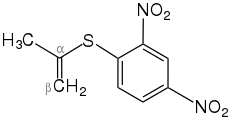 Thioether des 2,4-Dinitrochlorobenols α-β-ungesättigter, aromatisch substituierter Thioether des 2,4-Dinitrochlorobenzols | |
Acrylnitril | 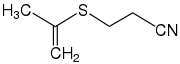 Thionitril | |
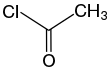 Acetylchlorid Acetylchlorid (Carbonsäurehalogenid) | 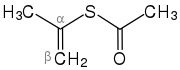 Iso-Propen-thioacetat iso-Propenthioacetat (α-β-ungesättigter Thioester) | |
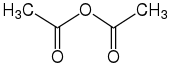 Essigsäureanhydrid Essigsäureanhydrid (Säureanhydrid) | ||
CS2 + 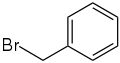 Kohlenstoffdisulfid und Benzylbromid | 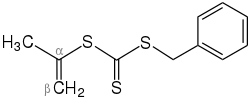 Thiocarbonat aromatisch substituiertes Trithiocarbonat | |
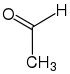 Acetaldehyd (Aldehyd) | 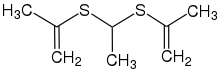 Sulfandiyl | |
| Oxidationsmittel (z. B. H2O2) | 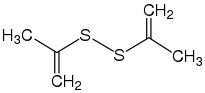 Disulfid Disulfid | |
Praktische Bedeutung
Thioketone haben überwiegend präparative Bedeutung für Synthesen in der Organischen Chemie.[2][31] Organische Schwefelverbindungen bieten grundsätzlich nicht nur vielfältige, synthetische Möglichkeiten, sie spielen auch in biologischen Prozessen eine wichtige Rolle. Sie wurden bereits zur Herstellung von Pharmazeutika, Polymeren, Pestiziden und Herbiziden eingesetzt.[18] Für die Einführung von Schwefelatomen in Heterocyclen eignen sich Thioketone besonders gut.[11]
Einzelnachweise
- Eintrag zu Thioketone. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2020.
- Kracher, R. et al. (2007): Lexikon der Chemie. 3. Band (Perf bis Zy), Jokers edition. Heidelberg: Spektrum Verlag. S. 342. ISBN 978-3-8274-1909-5.
- Schönberg, A. & Wagner, A. (1955): Methoden zur Herstellung und Umwandlung von Thioaldehyden und Thioketonen. In Müller, E. (Hrsg.): Methoden der Organischen Chemie. Band IX: Schwefel-, Selen-, Tellurverbindungen. Stuttgart: Thieme Verlag. S. 699–740.
- Campaigne, E.: Thiones and thials. Chemical Reviews, 1946, 39(1), S. 1–77. .
- Voss, J. (1985): Thioaldehyde bzw. Thioketone. In Klamann, D. (Hrsg.): Methoden der Organischen Chemie. Band E11: Organische Schwefel-Verbindungen. Stuttgart: Thieme Verlag. S. 195–231. ISBN 3-13-218 104-8
- Verani, G. & Garau, A. (2013): Chalcogenone C=E Compounds (E=S, Se, Te). In Devillanova, F. A. & du Mont, W.-W. (Eds.): Handbook of Chalcogen Chemistry: New Perspektives in Sulfur, Selenium and Tellurium. 1. Band. Dorchester: The Royal Society of Chemistry. S. 118–149.
- Mayer, R. et al.: Aliphatische Thioketone. Angewandte Chemie, 1964, 76(4), S. 157–167. doi:10.1002/ange.19640760402.
- Lewis, G.N. & Kasha, N.: Phosphorescence in Fluid Media and the Reverse Process of Singlet-Triplet Absorption. Journal of the American Chemical Society, 1945, 67(6), S. 994–1003. doi:10.1021/ja01222a032.
- Opitz, G.: Sulfine und Sulfene - die S-Oxide und S,S-Dioxide der Thioaldehyde und Thioketone. Angewandte Chemie, 1967, 79(4), S. 161–177. doi:10.1002/ange.19670790402
- Fišera, L. et al.: New thione chemistry. Pure and applied chemistry, 1996, 68(4), S. 789–798. doi:10.1351/pac199668040789.
- McGregor, W. M. & Sherrington, D.C.: Some Recent Synthetic Routes th Thioketones and Thioaldehydes. Chemical Society Reviews, 1993, 22(3), S. 199–204. doi:10.1039/CS9932200199.
- Jutzi, P. et al.: Bis(pentamethylcyclopentadienyl)keton und -thioketon: Kohlenstoff-Verbindungen mit präformierter Diels-Alder-Geometrie. Chemische Berichte, 1993, 126(2), S. 415–420. doi:10.1002/cber.19931260219.
- Fischer, H. & Märkl, R.: Thioketon-Komplexe durch Insertion des Schwefels von Organylisothiocyanaten in die Metall-Carbenkohlenstoff-Bindung. Chemische Berichte, 1982, 115(4), S. 1349–1354. doi:10.1002/cber.19821150411.
- Von Ettinghausen, O.G.: Polythioacetone. Polymer, 1966, 7(9), S. 469–474. doi:10.1016/0032-3861(66)90005-X.
- Mayer, Roland, et al.: Die basenkatalysierte Umsetzung von Ketonen mit Schwefelwasserstoff. Angewandte Chemie, 1963, 75(21), S. 1011–1014. doi:10.1002/ange.19630752103.
- Ferri, C. (1978): Reaktionen der organischen Synthese: 2700 technische und präparative Herstellungs- und Umwandlungsreaktionen. Stuttgart: Thieme. S. 490f. ISBN 3-13-487401-6.
- Viola, H. et al.: Friedel-Crafts-Reaktionen mit Thiosäurechloriden. Polymer, 1968, 101(10), S. 3517–3529. doi:10.1002/cber.19681011024.
- Polshettiwar, V. & Kaushik, M.P.: A new, efficient and simple method for the thionation of ketones to thioketones using P4S10/Al2O3. Tetrahedron Letters, 2004, 45(33), S. 6255–6257. doi:10.1016/j.tetlet.2004.06.091.
- Mloston, G. & Heimgartner, H.(2002): Thiocarbonyl Ylides. In Pearson, W.H. (Hrsg.): The Chemistry of heterocyclic compounds: Synthetic Applications of 1,3-Dipolar Cycloaddition Chemistry toward Heterocycles and natural products. New York: Wiley. S. 315–360. doi:10.1021/ja025264v.
- Eintrag zu Trithiane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2020.
- König, B. et al.: Organische Schwefelverbindungen, 8. Mitteilung: Bildung von Thiophenen durch Pyrolyse von Dihydrothiopyranen, Reaktionen der Diels-Alder-Addukte aus Thioflurenon und 1,3-Butadienen in der Hitze und unter Elektronenstoß. Chemische Berichte, 1974, Bd. 107. S. 2931–2937, doi: 10.1002/cber.19741070916.
- Kellogg, Richard M.: The molecules R2CXCR2 including azomethine, carbonyl and thiocarbonyl ylides. Their syntheses, properties and reactions. Tetrahedron, 1976, 32(18), S. 2165–2184. doi:10.1016/0040-4020(76)85131-9.
- Sustmann, R. et al.: A Computational Study of the Cycloadditions of Thiobenzophenone S-Methylide to Thiobenzophenon. Journal of the American Chemical Society, 2003, 125(47), S. 314425–14434. doi:10.1021/ja0377551.
- Huisgen, R., et al.: Recent developments of the chemistry of thiocarbonyl ylides. Bulletin des Sociétés Chimiques Belges, 1984, 93(7), S. 511–532. doi:10.1002/bscb.19840930701.
- Sheppard, W.A. & Diekmann, J.: Sulfines. Journal of the American Chemical Society, 1964, 86(9), S. 1891–1892. doi:10.1021/ja01063a075.
- Wedekind, E. & Schenk, D.: Über das Verhalten von Sulfochloriden gegen starke Tertiärbasen. Berichte der deutschen chemischen Gesellschaft, 1911, 44(1), S. 198–202. doi:10.1002/cber.19110440129.
- Hellwinkel, D. (2006): Die systematische Nomenklatur der organischen Chemie: Eine Gebrauchsanweisung. 5. Auflage. Berlin: Springer. S. 113–146. ISBN 3-540-26411-6.
- King, J. F., Marty, R. A., De Mayo, P., & Verdun, D. L.: Organic sulfur mechanisms. XI. Flash thermolysis. VII. Reactivity and infrared spectrum of sulfene. Journal of the American Chemical Society, 1971, 93(23), S. 6304–6305. .
- Sander, W., Kirschfeld, A. & Halupka, M.: Matrix Isolation of Diphenylsulfene and Diphenyl-α-sultine. Journal of the American Chemical Society, 1997, 119(5), S. 981–986. doi:10.1021/ja962949k.
- Mayer, R., Scheithauer, S. & Kunz, D.: Clemmensen-Reduktion und Halbstufenpotentiale einiger Thiocarbonsauren und Abkömmlinge . Chemische Berichte, 1966, 99(4), S. 1393–1413. doi:10.1002/cber.19660990449
- Metzner, P. (1999): Thiocarbonyl compounds as specific tools for organic synthesis. In Page, P.C.B (Eds.): Organosulfur Chemistry I. Berlin: Springer. S. 127–181, ISBN 3-540-65787-8.