Thioessigsäure
Thioessigsäure ist eine organische Verbindung. Sie hat dieselbe Struktur wie die Essigsäure, jedoch ist das Sauerstoffatom der Hydroxygruppe durch Schwefel ersetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
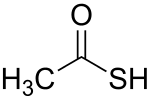 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thioessigsäure | ||||||||||||||||||
| Andere Namen |
Thiolessigsäure | ||||||||||||||||||
| Summenformel | C2H4OS | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit penetrantem stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 76,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,07 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
86–88 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
3,33 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit |
27 g·l−1 in Wasser (15 °C) bei langsamer Zersetzung[3] | ||||||||||||||||||
| Brechungsindex |
1,4648 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−216,9 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Eigenschaften
Thioessigsäure hat einen niedrigeren Siedepunkt als Essigsäure. Thioessigsäure ist eine farblose bis gelbe, an der Luft rauchende Flüssigkeit mit stechendem, unangenehmem, in ausreichender Verdünnung fruchtigen Geruch. Ihre Dämpfe reizen und schädigen die Augen, die Atemwege und die Lunge sowie die Haut.[6]
Synthese
Beim Erhitzen von Eisessig mit Phosphor(V)-sulfid entsteht Thioessigsäure. Alternativ kann Thioessigsäure aus Essigsäureanhydrid und Schwefelwasserstoff hergestellt werden.[7] Eine Synthese aus Acetylchlorid und Schwefelwasserstoff ist ebenfalls beschrieben.[8]
Verwendung
Sie wird in der Organischen Chemie für die Einführung von Thiolgruppen in Moleküle genutzt. Des Weiteren dient sie auch zur Vernichtung von Peroxiden als Alternative zu wässrigen Reduktionsmitteln.
Einzelnachweise
- Eintrag zu Thioessigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dissociation Constants of Organic Acids and Bases, S. 8-42.
- Datenblatt Thioessigsäure (PDF) bei Merck, abgerufen am 24. April 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-484.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- Römpp Chemie Lexikon, Thieme Verlag Stuttgart, 9. Auflage, Band 6, S. 4585.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1602, ISBN 978-0-911910-00-1.
- Alfons Schöberl und Annemarie Wagner in Houben-Weyl Methoden der Organischen Chemie, herausgegeben von Eugen Müller, Otto Bayer, Hans Meerwein und Karl Ziegler, Band 9, Schwefel-, Selen- und Tellur-Verbindungen, Thieme Verlag, Stuttgart, 1955, dort 741–771.


