Peroxycarbonsäuren
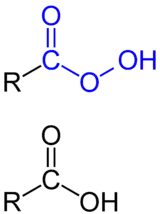
Als Peroxycarbonsäuren – auch Persäuren genannt – bezeichnet man Vertreter einer Stoffgruppe organischer Verbindungen, die eine Peroxycarboxylgruppe (Peroxycarbonsäurengruppe) als funktionelle Gruppe enthalten. Alle Peroxycarbonsäuren enthalten eine freie Hydroperoxidgruppe (HOO-Gruppe) und können deshalb als Acyl-Hydroperoxide aufgefasst werden.[1] Wie die meisten Peroxide, sind die Peroxycarbonsäuren in reiner oder hochkonzentrierter Form explosiv. Mit steigender Kettenlänge sinkt die Explosionsfähigkeit. Kurzkettige aliphatische Peroxycarbonsäuren sind bis ~C6 wasserlöslich, danach überwiegt der wasserunlösliche (lipophile) Teil des Moleküls. Aromatische Peroxycarbonsäuren sind in organischen Lösungsmitteln besser löslich als in Wasser.
Herstellung
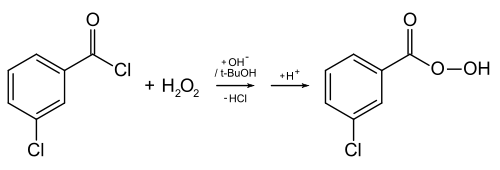
Peroxycarbonsäuren werden aus Carbonsäuren und Wasserstoffperoxid dargestellt (Rückreaktion Gleichung 2 unter Reaktionen). Vor allem aromatische Peroxycarbonsäuren werden aus Carbonsäurechloriden und Wasserstoffperoxid in basischem Milieu dargestellt.
Peroxycarbonsäuren entstehen auch durch Autoxidation von Aldehyden.
Reaktionen
Peroxycarbonsäuren sind meist instabil und werden deshalb bei Synthesen erst während der Reaktion aus der Carbonsäure und Wasserstoffperoxid hergestellt (In situ). Eine Ausnahme bildet meta-Chlorperbenzoesäure, die kristallin und stabil ist.
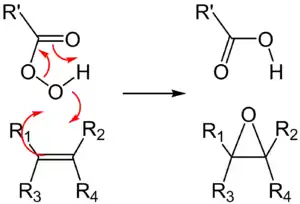
Peroxycarbonsäuren und Alkene können bei Raumtemperatur zu Epoxiden reagieren (Prileschajew-Reaktion). Neben dem Epoxid entsteht eine Carbonsäure. Häufig wird als Peroxycarbonsäure meta-Chlorperbenzoesäure (MCPBA) eingesetzt. Andere Peroxycarbonsäuren, die zur Epoxidierung eingesetzt werden können, sind Peroxyameisensäure und Peroxyessigsäure.
Peroxycarbonsäuren dienen als Oxidationsmittel, zum Beispiel bei Baeyer-Villiger-Oxidationen.
Peroxycarbonsäuren sind schwache Säuren und gehen als solche Säure-Base-Reaktionen ein. Ihre Salze können zur Reinigung und Isolierung verwendet werden.
.svg.png.webp)
Literatur
- Christian Caspari: Die Chemie Organischer Peroxide unter besonderer Berücksichtigung von Sicherheitsaspekten. 26. April 1998 (grin.com [PDF; 400 kB; abgerufen am 21. März 2007] Facharbeit).
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 4: M–Pk. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1985, ISBN 3-440-04514-5, S. 3068.