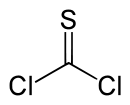
Thiophosgen
Thiophosgen ist eine orangerote bis rote übelriechende Flüssigkeit. Es ist das Schwefelanalogon (Thioverbindung) des Phosgens und kann zu analogen Reaktionen, wie zum Beispiel der Einführung einer Thiocarbonylgruppe, herangezogen werden. Da man Arbeiten mit gasförmigem Phosgen seiner hohen Giftigkeit wegen nach Möglichkeit vermeiden möchte, bietet sich der Einsatz des flüssigen Thiophosgens aus Gründen der leichteren Handhabung und des geringeren apparativen Aufwands oftmals an.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thiophosgen | |||||||||||||||
| Andere Namen |
Thiocarbonyldichlorid | |||||||||||||||
| Summenformel | CCl2S | |||||||||||||||
| Kurzbeschreibung |
rote bis orangerote Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,98 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser und Alkoholen[1] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Thiophosgen kann aus Trichlormethansulfenylchlorid und Eisen(III)-chlorid als Katalysator in Xylol bei 140 °C synthetisiert werden.[2][5]
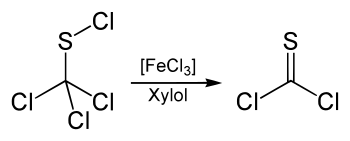
Die Reaktion kann ebenfalls in Benzol oder Toluol mit Zinkchlorid oder Aluminiumchlorid als Katalysator durchgeführt werden.
Eigenschaften
Thiophosgen ist eine rote, übelriechende und giftige Flüssigkeit.[2] In Wasser hydrolysiert die Verbindung zu Salzsäure und Kohlenoxidsulfid, welches weiter zu Schwefelwasserstoff und Kohlendioxid reagiert.[2]
Die Hydrolyse verläuft wesentlich langsamer als beim Phosgen.[2] Beim Erhitzen von Thiophosgen erfolgt eine Disproportionierung zu Schwefelkohlenstoff und Tetrachlormethan.[2]
Thiophosgen reagiert teils heftig und stark exotherm mit nukleophilen Lösungsmitteln wie z. B. Alkoholen, Aminen sowie Säuren und Basen.[6] Photochemisch kann die Verbindung zum 2,2,4,4-Tetrachlor-1,3-dithietan dimerisiert werden.[2][7][8]
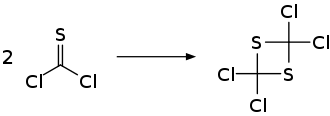
Thiophosgen bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 63 °C.[2]
Verwendung
Thiophosgen wird für die Herstellung von Farbstoffen, Pestiziden, Fungiziden oder Nematiziden eingesetzt. Früher wurde es auch für die Herstellung chemischer Kampfstoffe verwendet.[2] In der organischen Synthesechemie dient es als Reagenz zur Herstellung von Thiocarbonylverbindungen. Mit Aminen reagiert es zu Isothiocyanaten, substituierten Thioharnstoffen oder Thiocarbamoylchloriden.[2][9]
Die Reaktion mit 1,2-Diolen ermöglicht in einer Corey-Winter-Eliminierung die stereoselektive Herstellung von Alkenen.[2][9]
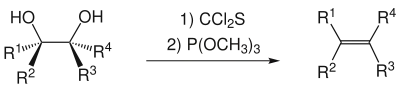
Die Verbindung kann auch als Dienophil in Diels-Alder-Reaktionen reagieren.[2][9] Mit Bisphenol A ergeben sich Polythiocarbonate.[2]
Toxikologie
Thiophosgen ist eine hochgiftige und ätzende Verbindung. Die Dämpfe wirken stark reizend auf die Augen, die Atemwege, die Lunge und die Haut. Die Ausbildung von Lungenödemen ist möglich.[2] Die Verbindung ist ein Lungenreizstoff. Eine Inhalation kann zu lebensbedrohlichen Zuständen führen.[6] Der Kontakt mit der Flüssigkeit verursacht eine sehr starke Reizung der Haut oder der Augen. Es wird eine Resorption von lebensbedrohlichen Dosen über die Haut angenommen, was im Umgang strengste Hautschutzmaßnahmen erforderlich macht.[2]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Sharma, S.: Thiophosgene in Organic Synthesis. In: Synthesis, 11, 1978, 803–820; doi:10.1055/s-1978-24896 (Übersichtsartikel in Englisch, freier Volltext)
Einzelnachweise
- Eintrag zu Thiophosgen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Thiophosgen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. November 2017.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-88.
- Eintrag zu Thiocarbonyl chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Patent US2668853: Production of thiophosgene. Angemeldet am 12. Oktober 1950, veröffentlicht am 9. Februar 1954, Anmelder: Sharples Chemicals, Erfinder: Edward F. Orwoll.
- L. Roth, U. Weller: Gefährliche Chemische Reaktionen, Eintrag für Thiophosgen, Stand 81. Ergänzungslieferung 4/2017, ecomed Verlag Landsberg/Lech, ISBN 978-3609195872.
- Schönberg, A.; Stephenson, A.: Über die Konstitution des photodimeren Thiophosgens (23. Mitteil. über organische Schwefelverbindungen) in Ber. deutsch. chem. Ges. 66B (1933) 567–571, doi:10.1002/cber.19330660425.
- Krebs, B.; Beyer, H.: Die Kristall‐ und Molekelstruktur des dimeren Thiophosgens in Z. anorg. allg. Chem. 365 (1969) 199–210, doi:10.1002/zaac.19693650315.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Thiophosgene, doi:10.1002/047084289X.rt103.pub2
