Azide
Als Azide bezeichnet man die Salze und organischen Verbindungen der Stickstoffwasserstoffsäure. Sie gehören zu den Pseudohalogeniden. Viele Azide sind sehr giftig. Die löslichen Salze hemmen irreversibel das Enzym Cytochrom-C-Oxidase der Atmungskette in Zellen.
Schwermetallazide sind hochexplosiv, die Azide der Alkali- und Erdalkalimetalle hingegen verpuffen nur bei starker Hitzeeinwirkung, nachdem sie bereits geschmolzen sind.
Die bedeutendsten ionischen Azide sind Natriumazid und Bleiazid.
Anorganische Azide
Natriumazid
Natriumazid ist eine farblose, in Wasser lösliche Verbindung. Das Natriumazid wird stark verdünnt als Konservierungsmittel verwendet, zum Beispiel bei der Verarbeitung von leicht verderblichen Substanzen wie Insulin, und als Ausgangsstoff, zur Herstellung weiterer Azide und der freien Stickstoffwasserstoffsäure. Außerdem wird es in der Iod-Azid-Reaktion zum Nachweis von zweiwertigem Schwefel in Sulfiden und Thioethern eingesetzt. Weiterhin wird es in Airbags zum Füllen des Sackes verwendet. Die Zersetzung kann durch Erwärmen oder einen elektrischen Impuls (bei Airbags) ausgelöst werden und verläuft nach der folgenden stöchiometrischen Gleichung:
Bleiazid
Bleiazid ist in kaltem Wasser unlöslich und gegen Wärme und Feuchtigkeit beständig. Beim langsamen Abkühlen aus heißen, wässrigen Lösungen entstehen lange Kristalle, die schon bei Zerbrechen unter Wasser detonieren. Deshalb wird bei der technischen Herstellung durch Zugabe von wenig Dextrin und Rühren die Bildung größerer Kristalle strikt vermieden. Sein Detonationspunkt liegt bei 350 °C. Hergestellt wird es durch eine Fällung von Natriumazid mit einer wasserlöslichen Bleisalz-Verbindung wie Bleiacetat. Bleiazid wird, in Mischung mit Bleitrinitroresorcinat, als Initialzünder verwendet. Letzteres dient zur Erhöhung der Funkenempfindlichkeit, da der Detonationspunkt des Azides hoch ist.
Silberazid
Silberazid ist im Gegensatz zu Bleiazid bei Lichteinwirkung deutlich instabiler und verfärbt sich in Analogie zur klassischen Photographie unter Verwendung von Silberhalogeniden schnell tiefviolett. Für Demonstrationsversuche ist es besser geeignet als Bleiazid, da es auch in heißem Wasser völlig unlöslich ist und sich immer in feinsten Kristallen abscheidet. Die Schlagempfindlichkeit ist nicht größer als beim Bleiazid. Durch den hohen Preis ist aber die Anwendungsmöglichkeit als technisch verwendeter Initialzünder sehr eingeschränkt.
Kupferazid
Kupferazid ist extrem brisant und explodiert oft schon bei Berührung. Es findet daher keine technische Anwendung und ist auch als Initialzünder ungeeignet.
Siliciumtetraazid
Siliciumtetraazid ist eine thermisch instabile, kovalente Silicium-Stickstoff-Verbindung mit einem Stickstoffgehalt von 85,7 %. Die hochenergetische, kristalline Substanz neigt schon ab 0 °C zu einer spontanen explosiven Zersetzung.[1] Eine weitere Koordination zur sechsfach koordinierten Struktur wie in Hexaazidosilicaten [Si(N3)6]2−[2] oder in Addukten mit zweiwertigen Liganden Si(N3)4L2[3] führt zu relativ stabilen, kristallinen Feststoffen, die bei Raumtemperatur normal gehandhabt werden können.
Bortriazid
Bortriazid (bzw. Triazidoboran) ist eine thermisch instabile Bor-Stickstoff-Verbindung mit einem Stickstoffgehalt von 92,1 %. Die farblosen Kristalle können oberhalb von −35 °C explosionsartig zerfallen. Die Umsetzung mit Aziden, wie Natriumazid oder Lithiumazid ergibt die entsprechenden Tetraazidoboratkomplexe.[4]
Organische Azide
Es gibt viele organische Verbindungen mit einer Azidogruppe (–N3), die somit als organische Azide bezeichnet werden. Methylazid ist der einfachste Vertreter der organischen Azide. Das vierfach substituierte Methanderivat Tetraazidomethan ist eine thermisch instabile Flüssigkeit mit einem Stickstoffgehalt von 93,3 %. Die hochenergetische, zu einer spontanen explosiven Zersetzung neigende Substanz wurde erstmals 2006 hergestellt.[5] Bekannt ist der Arzneistoff Azidothymidin (AZT).
Carbonsäureazide [R–CO–N3] finden Anwendung in der Curtius-Umlagerung, in der sie zu Isocyanaten umgelagert werden. Eine andere wichtige Reaktion der Azide stellt die 1,3-dipolare Cycloaddition (Huisgen-Reaktion) dar.[6] Bekannt seit den 1960er-Jahren, gewinnt sie zunehmend an Bedeutung als bioorthogonale Reaktion.[7][8] Die Reduktion von Alkylaziden (etwa mit Lithiumaluminiumhydrid) liefert primäre Amine; der Weg über Azide stellt damit eine Alternative zur Gabriel-Synthese dar.
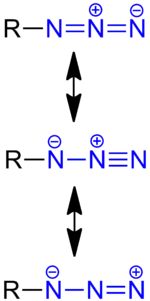
Um die Bindung der Azidgruppe im Rahmen des Valenzbindungsformalismus trotz der Delokalisierung der Bindungselektronen beschreiben zu können, behilft man sich mit mesomeren Grenzformeln. Dabei spielen neben jenen beiden Grenzstrukturen, die die heuristische Oktettregel erfüllen, auch solche eine Rolle, die dies nicht tun, wie die gezeigte 1,3-dipolare Struktur, bei der dem endständigen N-Atom formal ein Sextett zugeschrieben wird. Anhand dieser Grenzformel lässt sich sowohl die leichte Zersetzung zu den entsprechenden Nitrenen als auch die Reaktivität als 1,3-Dipol erklären.[9] Im Rahmen der Molekülorbitaltheorie liefern Berechnungen auf Grundlage der Hartree-Fock-Methode entsprechende Ladungsverteilungen: Sowohl für das innere als auch für das äußere N-Atom ergeben sich negative Partialladungen, für das mittlere dagegen positive. Allerdings ist die negative Partialladung am inneren N-Atom stets deutlich stärker ausgeprägt als am äußeren (bei organischen Aziden ca. −0,3 e ggü. schwächer als −0,1 e; am mittleren ca. +0,2 e).[10]
Literatur
- S. Bräse, C. Gil, K. Knepper, V. Zimmermann: Organische Azide – explodierende Vielfalt bei einer einzigartigen Substanzklasse. In: Angewandte Chemie, Bd. 117, (2005), S. 5320–5374. doi:10.1002/ange.200400657
Einzelnachweise
- E. Wilberg, H. Michaud: Zur Kenntnis eines Siliciumtetrazids Si(N3)4. In: Zeitschrift für Naturforschung B. 9, 1954, S. 500 (online).
- A.C. Filippou, P. Portius, G. Schnakenburg: The Hexaazidosilicate(IV) Ion: Synthesis, Properties, and Molecular Structure. In: J. Am. Chem. Soc. 124, 2002, S. 12396–12397, doi:10.1021/ja0273187.
- P. Portius, A.C. Filippou, G. Schnakenburg, M. Davis, K.-D. Wehrstedt: Neutrale Lewis-Basen-Addukte des Siliciumtetraazids. In: Angew. Chem. 122, 2010, S. 8185–8189, doi:10.1002/ange.201001826.
- E. Wiberg, H. Michaud: Zur Kenntnis eines Bortriazids. In: Z. Naturforsch. B. Band 9, 1954, S. 497–499. doi:10.1515/znb-1954-0715 (abgerufen über De Gruyter Online).
- K. Banert, Y.-H. Joo, T. Rüffer, B. Walfort, H. Lang: Die aufregende Chemie des Tetraazidomethans. In: Angew. Chem. 119, 2007, S. 1187–1190, doi:10.1002/ange.200603960.
- R. Huisgen, R. Grashey, J. Sauer: In: Chemistry of Alkenes, Interscience, New York, 1964, S. 806–877.
- D. Amantini, F. Fringuelli, O. Piermatti, F. Pizzo, E. Zunino, L. Vaccaro: In: J. Org. Chem. 70, 2005, S. 6526–6529.
- V. V. Rostovtsev, L. G. Green, V. V. Fokin, K. B. Sharpless: In: Angew. Chem. 114, 2002, S. 2708–2711.
- Stefan Bräse, Carmen Gil, Kerstin Knepper, Viktor Zimmermann: Organische Azide – explodierende Vielfalt bei einer einzigartigen Substanzklasse. In: Angewandte Chemie, 2005, Band 117, S. 5320–5374, doi:10.1002/ange.200400657.
- Š. Sklenák, A. Gatial, S. Biskupič: Ab initio study of small organic azides. In: Journal of Molecular Structure: THEOCHEM, 1997, Band 397, Nr. 1–3, S. 249–262, doi:10.1016/S0166-1280(96)04945-7.