Diazoverbindungen
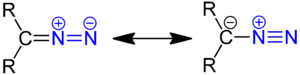
Diazoverbindungen sind eine Stoffgruppe organisch-chemischer Verbindungen mit der allgemeinen Strukturformel R1R2C=N=N; dabei sind R1 und R2 kohlenstoffhaltige Reste oder Wasserstoff. Die einfachste Diazoverbindung ist Diazomethan. Die Diazoverbindungen wurden 1858 von Peter Grieß entdeckt.
Eigenschaften
Diazoverbindungen sind isolierbare, aber sehr reaktive giftige Verbindungen, die oft als Synthesezwischenstufen dienen. Einfache Diazoverbindungen sind flüchtig und explosiv. Diazoverbindungen besitzen mit N2 eine sehr gute Abgangsgruppe (Bildung von gasförmigem Stickstoff). Reaktionen mit Diazoverbindungen müssen bei tiefen Temperaturen durchgeführt werden, da sich Diazoverbindungen sehr leicht zersetzen (Abspaltung von N2). Aromatische Diazoverbindungen sind meist stabiler als aliphatische. Sie zeigen einen stabilen, internen Dipolcharakter, der sich durch zwei mesomere Grenzstrukturen beschreiben lässt; dabei ist eine ein Ylid.
Verwendung in Reaktionen
Diazoverbindungen können als Alkylierungsmittel z. B. bei Veresterungen oder zur Bildung von Ethern eingesetzt werden, aufgrund ihres hohen Preises und da sie schwierig zu handhaben sind, meist jedoch nur im Labor.
So dient z. B. Diazomethan als Methylierungsmittel für Verbindungen mit genügend acidem Wasserstoff:
- RCO2H + H2CN2 → RCO2CH3 + N2
Bei der Reaktion wird im ersten Schritt das acide Proton auf das Diazomethan übertragen, das ein Methandiazonium-Ion [H3C–N2]+ bildet. Ein Nukleophil oder wie in diesem Fall ein Anion RCO2− reagiert weiter unter Abspaltung von N2.
Alkohole mit Substituenten, die einen −I-Effekt zeigen, welche die Acidität der OH-Gruppe erhöhen, können relativ leicht mit Diazomethan reagieren. Nicht-aktivierte Alkohole lassen sich jedoch nicht direkt oder nur in Gegenwart von Silikagel methylieren.
Wichtig sind Diazoverbindungen auch als Quelle für Carbene, die durch die Abspaltung von N2 gebildet werden.
- RR'CN2 → RR'C: + N2
Herstellung
Diazoverbindungen werden aufgrund ihrer Instabilität meist in situ, d. h. direkt vor der eigentlichen Reaktion, hergestellt.
- Diazomethan aus N-Methyl-N-nitroso-p-toluolsulfonamid
- Tol-SO2–N(NO)CH3 + KOH → H2CN2 + Tol-SO3−K+ + H2O
Das entstehende Diazomethan wird kontinuierlich abdestilliert.
- Nitrosierung von Glycinester (vgl. Azokupplung)
- ROOC-CH2-NH2 + NO+ → ROOC-CHN2
- Oxidation von Hydrazonen
- RR′C=N–NH2 + OxMittel → RR′CN2
Diese Variante eignet sich für aromatische Verbindungen. Als Oxidationsmittel kommt z. B. PbO2, Ag2O, CrO2 oder HgO zum Einsatz.
Literatur
- R. Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akad. Verlag, 2004, ISBN 3-8274-1579-9.
- Peter Grieß: Vorläufige Notiz über die Einwirkung von salpetriger Säure auf Amidinitro- und Aminitrophenylsäure. In: Annalen der Chemie und Pharmacie. Band 106, Nr. 1, 1858, S. 123–125, doi:10.1002/jlac.18581060114.
- Walter Bayer: Lehrbuch der org. Chemie. 24. Auflage. 2004.