En-Reaktion
Die En-Reaktion, auch Alder-En-Reaktion genannt, ist eine chemische Reaktion aus dem Bereich der Organischen Chemie. Es handelt sich um eine pericyclische Reaktion, bei der ein Alken, welches ein Wasserstoff in allylischer Position trägt, mit einer Verbindung, die eine Mehrfachbindung besitzt, umgesetzt wird. Die Alkenkomponente wird kurz als En, die zweite Komponente als Enophil bezeichnet. Die Reaktion wurde erstmals 1943 von Kurt Alder beschrieben.[1]
En-Reaktionen benötigen zur Aktivierung eine erhöhte Reaktionstemperatur oder eine Lewis-Säure. Elektronenarme Enophile begünstigen die Reaktion, da sie den Angriff des Ens am Enophil erleichtern (Vergleiche auch Dien und Dienophil in der Diels-Alder-Reaktion). Ein gutes Enophil ist beispielsweise Maleinsäureanhydrid, dessen Doppelbindung durch die elektronenziehenden Effekte zweier Carbonylfunktionen sehr elektronenarm ist.
Allgemeines
An der En-Reaktion sind vier π-Elektronen beteiligt. Formal wird eine π-Bindung zugunsten einer σ-Bindung gelöst. Sie wird durch elektronenreiche Ene und elektronenarme Enophile begünstigt. Sie verläuft schlechter, je höher der Substitutionsgrad in der allylischen Position, die das zu übertragende Proton trägt, ist.
Intramolekulare En-Reaktionen verlaufen in den meisten Fällen glatter als intermolekulare. Es können klassische Lewis-Säuren wie Aluminiumchlorid oder Bortrifluorid verwendet werden. Die Reaktion selbst verläuft dann trotzdem noch konzertiert, da die Lewis-Säure nur der Aktivierung des Enophils dient.
Enophile sind nicht auf den Einsatz von Alkenen beschränkt. Auch Alkine oder heteroatomtragende Gruppen, die eine Mehrfachbindung besitzen, können verwendet werden.
Mechanismus
Die En-Reaktion verläuft konzertiert. Es erfolgt eine Bindungsbildung zwischen einem Kohlenstoffatom der Doppelbindung 1 und dem Enophil 2 unter Übertrag des allylischen Wasserstoffs auf 2. Als Produkt entsteht ein substituiertes Alken 3.

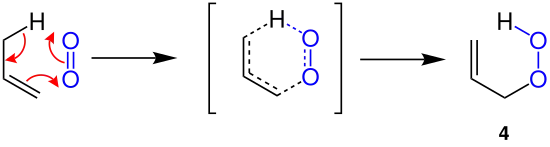
Die Reaktion von Sauerstoff als Enophil liefert ein analoges Produkt 4, jedoch wird ein konzertierter Mechanismus für diese Reaktion stark angezweifelt.[2]
Varianten
Hetero-En-Reaktionen
Neben der klassischen Reaktion mit einem Alken als Enophil, können auch Gruppen dienen, die Heteroatome tragen. Hierzu zählen hauptsächlich Carbonylverbindungen, aber auch Reaktionen mit funktionellen Gruppen, die mehrfach gebundene Stickstoff- oder Schwefelatome tragen, sind beschrieben. Werden Carbonylverbindungen verwendet, spricht man auch von einer Carbonyl-En-Reaktion. Ein Beispiel zeigt die Reaktion von Citronellal 1 mit Niob(V)-chlorid als Katalysator. Dabei entsteht das Produkt 2.[3]

Conia-En-Reaktion
Die Conia-En-Reaktion ist eine intramolekulare Variante mit enolisierbaren Ketonen oder Estern als enophile Komponente.[4][5] β-Dicarbonyle bieten gegenüber Monocarbonylen Reaktivitätsvorteile. Cyanoacetate, Sulfonylacetate oder Phosphonoacetate sind gleichermaßen einsetzbar.
Retro-En-Reaktion
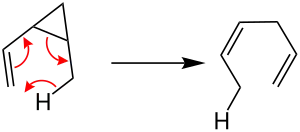
Die Retro-En-Reaktion tritt meist als intramolekulare Reaktion auf. Sie verläuft invers der En-Reaktion und tritt meist dann auf, wenn eine hohe Ringspannung, beispielsweise durch einen Cyclopropylring im Startmaterial vorhanden sind, die so abgebaut werden können.
En-Reaktion mit inversem Elektronenbedarf
Ähnlich der Diels-Alder-Reaktion können auch En-Reaktionen mit inversem Elektronenbedarf auftreten. Dies bedeutet, dass ein elektronenarmes En mit einem elektronenreichen Enophil umgesetzt wird. Ungleich der Diels-Alder-Reaktion sind diese En-Reaktionen jedoch sehr selten anzutreffen.
Schenck-En-Reaktion
Die Schenck-En-Reaktion, oder auch kurz Schenck-Reaktion, benannt nach Günther Otto Schenck, ist eine Variante der En-Reaktion, bei der als Enophil 1 Singulett-Sauerstoff eingesetzt wird. Dies ermöglicht die Synthese von Hydroperoxiden (blau markiert) 2.[6][7]

Einzelnachweise
- K. Alder, F. Pascher, A. Schmitz in: Ber. Dtsch. Chem. Ges. 1943, 76, S. 27–53.
- Michael B. Smith: March’s Advanced Organic Chemistry, 7. Auflage, Wiley, 2013, ISBN 978-0-470-46259-1, S. 834.
- Carlos Kleber Z. Andrade, Otilie E. Vercillo, Juliana P. Rodrigues, Denise P. Silveira: Intramolecular ene reactions catalyzed by NbCl5, TaCl5 and InCl3; in: J. Braz. Chem. Soc. 2004, 15, 6, S. 813–817; doi:10.1590/S0103-50532004000600005.
- J. M. Conia, P. Le Perchec: The thermal cyclisation of unsaturated carbonyl compounds. In: Synthesis. 1, Nr. 1, 1975, S. 1–19. doi:10.1055/s-1975-23652.
- Portal für organische Chemie.ch
- Günther O. Schenck: Zur Theorie der photosensibilisierten Reaktion mit molekularem Sauerstoff; in: Naturwissenschaften 1948, 35, S. 28–29.
- Michael Prein, Waldemar Adam: Die Schenck‐En‐Reaktion: eine diastereoselektive Oxyfunktionalisierung mit Singulettsauerstoff für präparative Anwendungen; in: Angew. Chem. 1996, 108, S. 519–538; doi:10.1002/ange.19961080505.
Literatur
- Thomas Laue, Andreas Plagens: Namen- und Schlagwortreaktionen der Organischen Chemie, Vieweg + Teubner, 5. Auflage, 2006, ISBN 978-3-8351-0091-6, S. 114–118.