Oxime
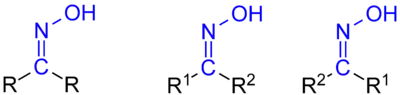
Oxime sind Derivate von Aldehyden oder Ketonen, die als funktionelle Gruppe die Gruppierung C=N–OH enthalten. Der Name wird gebildet mit den Silben Oxi- und Im und weist damit auf ein oxidiertes Imin hin. Die Oxime werden gebildet durch Reaktionen von Hydroxylaminen, mit Aldehyden oder Ketonen. Je nach Art der Reste am C-Atom unterscheidet man
- Ketoxime
- Beide Reste (R1, R2) sind organische Reste: R1R2C=N-OH
- Aldoxime
- Einer der beiden Reste ist ein H-Atom: RHC=N-OH
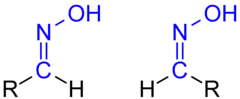
Das einfachste Oxim ist das Formaldoxim, bei welchem beide Reste Wasserstoffatome sind.
Nach IUPAC ist die Namensgebung auch durch Voranstellen von „Hydroxyimino-“ erlaubt.
Herstellung
Übersichtsreaktion
Oxime kann man aus Hydroxylamin oder dessen Hydrochlorid und Carbonylverbindungen wie Aldehyden und Ketonen unter saurer Katalyse in einer Kondensationsreaktion erhalten.
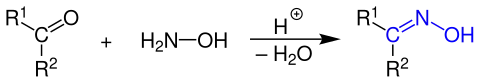
Wird ein Aldehyd eingesetzt, so ist mindestens einer der Reste R1 oder R2 ein Wasserstoff-Atom, der andere Rest kann entweder ebenfalls ein Wasserstoff-Atom oder aber eine Organylgruppe (Alkyl-, Aryl-, Alkylarylgruppe usw.) sein. Setzt man Ketone ein, so stellen beide Reste R1 oder R2 eine Organylgruppe dar.
Reaktionsmechanismus
Das nachfolgende Reaktionsschema zeigt die Bildung eines Oxims aus einer allgemeinen Carbonylverbindung und Hydroxylamin unter sauren Bedingungen. Dabei können Aldehyde (R1 = Organyl-Rest, R2 = H-Atom) oder Ketone (R1 = R2 = Organyl-Rest) eingesetzt werden:

Die Oxim-Bildung beginnt mit dem nukleophilen Angriff der Amino-Gruppe des Hydroxylamins (2) auf das elektrophile, positiv polarisierte Kohlenstoff-Atom der Carbonylverbindung (1), wodurch zunächst das Additionsprodukt (3) gebildet wird. Es erfolgt rasch eine Umprotonierung, wodurch ein N-Hydroxy-Halbaminal (4) entsteht. Unter sauren Katalyse wird dieses an der Hydroxy-Gruppe, welche an das ehemalige Carbonylkohlenstoff-Atom gebunden ist, protoniert. Eine nachfolgende Eliminierung von Wasser liefert ein Carbenium-Ion (6), welches über ein N-Hydroxyiminium-Ion (7) mesomer stabilisiert ist. Die abschließende Abspaltung des katalytisch aktiven Protons führt zum gewünschten Oxim (8). Anzumerken ist, dass es sich bei all diesen Schritten um reversible Gleichgewichtsreaktionen handelt.[1]
Isomerie
Von allen Aldoximen (außer Formaldoxim) und unsymmetrischen Ketoximen (d. h. R1 ≠ R2) existieren zwei unterschiedliche Isomere, die (E)- oder (Z)-Form, die unterschiedlich reaktiv sind.[2] Die (E)-Form wird auch trans-Form, die (Z)-Form als cis-Form bezeichnet.
Verwendung
1,2-Dioxime werden als Chelatbildner eingesetzt. Mit Dimethylglyoxim lassen sich Nickel(II)-ionen als wasserunlöslicher, leuchtend himbeerfarbener Komplex nachweisen. Durch Oximtitration lassen sich Aldehyde und Ketone quantitativ nachweisen.
Formaldoxim dient zur Komplexierung von Metallionen für photometrische Bestimmungen.
Oxime werden als Antihautmittel (engl.: anti-skinning agents) verwendet. Diese auch als Retarder oder Hautverhütungsmittel bezeichneten Stoffe verhindern die Hautbildung bei der Lagerung von Lacken. Verwendet werden hierzu meist flüchtige Oxime wie Acetonoxim oder 2-Butanonoxim.
Des Weiteren sind Oxime in der organischen Synthese interessant, da sie sich leicht zum Amin reduzieren lassen. Aldoxime können zu Nitrilen dehydratisiert oder zu Nitriloxiden oxidiert werden. Das industriell wichtigste Oxim ist Cyclohexanonoxim, das in einer Beckmann-Umlagerung in Gegenwart eines sauren Katalysators zu Caprolactam, einem Zwischenprodukt für die Herstellung von Polyamiden, reagiert.
Ketoxime können am Sauerstoffatom tosyliert werden und reagieren anschließend durch Baseneinwirkung in einer Neber-Umlagerung zum alpha-Aminoketon.
Einige Oxime finden Anwendung bei der Therapie von Vergiftungen mit Phosphorsäureestern, wie zum Beispiel mit dem Pflanzenschutzmittel E605 oder militärischen Nervengiften wie Sarin, Tabun, Soman oder VX. Die Giftwirkung dieser Phosphorsäureester beruht auf einer irreversiblen Hemmung (Phosphorylierung) des esteratischen Zentrums der Acetylcholinesterase und führt damit zunächst zu einer Acetylcholin-Überflutung des Körpers. Im Folgenden kommt es durch ständige Nervenimpulse zu Lähmungen und letztendlich zum Tod durch Atemlähmung. Oxime wie Pralidoxim oder Obidoxim können in begrenztem Ausmaß die Acetylcholinesterase reaktivieren. Die Wirkung beruht auf einer Umphosphorylierung und Freigabe der Cholinesterase. Die Wirkung der Therapie wird durch die Art des Nervengiftes bestimmt. Die toxischen Phosphorsäureester verlieren nach Freisetzung eine Seitenkette und werden dadurch für die Wirkung des Oxims unempfindlich, bleiben aber weiterhin toxisch. VX zerfällt dabei nie. Tabun über einen längeren Zeitraum, Sarin in 3 – 5 Stunden. Soman zerfällt innerhalb von rund zwei Minuten.[3]
Halogenierte Oxime wurden zwischen den beiden Weltkriegen als Nesselstoffe zu Kampfzwecken entwickelt und gelagert.
Aus dem Oxim von 3-Nitrobenzaldehyd kann man durch Umsetzung mit Distickstofftetroxid einen Sprengstoff herstellen (Ponzio-Reaktion).
Einzelnachweise
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry. 2. Auflage. Oxford University Press, New York 2012, ISBN 978-0-19-927029-3, S. 229 f.
- Siegfried Hauptmann: Organische Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, 2. Auflage, Seite 361, ISBN 3-342-00280-8.
- Charles G. Hurst, Jonathan Newmark, James A. Romano: Chemical Terrorism, in Dan L. Longo, Anthony S. Fauci, Dennis L. Kasper, Stephen A. Hausser, J. Larry Jameson, Joseph Localzo (Hrsg.) : Harrison's Principles of Internal Medicine, 18. Auflage, Band 1, New York, S. 1786.