Reversible Reaktion
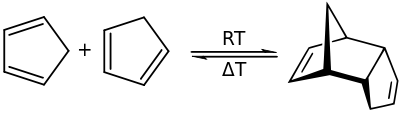
Unter einer reversiblen Reaktion versteht man eine chemische Reaktion, welche umkehrbar (von lateinisch reverti = umkehren abgeleitetes Fremdwort für umkehrbar)[1] ist. Ein Beispiel für eine reversible Reaktion ist die bei Raumtemperatur rasch ablaufende Dimerisierung von Cyclopentadien mittels einer Diels-Alder-Reaktion:[2]
Bei Temperaturerhöhung läuft die Umkehrreaktion, eine Retro-Diels-Alder-Reaktion, ab, bei welcher das Monomer zurückgebildet wird, welches dann durch Destillation aus dem Reaktionsgemisch entfernt werden kann.
Bei nahezu jeder reversiblen Reaktionen stellt sich in der Mischung ein Gleichgewicht zwischen Reaktanten (veraltet: Edukten) und Produkten ein.
Irreversible Reaktion
Das Gegenteil einer reversiblen Reaktion ist eine irreversible Reaktion (von lateinisch in = un... und revertere = umkehren)[3] welche unumkehrbar nur in eine Richtung verläuft und bei der sich auch kein Gleichgewicht einstellen kann. Ein Beispiel für eine irreversible Reaktion ist die Verbrennung von Ethanol:
Geschichte
Das Konzept der reversiblen Reaktion wurde von Claude Louis Berthollet 1803 etabliert, nachdem er beobachtet hatte, dass sich an den Rändern eines Salzsees in Ägypten Natriumcarbonat-Kristalle bildeten:[4]
Dies war die Umkehrreaktion zu einer Reaktion, welche er aus seinem Labor bereits kannte:
Bis zu diesem Zeitpunkt ging man davon aus, dass chemische Reaktionen immer nur in eine Richtung ablaufen. Berthollet folgerte, dass der hohe Überschuss an Salz im See die Reaktion in die umgekehrte Richtung zur Bildung von Natriumcarbonat verschob.[5]
Literatur
- A. Hädener, H. Kaufmann: Grundlagen der Allgemeinen und Anorganischen Chemie. Birkhäuser Verlag, Basel, 2006, ISBN 3-7643-7041-6 (Seite 100 in der Google-Buchsuche).
Einzelnachweise
- Eintrag zu Reversibel. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Januar 2012.
- Hans Peter Latscha, Uli Katzmeier, Alfons Klein: Organische Chemie Chemie-Basiswissen II. Springer Verlag, 2008, ISBN 978-3-540-77106-7 (Seite 83–84 in der Google-Buchsuche).
- Eintrag zu Irreversibel. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Januar 2012.
- How did Napoleon Bonaparte help discover reversible reactions?. Chem1 General Chemistry Virtual Textbook: Chemical Equilibrium Introduction: reactions that go both ways.
- Claude-Louis Berthollet: Essai de statique chimique, Paris, 1803. (Google books)