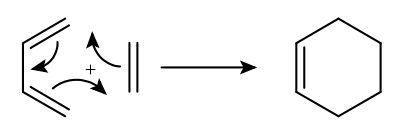
Cycloaddition
Die Cycloaddition ist eine chemische Reaktion der organischen Chemie. Es reagieren generell zwei (oder mehr) ungesättigte Systeme durch Ringschluss miteinander.[1] Man bezeichnet die Cycloadditionen meist mit einem Kürzel vor dem Namen, der angibt, wie viele -Elektronen an der Reaktion beteiligt sind. [4+2]-Cycloaddition heißt also, es sind 4 -Elektronen des einen Moleküls und 2 -Elektronen eines anderen Moleküls beteiligt. Die Atomökonomie von Cycloadditionen ist immer 100 %, da durch den konzertierten Reaktionsverlauf keine Koppelprodukte entstehen.
Die Cycloaddition ist ein Spezialfall der Pericyclischen Reaktionen. Der bekannteste und häufigste Spezialfall der Cycloaddition ist die [4+2]-Cycloaddition, darunter fällt auch die Diels-Alder-Reaktion. Zudem existieren noch die Huisgen 1,3-Dipolare Cycloaddition, die zur Herstellung von Heterocyclen nützlich ist. Die [2+2]-Cycloaddition ist ein Beispiel für eine photochemisch ablaufende Reaktion. Hierbei reagieren im Falle einer Paternò-Büchi-Reaktion ein Alken und ein Keton miteinander und bilden ein Oxetan.
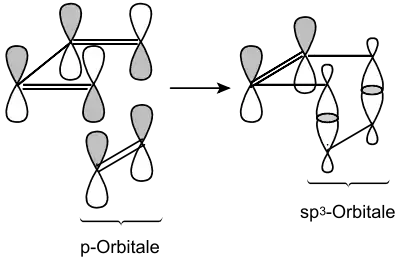
Der Ablauf dieser Reaktionen kann sowohl photochemisch als auch thermisch erfolgen, dies ist generell abhängig von der Anzahl der -Elektronen. Alle suprafacial-suprafacialen Cycloadditionen mit 4n -Elektronen (also [2+2], [4+4]) laufen immer photochemisch, alle mit 4n+2 -Elektronen [4+2] laufen immer thermisch. Im Gegensatz dazu laufen suprafacial-antarafaciale Cycloadditionen mit 4n -Elektronen (also [2+2], [4+4]) thermisch und die mit 4n+2 -Elektronen [4+2] laufen immer photochemisch. Dieser Unterschied begründet sich in der Geometrie der Reaktanten. Suprafacial bedeutet, dass beide Bindungen auf derselben Seite des Molekülorbitals gebildet werden. Antarafacial bedeutet entsprechend, die Bindung wird auf verschiedenen Seiten des Molekülorbitals gebildet. Ein Beispiel mag diesen Fall verdeutlichen:
In dem abgebildeten Fall der thermischen Diels-Alder-Reaktion erfolgt ein suprafacialer Angriff, es werden beide Bindungen auf derselben Seite des Moleküls gebildet.
Notation
Die Benennung einer Cycloadditionsreaktion kann gemäß den IUPAC-Empfehlungen auf zwei verschiedene Arten erfolgen.[1]
(i + j + …)-Cycloaddition
- Bei dieser Notation werden jeweils i und j und … aneinanderhängende Atome der reagierenden Spezies zu einem Ringsystem mit insgesamt i + j + … Atomen verknüpft. Die obige Diels-Alder-Reaktions ist demnach eine (4+2)-Cycloaddition. Die Bildung des Primärprodukts der Ozonolyse wird als (3+2)-Cycloaddition bezeichnet.
[m + n + …]-Cycloaddition
- Bei dieser bevorzugten Schreibweise sind an den reagierenden Spezies jeweils m und n und … Elektronen an der Ausbildung des Ringsystems beteiligt. Damit ist sowohl die obige Diels-Alder-Reaktion, als auch der erste Schritt der Ozonolyse eine [4+2]-Cycloaddition.
Cheletrope Reaktion
Bei cheletropen Reaktionen handelt es sich um einen Sonderfall der Cycloaddition. Bei ihnen gehen die neu geknüpften Bindungen vom selben Atom aus. Beispielhaft ist die Addition eines Carbens an die Doppelbindung eines Alkens.[2] Auch diese Reaktionen sind über die Grenzorbitalmethode nachvollziehbar. Es werden zwei σ-Bindungen, die vom gleichen Atom ausgehen, simultan geöffnet oder geschlossen.
Einzelnachweise
- Eintrag zu cycloaddition. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01496 – Version: 2.1.5.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 349, ISBN 3-211-81060-9.