Lawessons Reagenz
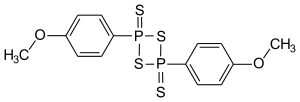
Lawessons Reagenz ist eine phosphor- und schwefelhaltige organische Verbindung und wurde nach seinem Entdecker, dem schwedischen Chemiker Sven-Olov Lawesson, benannt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lawessons Reagenz | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H14O2P2S4 | ||||||||||||||||||
| Kurzbeschreibung |
gelbes, übelriechendes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 404,47 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Lawessons Reagenz wird aus Phosphor(V)-sulfid und Anisol synthetisiert.[3]
Verwendung
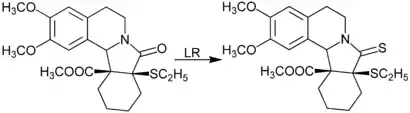
Lawessons Reagenz hat sich als äußerst nützlich für die Herstellung von Thiocarbonylverbindungen aus Carbonylverbindungen erwiesen. Es ist reaktiver als Phosphor(V)-sulfid, P4S10, und bei höherer Temperatur ausreichend in organischen Lösungsmitteln löslich, so dass die Reaktionen in einer homogenen Lösung durchgeführt werden können. Lactame lassen sich mittels Lawessons Reagenz in Thiolactame umwandeln:[4] Ebenso lassen sich so Phosphinoxide in die entsprechenden Phosphinsulfide überführen, enantiomerenreine P-stereogene Verbindungen reagieren unter Retention der Konfiguration.[5]
Mechanismus
Das Reagenz steht im Gleichgewicht mit der monomeren Form. Diese reagiert in einem Mechanismus ähnlich dem der Wittig-Reaktion mit einer Carbonylverbindung.[6]
Siehe auch
Einzelnachweise
- Datenblatt Lawessons Reagenz (PDF) bei Merck, abgerufen am 14. April 2005.
- Datenblatt Lawesson reagent bei Sigma-Aldrich, abgerufen am 7. April 2011 (PDF).
- Eintrag zu Lawessons Reagenz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. September 2014.
- A. Padwa und M. D. Danca, Organic Letters 2002, 715.
- Małgorzata Kwiatkowska, Grzegorz Krasiński, Marek Cypryk, Tomasz Cierpiał, Piotr Kiełbasiński: Lipase-mediated stereoselective transformations of chiral organophosphorus P-boranes revisited: revision of the absolute configuration of alkoxy(hydroxymethyl)phenylphosphine P-boranes. In: Tetrahedron: Asymmetry. Band 22, Nr. 14–15, 31. Juli 2011, S. 1581–1590, doi:10.1016/j.tetasy.2011.08.024 (sciencedirect.com [abgerufen am 30. Juni 2016]).
- Portal für organische Chemie.
Weblinks
- I. Thomsen, K. Clausen, S. Scheibye, and S.-O. Lawesson: Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4-Dithiaphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone In: Organic Syntheses. 62, 1984, S. 158, doi:10.15227/orgsyn.062.0158; Coll. Vol. 7, 1990, S. 372 (PDF).
