Diene
Die Diene sind eine Gruppe organisch-chemischer Verbindungen, die zwei Kohlenstoff-Kohlenstoff-Doppelbindungen (kurz C=C-Doppelbindungen) enthalten. Die Diene zählen somit zu den Alkenen bzw. Polyenen. Die einfachsten Diene sind die Kohlenwasserstoffe Propadien, 1,3-Butadien und Isopren.
Klassifizierung und Nomenklatur
| Isomere Pentadiene | |
|---|---|
.svg.png.webp) konjugiertes Dien 1,3-Pentadien | |
.svg.png.webp) isoliertes Dien 1,4-Pentadien | |
.svg.png.webp) kumuliertes Dien 1,2-Pentadien | |
Diene unterscheiden sich in der Anordnung der Doppelbindungen, also der Konstitution des Moleküls:
- Sind in einer Kohlenstoffkette die Kohlenstoff-Doppelbindungen durch genau eine Kohlenstoff-Einfachbindung getrennt, wie z. B. bei 1,3-Pentadien, spricht man von konjugierten Doppelbindungen (Lateinisch conjugare: zu einem Paar verbinden). Es können Wechselwirkungen (Konjugation) zwischen den Doppelbindungen stattfinden, durch welche die dazwischen liegende Einfachbindung einen „partiellen Doppelbindungscharakter“ erhalten kann. Es muss jedoch berücksichtigt werden, dass die Länge der =C–C= Bindung auch ohne „Konjugation“ kleiner ist als bei Alkanen (sp2-sp2-Bindung). Gelegentlich werden solche Verbindungen als Konjuene bezeichnet.
- Bei isolierten Doppelbindungen sind die Doppelbindungen durch mindestens zwei CC-Einfachbindungen voneinander getrennt, wie z. B. bei 1,4-Pentadien. Die Doppelbindungen zeigen in der Regel keine Wechselwirkungen untereinander.
- Bei kumulierten Doppelbindungen (Lateinisch cumulatus: gehäuft, cumulus: Haufe) werden die beiden Kohlenstoff-Doppelbindungen nicht durch andere Bindungen unterbrochen, wie z. B. bei 1,2-Pentadien. Entlang der kumulierten Doppelbindungen sind die Kohlenstoffatome linear angeordnet, da die zentralen Kohlenstoffatome in sp-Hybridisierung vorliegen. Verbindungen mit zwei kumulierten Doppelbindungen werden Allene genannt.[1]
Der Name eines Diens leitet sich wie der eines Alkens von demjenigen des entsprechenden Alkans ab, wobei die Endung -an durch das die Anzahl der Doppelbindungen repräsentierende griechische Zahlwort (di für zwei) und die die Alkene auszeichnende Endung -en ersetzt wird. Die Positionen der Doppelbindungen werden durch vorangestellte, durch Komma getrennte arabische Zahlen angegeben. Die Nummerierung der Bindungen wird so vorgenommen, dass im Namen des Alkens die kleinstmöglichsten Zahlen verwendet werden können. Die Zahlen werden durch einen Bindestrich mit dem Namen verknüpft.
Beispiel: Butan (Alkan) → 1,2-Butadien (Alken/Dien, zwei Doppelbindungen an Position 1 und 2 in der Kohlenstoffkette)
Diejenigen Diene, die keine weiteren Heteroatome enthalten und nur Kohlenwasserstoffe sind, nennt man Alkadiene.
Eigenschaften
Struktur
Die Bindungslänge der Einfach- und Doppelbindungen in Dienen unterscheidet sich von denen in Alkanen oder Alkenen wie Ethen. CC-Einfachbindungen haben üblicherweise eine Länge von 0,154 nm.[2] CC-Doppelbindungen sind 0,134 nm lang.[2] CC-Einfachbindungen jedoch, die auf eine CC-Doppelbindung folgen, sind kürzer als 0,1526 nm.
Dieses liegt daran, dass aufgrund der sp²-Hybridisierung des Kohlenstoff-Atoms, das an der Einfach- und an der Doppelbindung beteiligt ist, die bindenden Molekülorbitale keine solche räumliche Ausdehnung haben wie bei einer sp³-Hybridisierung beispielsweise bei den Alkanen.
Konformation
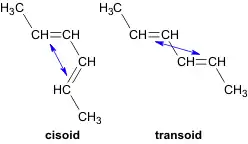
Diene besitzen CC-Einfachbindungen, um welche Molekülteile rotieren können. Dadurch sind verschiedene, energetisch unterschiedliche Zustände (Konformationen) des Moleküls möglich.
Aus der Drehung um die Einfachbindungen ergeben sich Konformationen, bei denen zwei Doppelbindungen auf der gleichen Seite von der Einfachbindung aus gesehen liegen oder auf gegenüberliegenden. Man spricht dann von cisoiden oder transoiden Doppelbindungen.
Konfiguration
Aufgrund der im Molekül vorkommenden CC-Doppelbindungen tritt in Polyenen das Phänomen der cis-trans-Isomerie auf. An beiden Doppelbindung sind zwei verschiedene räumliche Ausrichtungen (Konfigurationen) der Kohlenstoff-Kette möglich. Da diese Konfigurationen nur durch das Brechen und Wiederherstellen von Bindungen, in diesem Fall der Doppelbindung, ineinander überführt werden können, ergeben sich daraus zumindest physikalisch unterschiedliche Verbindungen.
Mesomerie
Bei konjugierten Dienen hat zusätzlich die Mesomerie einen Einfluss auf die Bindungslängen und -verhältnisse.
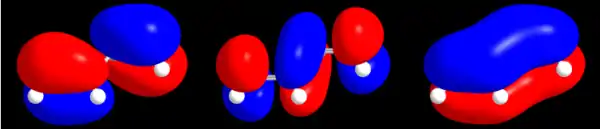
1. CC-Doppelbindungen zwischen den C-Atomen 1 und 2 bzw. 3 und 4;
2. CC-Doppelbindung zwischen den C-Atomen 2 und 3;
3. Resonanz-Hybridorbital aus den Zuständen 1. und 2.
So existieren von 1,3-Butadien zwei mesomere Grenzstrukturen, die sich durch unterschiedliche Elektronen-Verteilungen auszeichnen (siehe Abbildung oben). Alle Kohlenstoff-Atome sind sp²-hybridisiert. D. h., dass jedes Kohlenstoff-Atom ein senkrecht zur Molekülebene stehendes pz-Atomorbital besitzt, das durch Überlappung mit einem pz-Orbital eines benachbarten Kohlenstoff-Atoms eine Doppelbindung (genauer gesagt eine -Bindung) ausbilden kann. Aber auch mit weiter entfernten Kohlenstoff-Atomen ist dieses möglich, aber weniger wahrscheinlich.
Folglich kann man für 1,3-Butadien zwei Strukturen formulieren:
- Überlappung der pz-Orbitale von Kohlenstoff-Atom 1 und 2 bzw. 3 und 4 und Ausbildung der entsprechenden Doppelbindungen.
- Durch Überlappung der pz-Orbitale von Kohlenstoff-Atom 2 und 3 wird eine zentrale Doppelbindung ausgebildet. Die pz-Orbitale von Kohlenstoff-Atom 1 und 4 können ebenso miteinander wechselwirken. Dieses ist aber schon aus räumlichen Gesichtspunkten sehr unwahrscheinlich, womit 1,3-Butadien in dieser mesomeren Struktur nur zu geringen Anteilen vorliegt.
Weder Struktur 1 noch 2 kann für sich allein genommen die tatsächlichen Bindungsverhältnisse wiedergeben. Durch Überlagerung dieser beiden Strukturen erhält man ein so genanntes Resonanzhybrid für 1,3-Butadien, eine Mischform aus den beiden mesomeren Grenzformen 1 und 2. Diese zeigt eine über das gesamte Molekül verteilte (delokalisierte) -Elektronendichte.
Ausgehend von diesen Überlegungen lässt sich zusammenfassend sagen, dass die Doppelbindungen in 1,3-Butadien zu einem gewissen Grad Eigenschaften von Einfachbindungen und umgekehrt Einfachbindungen auch einen leichten Doppelbindungscharakter aufweisen.
Stabilität
Ein relatives Maß für die Stabilität von Kohlenwasserstoffen mit Mehrfachbindungen wie der Diene ist die so genannte Hydrierwärme. Das ist die Energie, die frei wird, wenn Wasserstoff an die Doppelbindungen addiert wird (Hydrierung). Dabei beobachtet man, dass bei der Hydrierung konjugierter Diene weniger Energie freigesetzt wird als bei nichtkonjugierten Dienen.
Reaktionen
Diene sind für Additionen zugänglich. Insbesondere gehen sie Diels-Alder-Reaktionen ein.
Herstellung
Cracken von Alkanen
Das einfachste, konjugierte Dien 1,3-Butadien erhält man durch katalytisches Cracken von Butan. Bei dieser Dehydrierung entstehen als Nebenprodukte Buten, Propen und Methan.
Dehydratisierung von Diolen
Durch säurekatalysierte Dehydratisierung von Diolen sind konjugierte Diene darstellbar.
Dimerisierung von Alkinen
Ethin reagiert in Gegenwart von Ammoniumchlorid und Kupfer(I)-chlorid unter Dimerisierung zu Vinylacetylen. Durch Hydrierung entsteht anschließend 1,3-Butadien.
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 245.
- Joachim Buddrus: Grundlagen Der Organischen Chemie. Walter de Gruyter, 2011, ISBN 3-11-024894-8, S. 368 (eingeschränkte Vorschau in der Google-Buchsuche).