Nebenreaktion
Eine Nebenreaktion ist eine chemische Reaktion, die zur selben Zeit wie die eigentliche Hauptreaktion abläuft, aber in geringerem Ausmaß. Sie führt zur Bildung von Nebenprodukt, wodurch die Ausbeute an Hauptprodukt verringert wird:[1]
Dabei ist P1 das Hauptprodukt, wenn k1 > k2. Das Nebenprodukt P2 ist zudem in der Regel unerwünscht und muss (meist aufwändig) vom eigentlichen Hauptprodukt abgetrennt werden.
In der organischen Synthese
B und C aus der oben stehenden Gleichung repräsentieren meist unterschiedliche Verbindungen. Es kann sich bei B und C jedoch auch um unterschiedliche Positionen in einem Molekül handeln. Verbindungen, die an unterschiedlichen Positionen reagieren können, werden ambifunktionell oder ambident genannt.
Eine Nebenreaktion wird auch als Konkurrenzreaktion[2] bezeichnet, wenn verschiedene Verbindungen (B, C) um einen anderen Reaktanten konkurrieren (A). Wenn die Nebenreaktion ähnlich häufig wie die Hauptreaktion abläuft, wird von Parallelreaktionen[3] gesprochen (vor allem in der Kinetik, s. u.).
Es können auch kompliziertere Verhältnisse vorliegen. So könnte Verbindung A reversibel aber schnell zu Stoff B (mit Geschwindigkeit k1) reagieren oder irreversibel aber langsam (k1 > k-1 >> k2) zu Stoff C:
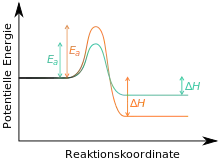
Die Reaktion zu Stoff C könnte irreversibel sein, da dieser thermodynamisch sehr stabil ist. In diesem Fall wäre B das kinetische und C das thermodynamische Produkt der Reaktion (siehe auch hier).[4][5][6] Wenn die Reaktion bei niedrigen Temperaturen durchgeführt und nach kurzer Zeit abgebrochen wird, spricht man von kinetischer Kontrolle, es hätte sich in erster Linie das kinetische Produkt B gebildet. Wenn die Reaktion bei hoher Temperatur und für lange Zeit durchgeführt wird (dann steht die notwendige Aktivierungsenergie für die Reaktion zu C zur Verfügung), welches über die Zeit in zunehmendem Maße gebildet wird, man spricht von thermodynamischer Kontrolle; es wird das thermodynamische Produkt C gebildet.
Bedingungen für Nebenreaktionen
In der organischen Synthese führt eine erhöhte Temperatur meist zu mehr Nebenprodukten. Da diese i. d. R. unerwünscht sind, werden niedrige Temperaturen („milde Bedingungen“) gewählt. Das Verhältnis zwischen konkurrierende Reaktionen kann i. d. R. durch eine Veränderung der Temperatur beeinflusst werden, da deren Aktivierungsenergien meist unterschiedlich sind. Reaktionen mit hoher Aktivierungsenergie werden durch eine Erhöhung der Temperatur stärker beschleunigt als solche mit niedriger Aktivierungsenergie. Auch die Lage des Gleichgewichts ist temperaturabhängig.[7]
Nachweisreaktionen können durch Nebenreaktionen verfälscht werden.
Kinetik
Nebenreaktionen werden auch in der Reaktionskinetik beschrieben, einem Teilgebiet der physikalischen Chemie. Nebenreaktionen werden als komplexe Reaktion verstanden, da die Gesamtreaktion (Hauptreaktion + Nebenreaktion) sich aus mehreren (wenigstens zwei) Elementarreaktionen zusammensetzt.[8] Andere komplexe Reaktionen sind Konkurrenzreaktionen, Parallelreaktionen, Folgereaktionen, Kettenreaktionen, reversible Reaktionen etc.[9]
Wenn eine Reaktion deutlich schneller als die andere abläuft (k1 > k2), wird diese (k1) als Hauptreaktion, die andere (k2) als Nebenreaktion bezeichnet. Wenn beide Reaktionen etwa gleich schnell ablaufen (k1 ≅ k2) wird von Parallelreaktionen gesprochen.[3]
Wenn die Reaktionen und irreversibel ablaufen (ohne Rückreaktion), dann entspricht das Verhältnis von P1 und P2 der relativen Reaktivität von B und C gegenüber A:
Einzelnachweise
- side reaction auf merriam-webster.com. Abgerufen am 30. August 2015.
- Konkurrenzreaktion auf chemgapedia.de. Abgerufen am 30. August 2015.
- 4. Kinetik und Katalyse (PDF) Abgerufen am 30. August 2015.
- Kinetische und thermodynamische Kontrolle von chemischen Reaktionen auf Chemgapedia.de. Abgerufen am 6. Dezember 2015.
- John Gilbert, Stephen Martin: Experimental Organic Chemistry: A Miniscale and Microscale Approach. 2010, ISBN 978-1-4390-4914-3, S. 445 (eingeschränkte Vorschau in der Google-Buchsuche).
- Robert G. Mortimer: Physical Chemistry. Academic Press, 2008, ISBN 978-0-08-087859-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus Schwetlick: Organikum. 23. Auflage. Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32292-3, S. 156.
- Komplexe Reaktionen auf spektrum.de. Abgerufen am 30. August 2015.
- Claus Czeslik, Heiko Seemann, Roland Winter: Basiswissen Physikalische Chemie. Vieweg+Teubner, 2010, ISBN 978-3-8348-9359-8, S. 280–291 (eingeschränkte Vorschau in der Google-Buchsuche).