Thioaceton
Thioaceton ist eine organische Verbindung und gehört zur Stoffklasse der Thioketone, welche Derivate von Ketonen darstellen. Thioaceton zeichnet sich durch einen unangenehm durchdringenden Geruch aus.[4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
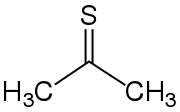 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Thioaceton | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C3H6S | ||||||||||||
| Kurzbeschreibung |
orangene oder braune Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 74,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Schmelzpunkt |
−40 °C[1] | ||||||||||||
| Siedepunkt |
80 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
Schwefelverbindungen begründen häufig in der Natur vorkommende, charakteristische Gerüche, wie z. B. die Gerüche von Zwiebeln oder Knoblauch.[5] Thioaceton hingegen wurde bisher nicht in der Natur beobachtet.
Synthese
Gewöhnlicherweise wird Thioaceton 2 durch das Cracken des Trimers 1 gewonnen, wie es bereits von Ettinghausen formulierte.[1][6]

Das Trimer kann entweder aus der Pyrolyse von Allylisopropylsulfid, oder durch die Behandlung von Aceton mit Schwefelwasserstoff in Anwesenheit einer Lewissäure bei niedrigen Temperaturen gewonnen werden.[7][8] Außerdem kann Thioaceton aus 2-Prop-2-ynyl-sulfanylpropan[9], die Zersetzung von alkylsubstituierten (2-Chlorethyl)sulfinylnitroharnstoffen[10] oder durch das Erhitzen von Acetonmercapol[11] synthetisiert werden.
Eigenschaften

Bisher konnte Thioaceton als orangene oder braune, sehr flüchtige Flüssigkeit isoliert werden. Roland Mayer untersuchte Thioketone und stellte fest, dass es sich häufig um rot erscheinende Flüssigkeiten handelt. Dies begründet er mit einer prototropen Tautomerie.[6]
Thioaceton ist nicht in Wasser, dafür jedoch gut in Ether, Benzol oder Ethanol löslich. Aus der Schmelze bildet es beim Erstarren lang gestreckte, durchsichtige Tafeln.[4]
Die Handhabung von Thioaceton wird durch seinen intensiven, unangenehmen Geruch erschwert. Baumann und Fromm charakterisieren den Geruch des Thioacetons in Bezug auf die Untersuchung desselben folgendermaßen:
„[…] unsere Versuche in dieser Richtung scheiterten aber an dem Umstande, dass jener Stoff einen fürchterlichen Geruch besitzt, welcher in erstaunlich kurzer Zeit sich verbreitet und ganze Stadttheile verpestet.[…] Die Intensität des Geruches dieser Substanz übertrifft nach unseren Wahrnehmungen Alles, was in dieser Hinsicht von stark riechenden Stoffen bekannt geworden ist.“
Um die Intensität des Geruches zu verdeutlichen, beschreiben die Autoren den Versuch, Thioaceton aus 100 Gramm Aceton herzustellen. Der Versuch fand in Freiburg statt. Dabei:
„[…] verbreitete sich der Geruch in kurzer Zeit bis zu Entfernungen von 3/4 Kilometer bis in weit abgelegene Stadttheile. Bewohner der dem Laboratorium benachbarten Strassen beschwerten sich darüber, dass die riechende Substanz bei manchen Personen Ohnmachtsanfälle, Uebelkeit und Erbrechen bewirkt hätte.[…] Aeusserst geringe Mengen des schwefelhaltigen Körpers genügen also, um Millionen von Kubikmetern Luft zu verpesten.“
Darum wird Thioaceton häufig als der stinkendste Stoff der Welt beschrieben.
Generell weisen Thioketone die Tendenz auf, leicht zu polymerisieren (Thioaceton bei über −20 °C). Trithioaceton, das cyclische Trimer des Thioacetons, ist stabiler und wird darum bevorzugt gebildet.[12][13][14] Dennoch wurden bereits lineare Polymere des Thioacetons synthetisiert.[1] Darüber hinaus können aus Thioaceton viele heterocyclische Verbindungen synthetisiert werden.[10]
Literatur
- Kracher, R. et al. (2007): Lexikon der Chemie. 3. Band (Perf bis Zy), Jokers edition. Heidelberg: Spektrum Verlag. S. 342. ISBN 978-3-8274-1909-5.
Einzelnachweise
- Von Ettinghausen, O.G. (1966): Polythioacetone, Polymer, 7(9), 469–474, doi: 10.1016/0032-3861(66)90005-X.
- V.C.E. Burnop, K.G. Latham: Polythioacetone. In: Polymer. 8, 1967, S. 589, doi:10.1016/0032-3861(67)90069-9.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fromm, E. & Baumann, E. (1889): Ueber Thioderivate der Ketone, Berichte der deutschen chemischen Gesellschaft, 22(1), 1035–1045. doi: 10.1002/cber.188902201224
- Virtanen, A.I.(1962): Organische Schwefelverbindungen in Gemüse- und Futterpflanzen, Angewandte Chemie, 74(11), 374–382. doi: 10.1002/ange.19620741103
- Mayer et al.(1964): Aliphatische Thioketone, Angewandte Chemie, 76 (4), 157-167. doi:10.1002/ange.19640760402
- Bailey, W.J. & Chu, H.(1965): Synthesis of polythioacetone, ACS Polymer Preprints, 6, 145–155.
- Böhme, H. et al.(1942): Zur Kenntnis der dimeren Thioketone, Berichte der Deutschen Chemischen Gesellschaft, 75B (7), 900–909. doi:10.1002/cber.19420750722
- Martinez, G. et al.(1983): Gas-phase thermolysis of sulfur compounds. Part VI. Allyl propargyl and isopropyl propargyl sulfides, In: Phosphorus and Sulfur and the Related Elements. 17, 47-55. doi: 10.1080/03086648308077523
- Lown, J.W & Koganty, R.R.(1986): Formation of Novel 1,2-Oxathietanes from 2-Chloroethyl Sulfoxide Precursos and Their Rections in Solution, Including Formal [σ2s+σ2a] Cycloreversions and Rearrangements, Journal of the American Chemical Society, 108 (13), 3811–3818. doi: 10.1021/ja00273a042
- Fromm, E. & Baumann, E. (1889): Ueber Thioderivate der Ketone, Berichte der deutschen chemischen Gesellschaft, 22(2), 2592–2599. doi:10.1002/cber.188902202151
- Kroto, H.W. et al.(1974): The photoelectron and microwave spectra of the unstable species Thioaldehyde, CH3CHS, and Thioacetone (CH3)2CS, Chemical Physics Letters, 29 (2), 265-269. doi: 10.1016/0009-2614(74)85029-3
- Burnop, V.C.E. & Latham, K.G.(1967): Polythioacetone, Polymer, 8, 589-607. doi: 10.1016/0032-3861(67)90069-9
- Lipscomp, R.D. & Sharkey, W.H.(1970): Characterization and polymerization of thioacetone, Journal of Polymer Science Part A: Polymer Chemistry, 8 (8), 2187–2196. doi: 10.1002/pol.1970.150080826