Polyhydroxyalkanoate
Polyhydroxyalkanoate (PHA) oder Polyhydroxyfettsäuren (PHF) sind natürlich vorkommende wasserunlösliche und lineare Biopolyester, die von vielen Bakterien als Reservestoffe für Kohlenstoff und Energie gebildet werden. Diese Biopolymere sind biologisch abbaubar und werden zur Herstellung von bio-basierten Kunststoffen verwendet.[1] Als Mikroorganismen sind bekannt: Ralstonia eutropha (früher genannt Alcaligenes eutropha, Wautersia eutropha or Cupriavidus necator), Alcaligenes latus, Pseudomonas putida, Aeromonas hydrophila und Escherichia coli. Innerhalb der Familie können mehr als 150 verschiedene Monomere kombiniert werden, um Materialien mit extrem unterschiedlichen Eigenschaften zu erhalten.[2]
-3-hydroxybutyrat.svg.png.webp)
Sie können entweder thermoplastische oder elastomere Materialien sein, wobei der Schmelzpunkt im Bereich von 40 bis 180 °C liegt. Die mechanischen Eigenschaften und die Biokompatibilität von PHA können auch durch Mischen, Modifizieren der Oberfläche oder Kombinieren von PHA mit anderen Polymeren, Enzymen und anorganischen Materialien verändert werden, wodurch ein breiteres Anwendungsspektrum ermöglicht wird.
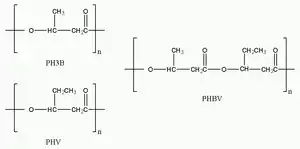
Struktur
Die einfachste und am häufigsten vorkommende Form der PHA ist das durch fermentativ synthetisierte Poly[(R)-3-hydroxybutyrat] (Polyhydroxybuttersäure, PHB oder Poly(3HB)). Dieses besteht aus 1.000 bis 30.000 Hydroxyfettsäureeinheiten. Neben 3-Hydroxybuttersäure sind rund 150 weitere Hydroxyfettsäuren als PHA-Bausteine bekannt.
PHA kann entweder als kurzkettiges (short-chain length PHA, scl–PHA) mit 3 bis 5 Kohlenstoffatomen, als mittelkettiges (medium-chain length PHA, mcl–PHA) mit 6 bis 14 Kohlenstoffatomen oder als langkettiges (long-chain length PHA, lcl–PHA) mit 15 oder mehr Kohlenstoffatomen synthetisiert werden. Je nach Mikroorganismus und Kultivierungsbedingungen werden Homo- oder Copolyester mit unterschiedlichsten Hydroxycarbonsäuren erzeugt.
PHA-Typen
PHA Monomere: Polyhydroxybutyrat, Polyhydroxyvalerat PHA co-Polymere: P(4hb-Co-3hb), P(3hb-Co-3hv) PHA Terpolymere: P(3hb-Co-3hv-Co-4hb).
PHAs sind nach folgender Strukturformel aufgebaut:
| Alkyl Verzweigung | Name | Abkürzung |
|---|---|---|
| R = H | Poly(3-hydroxypropionat) | (PHP) |
| R = CH3 | Poly(3-hydroxybutyrat) | (PHB, P3HB) |
| R = CH2CH3 | Poly(3-hydroxyvalerat) | (PHV) |
| R = Propyl | Poly(3-hydroxyhexanoat) | (PHHx) |
| R = Butyl | Poly(3-hydroxyheptanoat) | (PHH) |
| R = Pentyl | Poly(3-hydroxyoctanoat) | (PHO) |
| R = Hexyl | Poly(3-hydroxynonanoat) | (PHN) |
| R = Heptyl | Poly(3-hydroxydecanoat) | (PHD) |
| R = Octyl | Poly(3-hydroxyundecanoat) | (PHUD) |
| R = Nonyl | Poly(3-hydroxydodecanoat) | (PHDD) |
| R = Undecyl | Poly(3-hydroxytetradecanoat) | (PHTD) |
| R = Dodecyl | Poly(3-hydroxypentadecanoat) | (PHPD) |
| R = Tridecyl | Poly(3-hydroxyhexadecanoat) | (PHHxD) |
Ein "-Co-" wird verwendet, um das Copolymer anzuzeigen
| Co-Polymer-Name | Abkürzung | |
|---|---|---|
| poly(3-hydroxypropionate-co-3-hydroxybutyrate) | (P3HP-3HB) | |
| poly(3-hydroxypropionate-co-4-hydroxybutyrate) | (P3HP-4HB) | |
| poly(3-hydroxybutyrate-co-4-hydroxybutyrate) | (P(3HB-4HB)) | |
| poly(3-hydroxybutyrate-co-3-hydroxyvalerate) | (PHBV) | |
| poly(3-hydroxybutyrate-co-3-hydroxyvalerate-co-3-hydroxyhexanoate) | (PHBV-HHx) | |
| R= C3-C11 | medium chain length PHA | (mcl-PHA) |
| R= C12-und mehr | long chain length PHA | (lcl-PHA) |
-3-hydroxybutyrat.svg.png.webp) Struktur von Poly-(R)-3-hydroxybutyrat (P3HB)
Struktur von Poly-(R)-3-hydroxybutyrat (P3HB)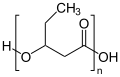 Struktur von Poly-3-hydroxyvalerat (PHV)
Struktur von Poly-3-hydroxyvalerat (PHV)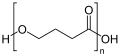 Struktur von Poly-4-hydroxybutyrat (P4HB)
Struktur von Poly-4-hydroxybutyrat (P4HB)
Biosynthese
Zur Herstellung von PHA wird eine Kultur eines Mikroorganismus wie Cupriavidus necator (auch Ralstonia eutropha genannt) aus der Familie der Burkholderiaceae in ein geeignetes Medium gegeben und mit geeigneten Nährstoffen gefüttert, so dass sie sich schnell vermehrt. Als Nährstoffe kommen einfache pflanzliche oder tierische Zucker wie Glucose, Fructose, Maniokstärke-Nebenprodukt, Lactose, kurzkettige Säuren und Alkohole wie Milchsäure, Essigsäure, 1,4-Butandiol, γ-Butyrolacton, 4-Hydroxybutansäure als auch Öle und Fette wie Olivenöl, Maisöl, Palmöl, Schmalz, Talg, Abfallöle in Frage.[3]
Um die Glucosebausteine der Saccharose-Substrate für die mikrobielle PHA Produktion zugänglich zu machen, werden die Substrate oftmals vorher hydrolysiert. Sobald die Population ein beträchtliches Niveau erreicht hat, wird die Nährstoffzusammensetzung geändert, um den Mikroorganismus zur Synthese von PHA zu zwingen. Die Biosynthese von PHA durch Mikroorganismen wird während der Fermentation meist durch bestimmte Mangelbedingungen (z. B. Mangel an den Makroelementen Phosphor, Stickstoff, Mangel an Spurenelementen oder Sauerstoffmangel) bei gleichzeitigem Überangebot an Kohlenstoffquellen ausgelöst.
PHAs werden in Bakterienzellen durch einen Stoffwechselprozess synthetisiert. Die Substrate für die biosynthetisierende PHAs sind in der Regel auf kleine Moleküle beschränkt, da Bakterien dicke, starre Zellwände als Membranen haben. Große polymere Moleküle können nicht in die Zelle transportiert werden, und für den Einsatz der polymeren Moleküle ist eine extrazelluläre Transformation entweder durch den Mikroorganismus oder durch einen chemischen Prozess erforderlich.
JoAnne Stubbe erforschte und isolierte mit ihrer Gruppe ein erstes Enzym zur biosynthetischen PHA-Synthase und untersuchte die durch das Enzym aufgebauten Polymere. Eine Liste mit Enzymen, die in den PHA-Biosynthese-Pfad involviert sind, ist bei Tan et al. zusammengestellt.[4][5] PHA-Synthasen sind die Schlüsselenzyme der PHA-Biosynthese. Sie verwenden das Coenzym A-Thioester von (r) -Hydroxyfettsäuren als Substrate.
Die Ausbeute an PHA, die aus den intrazellulären Granulateinschlüssen erhalten wird, kann bis zu 80 % des Trockengewichts des Organismus betragen.
Die Biopolyester werden in Form von wasserunlöslichen, stark lichtbrechenden Granula als Energie-Speicherstoffe in den Zellen abgelagert. Die meisten PHA-synthetisierenden Mikroorganismen können als Substrat einfache Zucker verwenden. Der Kohlenwasserstoff-Stoffwechsel von Triacylglycerol (Fette und Öle) ist begrenzter, kann aber von Pseudomonas-Bakterienarten durchgeführt werden. Aus dem gleichen Substrat können verschiedene Bakterien PHAs mit einer anderen Zusammensetzung herstellen.
Bei reinen Substraten entstehen Homopolyester. Gibt man zu den Hauptsubstraten noch Co-Substrate wie zum Beispiel Valeriansäure oder Glycerin hinzu, werden von den Mikroorganismen Co-Polyester mit unterschiedlichen Hydroxycarbonsäuren erzeugt.
Die Firma P4SB erforscht die Biotransformation von nicht biologisch abbaubaren, ölbasierten Kunststoffabfällen (z. B. Polyethylenterephthalat und Polyurethan) unter Verwendung der Bakterien Pseudomonas putida zu biologisch abbaubarem Polyhydroxyalkonat (PHA).[6]
Eine Übersicht über die Umwandlung von Abfallströmen als auch von petrochemischem Plastikabfall als Kohlenstoffquelle in Biopolymere PHA beschreiben Khatami und Kollegen.[7]
Anbei einige ausgewählte Stämme an Mikroorganismen, die aus Substraten eine hohe PHA-Konzentration in der trockenen Zellmasse synthetisieren:
| Gruppe Kohlenstoff-Quelle | Kohlenstoff-Quelle | Mikroorganismen-Stamm | PHA |
|---|---|---|---|
| Hydroxycarbonsäuren, kurzkettig | 3-Hydroxybutansäure, 4-Hydroxybutansäure |
Eutropha N9A, Wautersia eutropha, , Cupriavidus necator und Alcaligenes |
scl-PHA, P3HB mit 1.000 bis 30.000 Hydroxycarbonsäure Monomeren. |
| Hydroxycarbonsäuren | 3-Hydroxybutansäure, 4-Hydroxybutansäure |
Aeromonas hydrophila und Thiococcus pfennigii | PHA-Copolyester |
| Hydroxycarbonsäuren | Alkene, n-Alkane | Pseudomonas putida GPo1, Pseudomonas oleovorans |
scl-mcl-PHA, mcl-PHA |
| Glycerin | Glycerin | Burkholderia cepacia | P3HB |
| Glycerin | Rohglycerin aus der Biodiesel-Produktion | Haloferax mediterranei | P3HB3HV |
| Polysaccharide | Glucose | CECT 4623, KCTC 2649, NCIMB 11599, Novosphingobium nitrogenifigens Y88, Ralstonia eutropha[4][8] |
P3HB |
| Polysaccharide | Fructose + Glucose | Azohydromonas lata, Alcaligenes latus, Cupriavidus necator H16, (früher Hydrogenomonas eutropha H16), (früher Alcaligenes eutrophus H16), (früher Ralstonia eutropha H16), (früher Wautersia eutropha H16), Burkholderia cepacia, Pseudomonas multivorans, Pseudomonas cepacia |
P3HB |
| Polysaccharide | Glucose + Valeriansäure | Caldimonas taiwanensis | PHBV (49 % B–51 % V) |
| Polysaccharide | Glucose + Laurinsäure | Aeromonas hydrophila, Aeromonas caviae, Rhodospirillium rubrum, Rhodocyclus gelatinosus, Sinorhizobium fredil |
P(3HB-co-3HHx), P(3HB-co-3HO), SCL-MCL-Copolymers |
| Polysaccharide | Glucose + mittelkettige Fettsäuren | Aeromonas hydrophila, Cupriavidus necator, Hydrogenomonas eutropha, (früher Alcaligenes eutrophus), (früher Ralstonia eutropha) und (früher Wautersia eutropha), Caldimonas taiwanensis |
P3HB-co-3HHx, P3HB-co-3HV |
| Polysaccharide | Saccharose | Azohydromonas lata, (früher Alcaligenes latus), |
P3HB |
| Polysaccharide | Xylane | Co-culture of Saccharophagus degradans und Bacillus cerues, Burkholderia cepacia, Pseudomonas multivorans und Pseudomonas cepacia, P. cepacia |
P3HB |
| Zucker-Melasse | Zuckerrüben-Melasse | Haloferax mediterranei DSM 1411 | PHBV (86–14) |
| Zucker-Melasse | Zuckerrüben-Melasse | Alicaligenes latus, Ralstonia eutropha, Haloferax meduterranel, Azotobacter vinelundi |
P3HB, P(3HB-3HV), P(3HB-4HB) |
| Zucker-Melasse | Zuckerrohr-Melasse + Fructose, Glucose, Saccharose, Glycerin |
Pseudomonas aeruginosa NCIM 2948 | P3HB |
| Zucker-Melasse | Malz-Zucker-Abfall | Azohydromonas australica, (früher Alcaligenes latus), Azotobacter vinelandii |
P3HB |
| Polysaccharide-Stärke | Hydrolysierte Kartoffelstärke | Halomonas boliviensis LC1 | P3HB |
| Polysaccharide-Stärke | Hydrolisierte Kartoffelstärke + Valeriansäure, Hydrolisierte Weizenstärke + Valeriansäure |
Caldimonas taiwanensis | PHBV (80–10) |
| Polysaccharide-Stärke | Hydrolysierte Maniokstärke (Cassava) + Valeriansäure, Maisstärke + Valeriansäure |
Caldimonas taiwanensis, |
PHBV (87–13) |
| Fette und Öle | Pflanzenöle | Ralstonia eutropha | P3HB |
| Fette und Öle | Olivenöl, Maisöl, Palmöl, Ölsäure |
Cupriavidus necator H16, (früher Hydrogenomonas eutropha H16), (früher Alcaligenes eutrophus H16), (früher Ralstonia eutropha H16), Wautersia eutropha H16 |
P3HB |
| Fette und Öle | Olivenöl | Aeromonas hydrophilia, Aeromonas caviae |
mcl-PHA, P3HB-3HHX |
| Fette und Öle | Abwasser der Olivenölmühlen | Haloferax mediterranei DSM 1411 | PHBV (94-6) |
| Fette und Öle | Palmkernöl, Rohes Palmöl, Fettsäuren aus Palmöl und Palmkernöl |
Cupriavidus necator | mcl-PHA |
| Fette und Öle | Sojabohnenöl | Pseudomonas stutzeri | mcl-PHA |
| Fette und Öle | Erdnussöl, Rizinusöl, Senföl, Sesamöl |
Comamonas testosteroni | P3HB |
| Fette und Öle | Senföl | Pseudomonas aeruginosa | PHA |
| Fette und Öle | Kokosöl, Talgöl |
Pseudomonas saccharophilia | mcl-PHA |
| Fette und Öle | Talg-basierter Biodiesel | Pseudomonas citronellolis, Pseudomonas oleovorans, Pseudomonas stutzeri |
mcl-PHA, P3HHX, P3HO |
| Fette und Öle | Bratöl-Abfall | Ralstonia eutropha | P3HB, P(3HB-3HV) |
| Lactose, Milchzucker | Molke | Escherichia coli harbouring A. latus genes | P3HB |
| Lactose, Milchzucker | hydrolisierte Molke | Haloferax mediterranei | P3HB3HV |
| Lactose, Milchzucker | Lactose + Saccharose | Hydrogenophaga pseudoflava ATCC 33668, DSM 1034 |
P3HB3HV |
| Alkohole | Methanol | Methylobacterium extorquens, Methylobacterium. organophilum |
P3HB |
| Fettsäuren | Laurinsäure, Myristinsäure, Palmitinsäure, Stearinsäure, Ölsäure |
Burkholderia sp. USM JCM 15050[9] | P3HB |
| Fettsäuren | Pelargonsäure | Pseudomonas putida KT2440 | mcl-PHA |
| Fettsäuren in Algen | Agarose | Co-culture of Saccharophagus degradans und Bacillus cerues | P3HB |
| Fettsäuren in Algen | Alge Corallina mediterranea | Halomonas pacifica ASL 10, Halomonas salifodiane ASL11 | PHA-Nanopartikel |
| Cellulose | Hemicellulose Hydrolysat | Burkholderi cepacia ATCC 17759 | P3HB |
| Cellulose | Cellulose-Sigmacell | Saccharophagus degradans | P3HB |
| Cellulose | α-Cellulose | Saccharophagus degradans | P3HB |
| Cellulose | Silage | Haloferax mediterranei DSM 1411 | PHBV (85–15) |
| gasförmige Kohlenwasserstoffe | Methan | Methylotroph spp. Hefe | P3HB |
| gasförmige Kohlenwasserstoffe | Kohlendioxid, CO2 | Cupriavidus necator H16, (früher Hydrogenomonas eutropha H16), (früher Alcaligenes eutrophus H16), (früher Ralstonia eutropha H16), (früher Wautersia eutropha H16) |
P3HB |
| flüssige Kohlenwasserstoffe | n-Octan | Pseudomonas oleovorans, Pseudomonas citronellolis |
mcl-PHA, P3HHx, P3HO, P3HD |
| flüssige Kohlenwasserstoffe | Benzol, Ethylbenzol, Toluol, Styrol, p-Xylol |
Pseudomonas fluva TY16, Pseudomonas putida F1, Pseudomonas putida CA-3 |
mcl-PHA |
| Nukleinbasen, Nukleinsäuren | Adenin, Purine |
Blastobotrys adeninivorans | PHA |
| Nährstoffe | Nährstoffe in Salzseen mit hoher Salzkonzentration | Methylaspartatzyklus | PHA |
Die zitierten Literaturwerke enthalten umfangreiche Tabellen mit: Mikroorganismen-Stämmen, Kohlenstoff-Quellen, Art der gebildeten PHAs, Trockenmasse der Bakterien, PHA in der Fermentationslösung, PHA-Anteil an der trockenen Zellmasse und Ausbeute an PHA bezogen auf die Substratmenge. Die vollständigen Tabellen in den Artikeln können über den DOI als Volltext heruntergeladen werden.[3][5][8][9][10][11][12][13][14][15][16][17]
Eigenschaften
Je nach chemischer Zusammensetzung (Homo- oder Copolyester, enthaltene Hydroxycarbonsäuren) unterscheiden sich die Eigenschaften der PHAs:.
- Nicht toxisch, daher für Lebensmittelverpackungen geeignet.
- Bioverträglich und damit für medizinische Anwendungen geeignet.
- Sie sind als hochwertige, therapeutische oder pharmazeutische Materialien wie wärmeempfindliche Klebstoffe, Trägermaterialien für die kontrollierte, in vivo Freisetzung von Arzneimitteln, Führungsleitungen beim Reparieren von Nervenbahnen, Implantaten, Nähte, intelligente Latex, Maschen oder als Gerüststrukturen bei der Gewebezüchtung geeignet.[18]
- Gute Beständigkeit gegen Feuchtigkeit.
- Zeigen eine geringe Permeation von Wasser.
- Weisen Aroma-Barriere-Eigenschaften auf.
- Gute Beständigkeit gegen Ultraviolettstrahlung.
- Schlechte chemische Beständigkeit gegenüber Säuren und Basen.
- In Wasser unlöslich.
- Löslich in Chloroform und andere chlorierte Kohlenwasserstoffe wie Dichlormethan; Cyclische Ester wie Ethylencarbonat oder 1,2-Propylencarbonat
- Relativ widerstandsfähig gegen hydrolytischen Abbau.
- Mit einer Dichte von 1200 kg/m³ sind sie schwerer als Wasser. Sie sinken im Gegensatz zu Polypropylen in Wasser ab.
- Das Absinken erleichtert den anaeroben Bioabbau in Sedimenten.
- Weniger klebrig als herkömmliche, geschmolzene Polymere.
- Vertragen im Gegensatz zu anderen bio-basierten Kunststoffen wie Polymere aus Polymilchsäure teilweise Temperaturen bis ca. 180 °C.
- Der kristalline Anteil kann im Bereich von wenigen bis zu 70 % liegen.
- Rein aus Polyhydroxybuttersäure synthetisiertes PHB Polymer hat eine hohe Kristallinität ist daher relativ spröde und steif.
- Verarbeitbarkeit, Schlagfestigkeit und Elastizität verbessern sich durch höhere Valeriat-Anteile im Co-Polymer (PHBV).
- PHB-Copolymere, die auch andere Fettsäuren wie z. B. Beta-Hydroxyvaleriansäure enthalten, erhöhen die Elastizität.[12][19][20]
| Eigenschaft | Abkürzung | [Einheit] | Homopolymer scl-PHA | Homopolymer mcl-PHA | Copolymer P(3HB- co-3HV) | Copolymer P(3HB 94- -co-3HD 6) |
|---|---|---|---|---|---|---|
| Schmelztemperatur | Tm | [°C] | 160–179 | 80 | 137-170 | 130 |
| Glasübergangstemperatur | Tg | [°C] | 2-4 | −40 | −6 bis 10 | −8 |
| Kristallisationsgrad | Xcr | [%] | 40–60 | |||
| Elastizitätsmodul, Young’s Modul | E-modul | [GPa] | 1–3,5 | 0,7-2,9 | ||
| Zugfestigkeit | [MPa] | 5-15 | 20 | bis 690 | 17 | |
| Reißdehnung | ε | [%] | 1–40 | 300 | 30-38 | 680 |
| Wasserdampftransmissionsrate | WVTR | [g·mm/m²·Tag] | 2.36 | |||
| Sauerstoff Transmissionsrate | OTR | [cc·mm/m²·Tag] | 55.12 |
PHA-Gewinnung
Die PHA-Gewinnung aus der Biomasse wendet eine Abfolge verschiedener Techniken an:
Biomasseernte
Die Biomasseernte ist die Konzentration von Biomasse mit Techniken wie Filtration oder Zentrifugieren.
Vorbehandlung und Zerstörung der Zellmembranen
Da PHAs intrazelluläre Polymere sind, ist es notwendig, die Biomasse vor der PHA-Gewinnung zu konzentrieren. Zu den Techniken gehören Trocknungstechniken (Lyophilisierung und thermische Trocknung), Schleifen, chemische, enzymatische und biochemische Vorbehandlungen. Der Vorbehandlungsschritt kann zwei oder mehr Methoden kombinieren.
Die Zerstörung der nicht-PHA-Zellmasse (NPCM) kann mechanisch, chemisch, enzymatisch, biologisch oder osmotisch erfolgen.
PHA Extraktion und Fällung
Bei der PHA-Solubilisierung wird das PHA aus der bakteriellen Biomasse durch den Einsatz eines Alkohols ausgefällt. Hierbei wird die Unlöslichkeit von PHA in eiskaltem Methanol und die Löslichkeit von NPCM in einem Lösungsmittel ausgenutzt. Als Lösungsmittel kommen „wässrige, glykolhaltige zwei Phasensysteme“, „halogenierte Lösungsmittel“ z. B. heißes Chloroform, Methylenchlorid, „nicht halogenierte Lösungsmittel“ oder „Extraktion mit überkritischen Flüssigkeiten“ zur Anwendung.[3]
Beim Verfahren nach Heinrich und Kollegen wurde Natriumgluconat mit Ralstonia eutropha kultiviert. Die Bakterienzellen wurden 68 h bei 30 °C gezüchtet und durch kontinuierliche Zentrifugation geerntet. Die gefriergetrocknete und pulverisierte Zellmasse wurde in 13 vol % wässrigen Natriumhypochloritlösung suspendiert. Bei einer Biomassekonzentration von mehr als 30 g L-1 (Gew./Vol.) war die Natriumhypochloritlösung gesättigt. Der Aufschluss der Nicht-Poly (3-HB) -Biomasse (NPCM) in Natriumhyperchlorit bei pH von 12,3 war sehr exotherm und intensive Kühlung war notwendig. Das Aussedimentieren des Polymers konnte durch Wasserzugabe beschleunigt werden. Die Sedimentation des Polymers ging mit einer klaren Trennung einher und das sedimentierte Poly (3HB) konnte einfach vom Überstand dekantiert werden. Das isolierten Poly (3HB) wurde zweimal mit Wasser und einmal mit Isopropanol gewaschen. Der Rest an Isopropanol wurde abgedampft. Danach war kein Geruch von Hypochlorit im Produkt mehr vorhanden. Das extrahierte und gereinigte Polymer erschien als weißes Pulver mit einer Reinheit von 93 bis 98 Gew. %. Die maximale Wiederfindung, die in Bezug auf die Anfangskonzentration von Poly (3HB) in den Zellen erreicht werden konnte, betrug ca. 87 %.[21]
PHA Extraktion mit Hilfe von Tensiden
Die nichtionischen Tenside Triton X-100, Triton X114 und Tergitol 6 bauen bei hohem pH die Bakterienzellmembranen ab und zerstören oder denaturieren andere Zellbestandteile und setzen das PHA frei. Darauf folgt eine kurze Behandlung mit Bleichmittel, die die Reinigung abschließt.[22]
PHA Extraktion durch Enzymatische Behandlung
Der Aufschluss der Zellmembranen und die Freisetzung der Polyhydroxyalkonate kann durch den Einsatz von Enzymen wie Lysozym, Nukleasen oder Proteasen wie z:B. proteases Corolase® L10, Alcalase® 2.4L, Corolase® 7089, Protemax® FC, glycosidases Celumax® BC, Rohament® CL oder Rohalase® Barley erfolgen. Es konnten Ausbeuten von 93 % P(3HB‐co‐3HV) mit 94 % Reinheit erzielt werden.[23]
Industrielle Fertigung
Geschichte
P3HB (Poly-3-hydroxybutyrat) wurde erstmals 1925 durch den französischen Mikrobiologen Maurice Lemoigne (1883-1967), im Bacillus megaterium entdeckt.[26] Erst in den 1960er Jahren konzentrierte sich die Wissenschaft auch auf andere von Bakterien produzierte PHA, nämlich P3HV (Poly-3-hydroxyvalrat) und P3HHx (Poly-3-hydroxyhexanoat). Bis 2006 waren etwa 150 verschiedene PHA bekannt. Das Unternehmen ICI entwickelte in den 1980er Jahren ein Material, um seine Produktion in einer Pilotanlage zu testen. Durch die kommerzielle Produktion wurden diese Materialien billiger und sie wurden in großen Mengen für verschiedene Anwendungen mit großem Potenzial in der Medizin getestet.
Das Interesse ließ jedoch nach, als klar wurde, dass die Materialkosten zu hoch waren und seine Eigenschaften nicht mit denen von Polypropylen vergleichbar waren.
1996 erwarb Monsanto alle Patente für die Polymerherstellung von ICI / Zeneca und verkaufte ein Copolymer aus PHBV (Poly (3-hydroxybutyrat-co-3-hydroxyvalerat)) unter der Marke Biopol. Monsanto verkaufte seine Rechte an Biopol jedoch 2001 an das US-amerikanische Unternehmen Metabolix und schloss Anfang 2004 ihre Kulturanlage, in der PHB aus Bakterien hergestellt wurde. Im Juni 2005 erhielt das amerikanische Unternehmen Metabolix einen Presidential Green Chemistry Challenge Award für die Entwicklung und Vermarktung einer kostengünstigen Methode zur Herstellung von PHAs im Allgemeinen, einschließlich PHB.[27]
Die wichtigsten PHA Produzenten
BASF Brasil; Bioamber, Inc.; Biomatera, Inc.; Biome Bioplastics Ltd.; Biomer; Bio-On Srl (Italy); Bioscience; Biotechnology Co., Ltd; Bluepha Co.(China), Ltd.; Boar (Japan); Cardia Bioplastics Ltd; CJ Cheil-Jedang Corp. (Südkorea); Danimer Scientific. (USA); Dayglo Color Corp.; Dupont Tate & Lyle Bio Products Company, LLC; Ecomann ; Full Cycle Bioplastics (USA); GreenBio ; Kaneka Corporation (Japan); Mango Materials; Materials Co. Ltd, ; Meredian Inc.; Metabolix Inc.; Micromidas; Minerv PHA Bioplastics; Mitsubishi Chemical; Nafigate Corporation (Czech Republic); Newlight Technologies, LLC (USA); PHB Industrial S.A.; Polyferm Canada, Inc.; Procter & Gamble Co.; RWDC-Industries (USA/Singapore); Shenzhen Ecomann Biotechnology Co., Ltd.; Tepha, Inc.; Tianan Biologic Materials Co. Ltd. (China); Tianjin Greenbio Materials Co. Ltd; Veolia-AnoxKaldnes Bas.
Eine Liste mit Produktionsstätten und Kapazitäten sind in Polyhydroxybuttersäure aufgeführt.
Verarbeitung und Verwendung
PHA-Polymere bergen großes Potential als Ersatzmaterial für Massenkunststoffe wie, z. B. Polypropylen(PP), besonders im Bereich der Verpackungen und Beschichtungen. Der Anteil von PHA an den 2020 weltweiten Kapazitäten für Bioplastik in Höhe von 2,11 Millionen Tonnen/Jahr beträgt 1,7 %.[28]
PHA-Polymere sind thermoplastisch auf konventionellen Anlagen verarbeitbar und sind je nach Zusammensetzung verformbar und mehr oder weniger elastisch.
Verarbeitet werden PHA vor allem im Spritzguss, durch Extrusion und Extrusionsblasen zu Folien und Hohlkörpern. PHA ist ein Thermoplast das beim 3D-Druck als Schmelzmaterial eingesetzt werden kann. Die Produktformen lassen sich durch Biegen, Druck, Zug und Zugdruck umformen und gestalten. So entstehen Flaschen, Golf-Tees, Schreibstifte, Behälter für Kosmetika.
Kunststoffe aus PHA finden als biologisch abbaubare Elastomere und Thermoplaste Verwendung, so zum Beispiel für Verpackungsmaterial, insbesondere für Lebensmittel. Strohhalme daraus sind resistent gegen heiße Flüssigkeiten, ohne den Geschmack der Getränke zu verändern.[29]
Ein weiteres mit PHA verbundenes Interesse ist seine Biokompatibilität mit lebenden Gewebe.
Es findet in der Medizintechnik Anwendung bei Implantate als Fixierungsmaterial und bei orthopädische Prothesen z. B. als Nieten, Heftklammern, Schrauben (einschließlich Interferenzschrauben), orthopädische Stifte, Stents, Gefäßklappen, Schlingen, Knochenplatten und Knochenbeschichtungssysteme zur Knochenverstärkung, als Knochentransplantatersatz.
PHA werden in medizinischen Bereichen eingesetzt, z. B. als vom Körper resorbierbare Materialien wie Nahtmaterialien; Chirurgische Netze, zur Regeneration von geführtem Gewebe z. B. Nervenführungen, Regeneration von Gelenkknorpel, Sehnen, Meniskus; als Band- und Sehnenimplantate, Augenzellimplantate; Adhäsionsbarrieren; als Wundauflage und Hämostate, Herz-Kreislauf-Pflaster, Perikardpflaster; als Hautersatz.
PHA ist für implantierte pharmazeutische Depotpräparate geeignet.[30]
Es wird ihr Einsatz als Hygieneartikel (, z. B. Windelbestandteile), Fasern, Klebstoffe, Bestandteile von Toner- und Entwicklerflüssigkeiten, Träger von Geschmacksstoffen in Lebensmitteln und biologisch abbaubare Fischernetze erprobt und getestet.[31]
In der Landwirtschaft können PHAs z. B. als Folien bzw. als Mulch und in Aquakulturen als Biofilmträger zur Denitrifikation eingesetzt werden.[32]
In der Kosmetik ersetzt PHA insbesondere Mikroplastik. PHA kann die Formulierung verdicken.
Je nach Co-monomer Zusammensetzung und Molekulargewicht lassen sich die PHA einsetzen als: Multifilament; Spinnvlies; Synthetisches Papier; als Latex zur Papierbeschichtung, Schäume; Spritzguss; Starre, geblasene Formen; Thermoformen; Geblasene Filme und Folien; Film für Gussformen; Elastomerer Film; Haftvermittler; Klebstoff.[12]
PHA als Verdickungs- und Bindemittel in technischen Schmierstoffen.[33]
Ökologie
PHA zerfallen beim biologischen Abbau in der industriellen Kompostierung und in Biogasanlagen ebenso wie auf dem heimischen Komposthaufen, in Erde und im Meer vergleichsweise schnell und zu 100 %. Der biologische Zersetzungsprozess kann sowohl an der Luft als auch im Wasser stattfinden. So bauen sich Implantate wie Schrauben, die nach Knochenbrüchen eingesetzt werden, oder chirurgisches Nahtmaterial ohne weiteren Eingriff ab. Aber auch in PHA eingearbeitete Medikamente und Wirkstoffe sind zur zeitlich gezielten Freisetzung im menschlichen Körper einsetzbar.[10][31]
In DE102015214766 wird der Einsatz von PHA als biologisch kompostierbare Kaffeekapseln beschrieben. Ihr Einsatz wird in bioabbaubaren Lösungsmitteln und als elektrisch leitendes Polymer beschrieben.[16]
Weblinks
- Biopolymere – Rohstoffe für innovative Medizinprodukte auf biooekonomie-bw.de, abgerufen am 8. November 2018.
- Zulfiqar Ali Raza, Sharjeel Abida, Ibrahim M.Banat: Polyhydroxyalkanoates: Characteristics, production, recent developments und applications, Review. (pdf) In: International Biodeterioration & Biodegradation. 126, Januar 2018, S. 45-56. doi:10.1016/j.ibiod.2017.10.001.
- Harvey Williams, Patricia Kelly: Polyhydroxyalkanotes; Biosynthesis, Chemical Structures and Applications, Nova, Complimentary Contributor Copy
- Elodie Bugnicourt; Patrizia Cinelli; Vera Alejandra Alvarez; Andrea Lazzeri: Polyhydroxyalkanoate (PHA): Review of synthesis, characteristics, processing and potential applications in packaging, eXPRESS Polymer Letters 8(11):791-808 · June 2014
Einzelnachweise
- Kesaven Bhubalan, Wing-Hin Lee, Kumar Sudesh: Biologisch abbaubar Polymere im klinischen Gebrauch und in der klinischen Entwicklung. In: Polyhydroxyalkanoate. John Wiley & Sons, Inc., 3. Mai 2011, ISBN 978- 1-118-01581-0, S. 247–315, doi:10.1002/9781118015810.ch8.
- Yoshiharu Doi, Alexander Steinbuchel: Biopolymers. Wiley-VCH, Weinheim, Deutschland 2002, ISBN 978-3-527-30225-3.
- Siddharth Priyadarshi, Anubha Shukula, Babasaheb Bhaskarrao Borse: Polyhydroxyalkanoates: Role of Ralstonia eutropha. In: International Journal of Biomedical And Advance Research. 2. Mai 2014. doi:10.7439/ijbar.
- Elizabeth C. Wittenborn, Marco Jost,Yifeng Wei,JoAnne Stubbe, Catherine L. Drennan,: Structure of the Catalytic Domain of the Class I Polyhydroxybutyrate Synthase from Cupriavidus necator. (pdf) In: Journal of Biological Chemistry. 291, Nr. 48, Oktober 2016, S. 25264-25277. doi:10.1074/jbc.M116.756833. PMID 27742839. PMC 5122792 (freier Volltext).
- Giin-Yu Amy Tan, Chia-Lung Chen, Ling Li, Liya Ge, Lin Wang, Indah Mutiara Ningtyas Razaad, Yanhong Li, Lei Zhao, Yu Mo und Jing-Yuan Wang: Start a Research on Biopolymer Polyhydroxyalkanoate (PHA): A Review'. (pdf) In: Polymers. 6, Nr. 3, März 2014, S. 706-754. doi:10.3390/polym6030706.
- P4SB, from plastic waste to plastic value using Pseudomonas putida, Synthetic Biology, Abgerufen 27. Januar 2021
- Kasra, MarielPerez-ZabaletaIsaacOwusu-AgyemanZeynepCetecioglu: Waste to bioplastics: How close are we to sustainable polyhydroxyalkanoates production?. In: Waste Management. 119, Januar 2021, S. 374-388. doi:10.1016/j.wasman.2020.10.008.
- Jia Yu: Ralstonia eutropha in Microbial Production of Bioplastics from Renewable Resources 2007
- Nyok Lau Lau, Kumar Sudesh: Revelation of the ability of Burkholderia sp. USM (JCM 15050) PHA synthase to polymerize 4-hydroxybutyrate monomer. In: AMB Express. 2, Nr. 1, August 2012, S. 41. doi:10.1186/2191-0855-2-41. PMID 22877240. PMC 3434029 (freier Volltext).
- A.J. Anderson, Dawes, First2=E.A.: Occurrence, metabolism, metabolic role, and industrial uses of bacterial polyhydroxyalkanoates.. In: Microbiology Reviews. 54 pages =450-472, April 1990. PMID 2087222.
- Guozhan Jiang, David J. Hill, Marek Kowalczuk, Brian Johnston, Grazyna Adamus, Victor Irorere, Iza Radecka: Carbon Sources for Polyhydroxyalkanoates and an Integrated Biorefinery. In: International Journal of Molecular Science. 17, Nr. 7, Juli 2016, S. 1157. doi:10.3390/ijms17071157. PMID PMID 27447619. PMC 4964529 (freier Volltext).
- Elodie Bugnicourt, Patrizia Cinelli, Vera Alvarez, Undrea Lazzeri: Polyhydroxyalkanoate (PHA): Review of synthesis, characteristics, processing and potential applications in packaging. In: eXPRESS Polymer Letters. 8, Nr. 11, 2014, S. 791-808. doi:10.3144/expresspolymlett.2014.82.
- Justyna Mo˙zejko-Ciesielska, Robert Kiewisz: Bacterial polyhydroxyalkanoates: Still fabulous?. In: Microbiological Research. 192, März 2016, S. 271-282. doi:10.1016/j.micres.2016.07.010.
- Martin Koller: Advances in Polyhydroxyalkanoate (PHA) Production. In: Bioengineering (Basel).. 4, Nr. 4, Dezember 2017, S. 88. doi:10.3390/bioengineering4040088. PMID 29099065. PMC 5746755 (freier Volltext).
- Constantina Kourmentza, J. Plácido, N. Venetsaneas, A. Burniol-Figols, C. Varrone, H. N. Gavala, M. A. Reis: Recent Advances und Challenges towards Sustainable Polyhydroxyalkanoate (PHA) Production (Review). In: Bioengineering. 4, Nr. 2, Juni 2017, S. 8-50. doi:10.3390/bioengineering4020055. PMID 28952534. PMC 5590474 (freier Volltext).
- Shankar Aditi, D’Souza Shalet, Narvekar Manish, Rao Pranesh, Tembadmani Katyayini: Microbial production of polyhydroxyalkanoates (PHA) from novel sources: A Review. (pdf) In: International Journal of Research in Biosciences. 4, Nr. 4, Oktober 2015, S. 16-28. ISSN 2319-2844.
- El-malek, Marian Rofeal, Aida Farag, Sanaa Omar,Heba Khairy: Polyhydroxyalkanoate nanoparticles produced by marine bacteria cultivated on cost effective Mediterranean algal hydrolysate media. In: Journal of Biotechnology. 328, Januar 2021, S. 95-105. doi:10.1016/j.jbiotec.2021.01.008.
- Sohail, Nazia Jamil: Characterization and Degradation of Polyhydroxyalkanoates (PHA), Polylactides (PLA) and PHA-PLA Blends. In: Research Square. Dezember 2020. doi:10.21203/rs.3.rs-113670/v1.
- Emilia Inone-Kauffmann: Polyhydroxyfettsäuren (PHF). In: Hans Domininghaus: Die Kunststoffe und ihre Eigenschaften. 6. Aufl., Springer Verlag, 1990, ISBN 3-540-21410-0, S. 1451–1454.
- Nicolas. Jacquel, Chi‐Wei Lo, Ho‐Shing Wu, Yu‐Hong Wei, Shaw S. Wang: Solubility of polyhydroxyalkanoates by experiment und thermodynamic correlations. In: AlChE J. 53, Nr. 10, 2007, S. 2704–2714. doi:10.1002/aic.11274.
- Heinrich, Mohamed H. Madkour, Mansour A AL-Ghamdi, Ibraheem I Sabbaj, Alexander Steinbüchel: Large scale extraction of poly(3-hydroxybutyrate) from Ralstonia eutropha H16 using sodium hypochlorite. In: AMB Express. 2, Nr. 59, November 2012. doi:10.1186/2191-0855-2-59.
- Murugesan, Regupathi Iyyasamy: Nonionic surfactants induced cloud point extraction of Polyhydroxyalkanoate from Cupriavidus necator. In: Separation Science and Technology. 52, Nr. 12, März 2017, S. 1929-1937. doi:10.1080/01496395.2017.1307227.
- Andréia Neves, José Müller: Use of enzymes in extraction of polyhydroxyalkanoates produced by Cupriavidus necator. In: Biotechnology Progress. 28, Nr. 6, 22. August 2012, S. 1575-1580. doi:10.1002/btpr.1624.
- Martin Koller, Horst Niebelschütz, Gerhart Braunegg: Strategies for recovery and purification of poly[(R)‐3‐hydroxyalkanoates] (PHA) biopolyesters from surrounding biomass. In: Engineering in Life Science. 13, Nr. 6, November 2013, S. 549-556. doi:10.1002/elsc.201300021.
- Mohamed H. Madkour‡, Daniel Heinrich†, Mansour A. Alghamdi‡, Ibraheem I. Shabbaj‡, and Alexander Steinbüchel: PHA recovery from biomass. In: Biomacromolecules. 9, Nr. 14(9), September 2013, S. 2963-2972. doi:10.1021/bm4010244. PMID 23875914.
- Lemougne: Produits de Deshydration et de Polymerisation de L'acide β=Oxybutyrique. In: Bull. Soc. Chim. Biol.. 8, 1926, S. 770-782.
- Presidential Green Chemistry Challenge: 2005 Small Business Award, Metabolix, Inc. (technology acquired by CJ CheilJedang), Producing Nature's Plastics Using Biotechnology, Juni 2005
- Bioplastic Markt Daten abgerufen 30. Januar 2021.
- Researchers create the first straws using polyhydroxyalkanoate (PHA) plastic
- Chen, Qiong Wu: The application of polyhydroxyalkanoates as tissue engineering materials. In: Biomaterials. 26, November 2005, S. 6565-6578. doi:10.1016/j.biomaterials.2005.04.036.
- Polyhydroxyalkonate Materialeigenschaften abgerufen am 8. November 2018.
- K.Shantini; Kai-Hee Huong; Hema Ramachandran; A.A. Amirul: Microbial Production of Polyhydroxyalkanoates for Agricultural and Aquacultural Applications, Beneficial Microorganisms in Agriculture, Aquaculture and Other Areas pp 129-164
- Große Fortschritte bei der Entwicklung umweltverträglicher Schmierstoffe