Natriumgluconat
Natriumgluconat ist eine chemische Verbindung des Natriums aus der Gruppe der Carbonsäuresalze und das Natriumsalz der Gluconsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
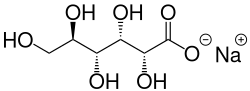 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumgluconat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H11NaO7 | |||||||||||||||
| Kurzbeschreibung |
weißer, fast geruchloser Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 218,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
0,8 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumgluconat wird technisch durch die Oxidation von Glucose oder glucosehaltigen Rohstoffen (zum Beispiel mit Natronlauge oder Natriumacetat[6]) hergestellt. Die Glucose kann chemisch, elektrolytisch oder biochemisch (zum Beispiel Fermentation[7]) oxidiert werden.[8]
Eigenschaften
Natriumgluconat ist ein brennbarer, schwer entzündbarer, kristalliner, weißer und fast geruchloser Feststoff, der leicht löslich in Wasser ist. Bei Temperaturen ab etwa 200 °C zersetzt sich die Verbindung.[3] Die Verbindung ist hydrolysebeständig, kurzzeitig auch bei hohen Temperaturen und pH-Werten.[8]
Verwendung
Natriumgluconat ist ein guter Chelator bei alkalischem pH-Wert, mit einer Chelatbildnerleistung, die besser ist als EDTA, NTA und andere Chelatoren. Es hat ein breites Spektrum an industriellen Anwendungen, darunter Textilfärbung, Wasserbehandlung und als Reinigungsmittel für Glasflaschen. Es findet auch Verwendung als Entrostungsmittel in der Metallurgie und als Zusatzstoff im Zement.[4] Die reinigende Wirkung von Natriumgluconat beruht auf der Bildung von Metallionen-Komplexen, die im neutralen und besonders im alkalischen Milieu stabil sind. Dies wird genutzt zum Entoxidieren von Stahl, Kupfer und dessen Legierungen, zum Entfetten oder Ätzen von Aluminium und zum Entzinken von Werkstücken. Bei 95 bis 100 °C werden Farb- und Lackschichten abgelöst.[8] Es wird in Lebensmitteln zur Maskierung des bitteren Nachgeschmacks von Süßstoffen, zur Verbesserung der Quellfähigkeit und Löslichkeit von Milcherzeugnissen und als Elektrolyt-Regenerator eingesetzt.[4][9]
Die Verbindung gilt als unbedenklich.[10]
Einzelnachweise
- Eintrag zu E 576: Sodium gluconate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 28. Juni 2020.
- Eintrag zu SODIUM GLUCONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Natriumgluconat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Datenblatt Sodium D-gluconate, 97% bei AlfaAesar, abgerufen am 9. Januar 2019 (PDF) (JavaScript erforderlich).
- Datenblatt Gluconsäure+Natriumsalz (PDF) bei Merck, abgerufen am 9. Januar 2019.
- R. B. Bian, J. Shen: Synthesis of Sodium Gluconate by Bi Promoted Pd/C Catalyst. In: MATERIALS TRANSACTIONS. 48, 2007, S. 2252, doi:10.2320/matertrans.MRP2006634.
- R. H. Blom, V. F. Pfeifer u. a.: SODIUM GLUCONATE PRODUCTION. FERMENTATION WITH ASPERGILLUS NIGER. In: Industrial & Engineering Chemistry. 44, 1952, S. 435, doi:10.1021/ie50506a061.
- Franz v. Bruchhausen, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis Folgeband 5: Stoffe L-Z. Springer-Verlag, 2013, ISBN 978-3-642-58388-9, S. 270 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerhard Eisenbrand, Peter Schreier: RÖMPP Lexikon Lebensmittelchemie, 2. Auflage, 2006. Georg Thieme Verlag, 2014, ISBN 3-13-179282-5, S. 447 (eingeschränkte Vorschau in der Google-Buchsuche).
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Gluconic acid, monosodium salt, abgerufen am 9. Januar 2019.