Xylole
Die Xylole (von altgriechisch ξύλον xýlon „Holz“), auch Xylene oder nach der IUPAC-Nomenklatur Dimethylbenzene, sind flüssige organisch-chemische Verbindungen mit einem charakteristischen aromatischem Geruch und der allgemeinen Summenformel C8H10. Sie zählen zu den aromatischen Kohlenwasserstoffen und bestehen jeweils aus einem Benzolring mit zwei Methylsubstituenten (–CH3). Durch unterschiedliche Anordnung der Methylgruppen ergeben sich drei Konstitutionsisomere des Xylols: 1,2-Xylol (ortho-Xylol), 1,3-Xylol (meta-Xylol) und 1,4-Xylol (para-Xylol). In der Technik (z. B. als Lösungsmittel) werden sie meist als (ungetrenntes) Isomerengemisch verwendet und setzen sich in der Regel aus 60 % m-Xylol, 10–25 % o-Xylol und 10–25 % p-Xylol zusammen. Als Lösungsmittel verwendete Xylolmischungen enthalten häufig auch Ethylbenzol, das im gleichen Temperaturbereich siedet und ähnliche Lösungseigenschaften besitzt.
Vertreter
| Xylole | ||||||||||||
| Name | o-Xylol | m-Xylol | p-Xylol | |||||||||
| Andere Namen | 1,2-Dimethylbenzol 1,2-Dimethylbenzen | 1,3-Dimethylbenzol 1,3-Dimethylbenzen | 1,4-Dimethylbenzol 1,4-Dimethylbenzen | |||||||||
| Strukturformel | 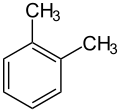 |
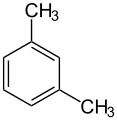 |
||||||||||
| CAS-Nummer | 95-47-6 | 108-38-3 | 106-42-3 | |||||||||
| 1330-20-7 (Isomerengemisch)[1] | ||||||||||||
| PubChem | 7237 | 7929 | 7809 | |||||||||
| ECHA-InfoCard | 100.002.203 | 100.003.252 | 100.003.088 | |||||||||
| 100.014.124 (Isomerengemisch) | ||||||||||||
| Summenformel | C8H10 | |||||||||||
| Molare Masse | 106,17 g·mol−1 | |||||||||||
| Aggregatzustand | flüssig | |||||||||||
| Kurzbeschreibung | farblose Flüssigkeit | |||||||||||
| Schmelzpunkt | −25 °C[2] | −48 °C[3] | 13 °C[4] | |||||||||
| Siedepunkt | 144 °C[2] | 139 °C[3] | 138 °C[4] | |||||||||
| Löslichkeit in Wasser | 180 mg·l−1[2] | 174 mg·l−1[3] | 200 mg·l−1[4] | |||||||||
| GHS- Kennzeichnung |
aus Verordnung (EG) Nr. 1272/2008 (CLP),[5] ggf. erweitert
|
aus Verordnung (EG) Nr. 1272/2008 (CLP),[6] ggf. erweitert
|
aus Verordnung (EG) Nr. 1272/2008 (CLP),[7] ggf. erweitert
| |||||||||
| H- und P-Sätze | 226‐304‐312‐315‐319‐335‐412[2] | 226‐304‐312‐332‐315‐319‐335‐412[3] | 226‐304‐312‐315‐332‐319‐335‐412[4] | |||||||||
| 210‐261‐273‐301+310‐302+352‐312‐331[2] | 261‐273‐280‐301+310‐305+351+338‐331[3] | 210‐280‐305+351+338‐301+330+331[4] | ||||||||||
| MAK | Schweiz: 100 ml·m−3 bzw. 435 mg·m−3[8] | |||||||||||
Eigenschaften
Xylole sind farblose Flüssigkeiten, die kaum in Wasser löslich sind (0,2 g/l). In Ethern, Alkoholen, Benzol und Aceton zeigen sie jedoch gute Löslichkeit. Wässrige Lösungen zeigen schon im Konzentrationsbereich von 0,53 bis 1,8 ppm einen erkennbaren Geschmack. Xylole haben typische aromatische Gerüche; die Geruchsschwelle liegt bei 0,2 und 174 mg/m3. Die Siedepunkte der drei Isomere liegen nah beieinander, während ihre Schmelzpunkte sich deutlich unterscheiden. Das p-Xylol besitzt, wie z. B. Benzol oder Cyclohexan, durch seine energetisch günstigere Symmetrie (Anordnung der Atome) einen vergleichsweise hohen Schmelzpunkt. Die Dichte beträgt 0,86–0,88 g/cm3[1]; die Xylole sind also alle leichter als Wasser. Der Flammpunkt liegt bei etwa 30 °C (abhängig vom Isomer),[1] die Zündtemperatur zwischen 463 und 528 °C.[1] Sie verbrennen mit stark rußender Flamme.
Gewinnung und Darstellung
Rohstoffquellen für die Gewinnung der Xylole sind Kohle (aus Steinkohlenteer) und Erdöl (durch Cracken), wobei Isomerengemische anfallen. Da die Isomere ähnliche Siedepunkte haben, ist eine Auftrennung durch Destillation schwierig. Die Abtrennung des o-Isomers wird technisch durch Rektifikation durchgeführt, anschließend kann p-Xylol aufgrund seines relativ hohen Schmelzpunktes durch Ausfrieren getrennt werden. Großtechnisch spielt die Abtrennung des p-Xylols mit Hilfe der Adsorption mit einem Molekularsieb eine wichtige Rolle.
Verwendung
Xylole finden als Lösungsmittel Verwendung und dienen zur Herstellung von Kunst- und Klebstoffen. Da der Flammpunkt von Xylol oberhalb von 21 °C liegt, ist es in der Praxis neben Butylacetat eines der wichtigsten Lösungsmittel für Lacke. Weiterhin werden sie Kraftstoffen zur Erhöhung der Oktanzahl beigemengt.
p-Xylol ist Ausgangsstoff für Terephthalsäure, die zur Herstellung von gesättigten Polyestern verwendet wird. o-Xylol dient zur Gewinnung der Phthalsäure, meist für die Herstellung von Kunstharzen oder Kunstfasern. Durch Nitrierung erhält man die Nitroxylole, die durch anschließende Reduktion zur Darstellung der Xylidine dienen.
Neben Toluol gehören die Xylole zu den technisch wichtigsten aromatischen Kohlenwasserstoffen, den sogenannten BTEX-Aromaten.
Reaktionen
Die Methylgruppen (–CH3) können zu Carboxygruppen oxidiert werden. Geeignete Oxidationsmittel zur Umsetzung beider Methylgruppen sind beispielsweise Kaliumpermanganat oder Chromschwefelsäure. o-Xylol wird so in Phthalsäure, m-Xylol in Isophthalsäure und p-Xylol in Terephthalsäure überführt. o-Xylol kann katalytisch – z. B. an Vanadium(V)oxid – in der Gasphase zu Phthalsäureanhydrid oxidiert werden.[9] Durch Sauerstoff (z. B. in Gegenwart von Cobalt(II)-stearat als Katalysator) erhält man die entsprechenden Monocarbonsäuren, die Toluylsäuren (Methylbenzoesäuren). Ebenfalls durch selektive Oxidation lassen sich die Benzoldicarbaldehyde erhalten. Xylole gehen die für Aromaten typischen Substitutionsreaktionen ein.
Gefahren
Xylole sind entzündlich und wirken gesundheitsschädigend bei Aufnahme über die Haut und die Atemwege. Sie können zum Beispiel Kopfschmerzen, Gedächtnis- und Orientierungsstörungen, Schwindel und Atemnot hervorrufen. Xylole sind wassergefährdend (WGK 2).[1] Zwischen einem Luftvolumenanteil von 1 bis 8 % bilden sie explosive Gemische.[1] Emissionen von Xylolen sind hauptsächlich auf den Kfz-Verkehr zurückzuführen. In den letzten Jahren ist ein Rückgang der Xylolemissionen zu verzeichnen.
Die Xylole wurden 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme der Xylole waren die Besorgnisse bezüglich Verbraucherverwendung, kumulative Exposition, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen und der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung soll ab 2020 von Deutschland durchgeführt werden.[10]
Literatur
- Bewertung von Toluol- und Xylol-Immissionen. Erich Schmidt Verlag, Berlin (2000), ISBN 3-503-04071-4.
Weblinks
- Hedinger: Sicherheitsdatenblatt Xylole. (PDF-Datei; 197 kB)
Einzelnachweise
- Eintrag zu Xylol, Isomerengemisch in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu o-Xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu m-Xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu p-Xylol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu o-xylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu m-xylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu p-xylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1330-20-7 bzw. Xylol (alle Isomere)), abgerufen am 14. September 2019.
- Bertram Philipp, Peter Stevens: Grundzüge der Industriellen Chemie, VCH Verlagsgesellschaft mbH, Weinheim 1987, ISBN 3-527-25991-0, S. 181.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Xylene, abgerufen am 20. Mai 2019.


