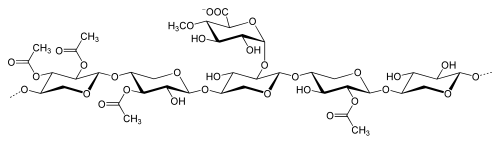
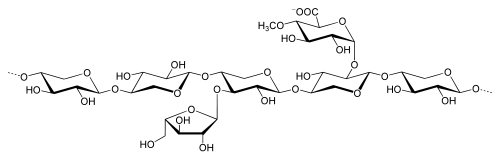
Xylane
Xylane sind pflanzliche Heteropolysaccharide und gehören zu den Hemicellulosen, ihre Hauptwiederholungseinheit (Monomereinheit) ist die D-Xylose. Die Hemicellulosen sind Bestandteil der Zellwand von Pflanzen. In der Natur sind Xylane das zweithäufigste Polysaccharid.[2] Wegen unterschiedlichen Modifikationsmöglichkeiten sind Xylane keine eindeutig definierbare Komponente.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
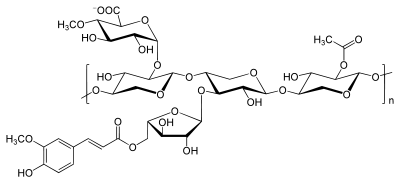 | |||||||
| Allgemeines | |||||||
| Name | Xylan | ||||||
| CAS-Nummer | 9014-63-5 | ||||||
| Monomere/Teilstrukturen | Xylose | ||||||
| Art des Polymers | |||||||
| Kurzbeschreibung |
hellbeigefarbenes Pulver[1] | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
>300 °C[1] | ||||||
| Löslichkeit |
unlöslich in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Xylane als Polysaccharide von Pflanzen
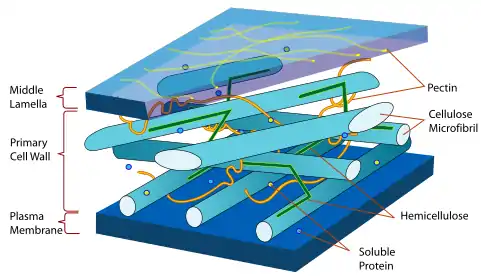
Die Xylane erhielten diesen Namen um 1890 von E.W. Allen und Bernhard Tollens, weil sie annahmen, Xylose sei das einzige Hydrolyseprodukt dieser Naturstoffe. Sie sind neben der Cellulose das wohl wichtigste Polysaccharid in der Pflanzenwelt. Xylane sind die wichtigsten Vertreter der Hemicellulosen bzw. Polyosen.
Die Funktionen und strukturellen Eigenschaften der Xylane lassen sich am deutlichsten im Vergleich mit der Cellulose darstellen. Im Gegensatz zur Cellulose liegt ihnen nicht nur ein einziges, lediglich unterschiedlich stark polymerisiertes Monomer zugrunde. Vielmehr unterscheiden sie sich im Mengenanteil und in ihrer chemischen Struktur je nach Pflanzenfamilien voneinander. Nach ihren Monosaccharid-, Uronsäure- und Acetyl-Bausteinen unterscheidet man grob in Arabino-4-O-methylglucuronoxylan aus Nadelhölzern und in vielfältigerer Form aus Monokotyledonen und O-Acetyl-4-O-methylglucuronoxylan aus Laubhölzern, sowie einige weitere, seltener vorkommende Strukturen und nachträgliche Modifikationen z. B. durch Aufschlussverfahren. Als Monosaccharide können D-Xylose, D-Mannose, D-Glucose, D-Arabinose, D-Galactose, D-Glucuronsäure und D-Galacturonsäure fungieren.[2]
Ein weiterer Unterschied zur Cellulose ist die wesentlich kürzere Kettenlänge der Xylane, die in Lignocellulosen normalerweise maximal 200 Bausteine beträgt.
Die Seitengruppen der Xylane erlauben es nicht im gleichen Maß wie bei der Cellulose, kristalline Strukturen aufzubauen, sodass Xylan wohl in vivo nur amorph vorkommt, obwohl auch die Bildung von Mischkristallen mit Cellulose in Erwägung gezogen wird. Auch die Aufgaben des Xylans als Hemicellulose im Verband der Gerüstmaterialien unterscheiden sich von der Cellulose. Bei den Hemicellulosen stehen nicht die Festigkeitseigenschaften im Vordergrund, vielmehr wirken sie zwischen Cellulose und Lignin vermittelnd. Ihre Funktion wird daher auch als die eines natürlichen Weichmachers und Unterstützungsmaterials beschrieben. Für die Substanz bzw. das Substanzgemisch (hauptsächlich Xylane), das durch verdünnte Lauge aus Holz extrahiert werden kann, wurde früher die Bezeichnung Holzgummi verwendet.
Zur Darstellung der Verteilung der Hemicellulosen und damit auch des Xylans im Zellwandverbund wurden eine Reihe verschiedener Modelle entwickelt, denen gemeinsam ist, dass die Hemicellulosen um die Cellulosefibrillen eine verbindende Schicht bilden, die das Einbetten der Cellulose in die Ligninmatrix erlaubt. Indiz hierfür bietet die Abwesenheit von Hemicellulosen in ligninfreier natürlicher Cellulose, wie etwa Baumwolle. Eine weitere Begründung für das Vorhandensein von Hemicellulosen wäre in ihrer hygroskopischen Eigenschaft zu suchen, die zu einem Feuchtegleichgewicht der Zellwand beitragen könnte.
Die Gesamtheit der unterschiedlichen chemischen und physikalischen Strukturmerkmale der Xylane, die neben ihrer Herkunft auch durch Isolierungsmethoden und technische Prozesse beeinflusst werden, bilden ein recht komplexes System. Die letztlichen Eigenschaften und gegebenenfalls die Eignung für den vorgesehenen Verwendungszweck, sei es im Zellstoff oder in isolierter Form, ergeben sich nur im Zusammenspiel all dieser Punkte.
Vorkommen von Xylanen

Wie schon erwähnt sind die Xylane die in der Natur am weitesten verbreiteten Hemicellulosen, sie kommen in allen Landpflanzen und auch in einigen Algen vor. In den Nadel- und Laubhölzern stellen sie jeweils etwa 10–15 % bzw. 10–35 % der Holzsubstanz. Die Spannweite dieser Angaben zeigt jedoch schon, dass es bedeutende Unterschiede in den Gehalten zwischen verschiedenen Arten, in unterschiedlichen Geweben und in den verschiedenen Schichten der Zellwand gibt. Entsprechend der geforderten Aufgabe in der Pflanze konzentrieren sich die Xylangehalte z. B. auf die verschiedenen Zellwandschichten. In Tracheiden von Spätholz kann mehr Xylan gefunden werden als in denen von Frühholz.
Da Xylane auch in hohen Anteilen (bis 40 %) in der Biomasse von Monokotyledonen und damit auch in landwirtschaftlichen Abfallprodukten enthalten sind, stehen sie zumindest theoretisch in enormen Mengen als Rohstoff zur Verfügung.
Durchschnittlicher Polymerisationsgrad (DP)
Für den Polymerisationsgrad (Pn) von Holzxylanen findet man Durchschnittswerte für Arabino-4-O-methylglucuronoxylan von größer 120 und für O-Acetyl-4-O-methylglucuronoxylan von 200. Es existiert aber eine große Schwankungsbreite, die von der betrachteten Holzart abhängt. Bei den Nadelholzxylanen reichen die Literaturwerte von 73 bis 185 und bei den Laubholzxylanen von 86 bis 218. Wesentlich höher können die Polymerisationsgrade bei Monokotyledonen sein, für wasserlösliches Xylan aus Roggenkleie existieren DP-Werte von 418, für die entsprechende wasserunlösliche Fraktion sogar von 674. Allerdings werden die erhaltenen Werte in hohem Maße von der jeweils verwendeten Isolierungs- und Messmethode beeinflusst und unterliegen dadurch großen Schwankungen.
Haupt- und Seitenketten
Die Verknüpfung der Hauptkette, die stets nur aus β-D-Xylopyranose-Einheiten (Xyl) besteht, ist entweder in β-(1→3)- oder β-(1→4)-glycosidischer Form möglich, wobei die β-(1→3)-Form nur bei Algen und Tangen gefunden wurde. Normalerweise wird bei Laub- und Nadelholzxylanen von unverzweigten Ketten ausgegangen, jedoch könnten pro Molekül auch ein bis zwei Verzweigungen auftreten.
An der Grundkette treten neben den möglichen Verzweigungen in unterschiedlichem Maße Seitengruppen aus Zuckern und Zuckerderivaten auf. Während Esparto-Xylan nur Seitenketten aus weiteren Xylose-Einheiten, also echte Verzweigungen, besitzt, findet man die komplexesten Xylane v. a. in Spezialgeweben (z. B. Samenhüllen) von Monokotyledonen. Die Verzweigungen bestehen zumeist nur aus monomeren Einheiten, können jedoch auch dimer oder oligomer sein. Als Zuckerbausteine kommen dabei L-Arabinofuranose (Ara), D-Xylopyranose und in seltenen Fällen Hexosen vor. Rhamnose findet sich in geringen Mengen als Bestandteil der Endgruppe im Xylan. Weitere mögliche Seitenketten bilden die Uronsäuren D-Glucuronsäure (GluA) und 4-O-Methyl-D-Glucuronsäure (Me-GluA), sowie O-Acetylgruppen (Ac).
Wie bereits erwähnt ist das O-Acetyl-4-O-Methylglucuronoxylan typisch für die Laubhölzer und das Arabino-4-O-Methylglucuronoxylan typisch für die Nadelhölzer. Es wurden aber auch schon Arabinoxylane aus Laubhölzern isoliert, z. B. aus Lorbeergewächsen oder Zimtrinde.
Die 4-O-Methylglucuronsäure-Seitenketten sind am Kohlenstoffatom 2 des Xyloserings α-(1→2)-glycosidisch verknüpft, die Arabinofuranose-Bausteine der Nadelholz- und Monokotyledonenxylane α-(1→3)-glycosidisch am Kohlenstoffatom 3 der Xylose. In Laubholzxylanen (der temperierten Zone) tragen außerdem 50 % bis 60 % der Xyloseeinheiten O-Acetyl-Gruppen, der Gehalt kann jedoch insgesamt von ca. 3 % bis ca. 12 % der Masse schwanken. In Birkenxylan beträgt das Verhältnis an unsubstituierten, C2-, C3- und di-substituierten Bausteinen 44 : 24 : 22 : 10. Für die Wasserlöslichkeit ist ein hoher Acetylierungsgrad des Xylans günstig. Im Holz nimmt der Acetylierungsgrad mit dem Alter ab, da sich v. a. im Kernholz durch ein saures Medium aus den Acetyl-Seitengruppen Essigsäure bildet.
Sehr wichtig für die Eigenschaften der Xylane, vor allem die Löslichkeit, ist neben der Häufigkeit von Seitengruppen auch die Zusammensetzung der Seitengruppen und deren Verteilung entlang der Kette, da durch die „Störungen“, welche die Substituenten darstellen, intermolekulare Zusammenlagerungen verhindert werden können.
Für Laubholzxylan ist das am häufigsten gefundene durchschnittliche Verhältnis von Xylose zu 4-O-Methyl-Glucuronsäure 10 : 1. Die Variationsbreite liegt bei 6 : 1 bis 11 : 1, wobei auch Fraktionen mit Verhältnissen von 3 : 1 gefunden wurden. Die Verteilung der Seitenketten innerhalb des Xylans einer Pflanze ist also nicht konstant.
Für Nadelhölzer liegen die 4-O-Methylglucuronsäure-Anteile höher. Dort liegt das Verhältnis Xylan zu 4-O-Methyl-Glucuronsäure gewöhnlich bei ca. 5-6 : 1, wobei auch Werte von 3 bis 4 : 1 vorkommen. Die Arabinose-Gruppen treten am Xylan in Verhältnissen von durchschnittlich (Xyl : Ara) 6-10 : 1 auf, und zeigen damit ebenfalls eine große Variabilität. Als durchschnittliches Verhältnis der drei Komponenten im Nadelholz kann 8 : 1,6 : 1 (Xyl : Me-GluA : Ara) angegeben werden, wobei die Werte zwischen 10 : 3 : 1 und 2,5 : 0,8 : 1 schwanken. Wie an verschiedenen Nadel- und Laubhölzern gezeigt werden konnte, ist die Verteilung der 4-O-Methylglucuronsäure-Reste entlang der Kette bei den beiden Holzartengruppen unterschiedlich. Während in Nadelholzxylan über die Xylan-Grundkette hinweg eine mehr oder weniger gleichmäßige Verteilung der Seitengruppen an jeder 7. bis 8. Xyloseeinheit vorliegt, wechseln sich in Laubholzxylan Bereiche mit intensiver Substitution (etwa an jeder zweiten Xyloseeinheit) und solche ohne Seitengruppen irregulär ab. Durch die vielen in Hemicellulosen zur Verfügung stehenden Hydroxygruppen und die amorphe Struktur zeigen sie eine starke Hygroskopizität und sind daher durch ihre Einbettung in den Zellwandverband maßgeblich für das Quellen und Schwinden von Lignocellulosematerialien verantwortlich.
Biologischer Abbau
In der Natur werden Xylane durch sogenannte Xylanasen abgebaut.[2] Diese Enzyme katalysieren die Hydrolyse der Haupt- und Seitenketten. Xylanasen wurden in Meeresalgen, Protozoen, Krebstieren, Insekten, Schnecken und Samen von Landpflanzen gefunden. Hauptsächlich erfolgt der Abbau durch Mikroorganismen, so dass filamentöse Pilze für den biologischen Abbau hauptsächlich verantwortlich sind. Der Anteil sezernierter Xylanasen ist dabei höher als bei anderen Mikroorganismen, beispielsweise bei Hefen oder Bakterien.
Wegen der inhomogenen Struktur von Xylanen erfolgt der Abbau jedoch nicht durch eine Xylanase, sondern durch einen Enzymkomplex. Hierbei sind Endoxylanasen (EC 3.2.1.8) und β-D-Xylosidasen (EC 3.2.1.37) besonders wichtig. Um die modifizierten Seitenreste abzuspalten, werden zudem Ferulasäure-Esterasen, Cumarsäure-Esterasen, Acetylxylan-Esterasen (EC 3.1.1.6), α-Glucoronidasen und Arabinasen (EC 3.2.1.99) eingesetzt.
Einzelnachweise
- Datenblatt Xylane (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Polizeli, ML. et al. (2005): Xylanases from fungi: properties and industrial applications. In: Appl Microbiol Biotechnol. 67(5); 577–591; PMID 15944805; doi:10.1007/s00253-005-1904-7.
Literatur
- Polizeli, ML. et al. (2005): Xylanases from fungi: properties and industrial applications. In: Appl Microbiol Biotechnol. 67(5); 577–591; PMID 15944805; doi:10.1007/s00253-005-1904-7
- York, WS. und O'Neill, MA. (2008): Biochemical control of xylan biosynthesis – which end is up? In: Curr Opin Plant Biol. 11(3); 258–265; PMID 18374624; doi:10.1016/j.pbi.2008.02.007
- BY. Wang: Environmental biodegradation research focus. New York Nova Science Publishers 2007; ISBN 9781600219047
Weblinks
- Gerüstmaterialien TU Darmstadt (Memento vom 27. Mai 2005 im Internet Archive) (PDF, 164 KB)