Blastobotrys adeninivorans
Blastobotrys adeninivorans, auch Arxula adeninivorans, ist eine dimorphe Hefe-Art mit ungewöhnlichen Eigenschaften. Sie wurde zuerst Mitte der 1980er Jahre beschrieben und zunächst Trichosporon adeninivorans genannt.
| Blastobotrys adeninivorans | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
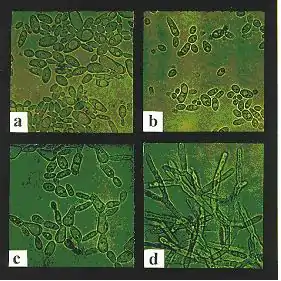
Mikroskopische Darstellung von B. adeninivorans Zellen, kultiviert bei 30 °C (a), 37 °C (b), 42 °C (c) und 45 °C (d). Man sieht den Übergang von normalen Hefezellen in filamentöse Zellen ab 42 °C | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Blastobotrys adeninivorans | ||||||||||||
| (Middelhoven, Hoogk.-Niet & Kreger) Kurtzman & Robnett |
Grundlagen
Nach ihrer Entdeckung in den Niederlanden wurden Stämme dieser Art u. a. in Sibirien und Südafrika gefunden. Sie wurden aus Bodenproben und Holzhydrolysaten isoliert. Nach detaillierten phylogenetischen Vergleichen mit verwandten Hefearten wurde Arxula adeninivorans im Jahre 2007 in Blastobotrys adeninivorans umbenannt. Der vormalige wissenschaftliche Name wird jedoch noch vielfach verwendet. Alle B. adeninivorans-Stämme weisen ungewöhnliche biochemische Aktivitäten auf. Sie sind in der Lage, neben verschiedenen Zuckern Amine, Adenin (daher der Name adeninivorans) und andere Purine als einzige Kohlenstoffquelle zu nutzen. Ferner können sie Nitrat assimilieren und sind thermotolerant, d. h., sie können bei Temperaturen bis 48 °C wachsen. Ein besonderes Charakteristikum von biotechnologischer Bedeutung ist ein temperaturabhängiger Dimorphismus. Bei Temperaturen über 42 °C wird eine reversible Umwandlung von normalen Hefezellen in filamentöse Formen (ähnlich der von Schimmelpilzen) induziert. Hefeformen kehren bei Absenkung der Kultivierungstemperatur unter 42 °C zurück. Mit der Änderung der Morphologie sind Unterschiede in der Sekretion von Proteinen und in der Modifikation (Anheften von Zuckerketten) verbunden (siehe Abbildung in Taxobox).
Biotechnologisches Potenzial
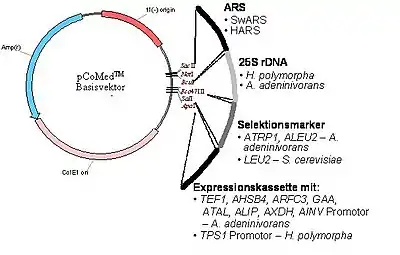
Die zuvor beschriebenen ungewöhnlichen Eigenschaften machen B. adeninivorans zu einem attraktiven Organismus für biotechnologische Anwendungen. Einerseits ist die Hefe eine Quelle für viele Enzyme mit interessanten Eigenschaften für industrielle Anwendungen und den entsprechenden Genen, darunter zum Beispiel Glucoamylasen, Tannase, Lipasen, Phosphatasen und viele andere. Andererseits ist B. adeninivorans ein sehr robuster und sicherer Organismus, der nach gentechnischer Veränderung genutzt werden kann, Proteine im industriellen Maßstab herzustellen. Dazu werden geeignete Wirtsstämme mit Plasmiden transformiert, in denen unter anderem die genetische Anweisung zur Herstellung derartiger Proteine enthalten ist (siehe Abbildung 2). Die Grundstruktur derartiger Plasmide ist ähnlich der, wie unter dem Wikipedia-Stichwort Hansenula polymorpha beschrieben.
Anwendungen in der Biotechnologie
In der akademischen Forschung[2] nutzte man diese Hefe für verschiedene Anwendungen.
Hier als exemplarisch zwei gentechnisch veränderte Stämme und ihre Anwendung:
In beiden Fällen wurden mehrere Plasmide mit unterschiedlichen Proteingenen gleichzeitig in die Hefe übertragen. Im ersten Beispiel wurde ein Stamm durch gentechnische Veränderung mit der Fähigkeit ausgestattet, ein auf biologischem Wege abbaubares Plastikmaterial herzustellen, nämlich PHA (Polyhydroxyalkanoat). Dazu musste ein neuer Syntheseweg, bestehend aus drei enzymatischen Schritten, in die Hefe übertragen werden. Die entsprechenden Gene phbA, phbB und phbC wurden aus dem Bakterium Ralstonia eutropha isoliert und in geeigneter, für die Hefe nutzbarer Form in Plasmide integriert. Diese Plasmide wurden in die Hefe eingeschleust, aber der so erzeugte gentechnisch veränderte Organismus war leider nicht in der Lage, das Plastikmaterial effizient herzustellen. Im zweiten Beispiel wurde ein Biosensor für den Nachweis von Östrogenen in Umweltproben entwickelt. Dazu wurde die Wirkkette des Östrogens in der Hefe imitiert. Zunächst wurde auf einem ersten Plasmid ein Gen für den menschlichen Östrogenrezeptor alpha (hERalpha) in die Hefe übertragen. Ein derartiger Rezeptor erkennt und bindet das Hormon jedoch erst in Konzentrationen über dem gesetzlichen Grenzwert. Der Rezeptor interagiert nach Bindung des Östrogens mit einem zweiten Gen, das durch diese Interaktion aktiviert wird. Ein solches „Reportergen“ wurde auf einem zweiten Plasmid in die Hefe übertragen. Das „Reportergen“ enthält die Produktionsanweisung für die Herstellung eines leicht mit einfachen Tests nachzuweisenden Proteins, etwa eines Enzymes oder eines Farbstoffes – dieses Gen lag in diesem Fall als Fusion an ein Kontrollelement vor, einem Promotor, der so modifiziert war, dass er den Rezeptor/Hormon Komplex erkennen konnte. Ein derartig veränderter Stamm kann in Gegenwart etwa von Abwasserproben kultiviert werde. Die Konzentration kann dann in Korrelation zur Menge des Reportergenproduktes (etwa Farbintensität oder Enzymaktivität) genau bestimmt werden.
Quellen
- Gerhard Steinborn, Erik Böer, Anja Scholz, Kristina Tag, Gotthard Kunze, Gerd Gellissen: Application of a wide-range yeast vector (CoMed™) system to recombinant protein production in dimorphic Arxula adeninivorans, methylotrophic Hansenula polymorpha and other yeasts. In: Microbial Cell Factories. Band 5, 2006, ISSN 1475-2859, S. 33, doi:10.1186/1475-2859-5-33.
- Arbeitsgruppe Hefegenetik - Forschungsgebiete. IPK-Gatersleben, archiviert vom Original am 24. Februar 2015; abgerufen am 18. August 2012.
Literatur
- G. Gellissen (Hrsg.): Production of recombinant proteins - novel microbial and eukaryotic expression systems. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31036-4.