Styrol
Styrol (auch Vinylbenzol, nach der IUPAC-Nomenklatur Phenylethen/ Ethenylbenzen) ist ein ungesättigter, aromatischer Kohlenwasserstoff. Es handelt sich um eine farblose, niedrigviskose und süßlich riechende Flüssigkeit. Styrol ist entzündlich und gesundheitsschädlich.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
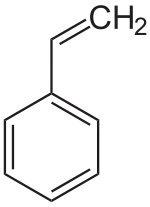 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Styrol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, süßlich riechende stark lichtbrechende Flüssigkeit[2][3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,91 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
145 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,5458 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Styrol ist ein leicht polymerisierbares, wichtiges Monomer zur Herstellung von Kunststoffen wie Polystyrol sowie Styrol-Acrylnitril, Acrylnitril-Butadien-Styrol und anderer Copolymere. Weltweit produzierte die chemische Industrie im Jahr 2010 etwa 25 Millionen Tonnen Styrol.[6]
Geschichte
Der Berliner Apotheker Eduard Simon erwarb um 1835 Styrax, das Harz des Orientalischen Amberbaumes (Liquidambar orientalis), der in Vorderasien wächst. Dieses Baumharz wurde schon bei den alten Ägyptern Parfüms und Heilmitteln beigemengt. Bei der Destillation dieses Baumwachses entdeckte er eine farblose Flüssigkeit und benannte sie nach dem Ausgangsstoff Styrol.[7][8] Als er die Flüssigkeit erwärmte, bildete sich ein neuer Stoff. Er nahm an, dass es sich um Styroloxid handelte.[7][9]
Der englische Chemiker John Blyth und der deutsche Chemiker August Wilhelm von Hofmann fanden jedoch 1845 durch Elementaranalyse heraus, dass sich die Stoffzusammensetzung nicht verändert hatte.[8] Marcelin Berthelot deutete die Veränderung bei der Erwärmung 1866 völlig richtig als Polymerisation. Hermann Staudinger, der sich hauptsächlich mit der Polymerchemie befasste, beschrieb schließlich in Thesen, dass durch die Erwärmung eine Kettenreaktion gestartet wird, bei der die Makromoleküle des Polystyrols entstehen.[10]
Ungefähr um 1930 begann die Entwicklung von technischen Verfahren zur Styrolherstellung. Vorher musste es aus dem Pyrolysebenzin isoliert werden. Während des Zweiten Weltkrieges stieg der Bedarf, weil es für das Styrol-Butadien-Copolymer benötigt wurde. Nach dem Zweiten Weltkrieg wurde es in größeren Mengen synthetisch hergestellt, weil es eine hohe Nachfrage nach Polystyrol gab.
Vorkommen

Styrol kommt in geringen Mengen im Styrax (Baumharz), im Steinkohlenteer und in Pyrolyseprodukten des Erdöls vor (ungefähr 7 % im Crackbenzin). In den letzten beiden Jahrzehnten ist eine Zunahme der Styrolemissionen durch vermehrten Einsatz von Styrol-Kunststoffen zu verzeichnen. Styrol ist in der Natur ein Aromastoff und kommt zum Beispiel in kleinen Mengen in Weintrauben und Kiwis vor, auch im Duft der Orchideenblüten ist es enthalten. Über die Wirkung ist wenig bekannt, wahrscheinlich dient es der Anlockung von Bestäubern im Falle der Blüten oder Konsumenten zur Samenverteilung bei den Früchten. Jüngere Forschungsarbeiten konnten nachweisen, dass Styrol auch beim Brauprozess von Weizenbier entstehen kann.[11]
Herstellung
Es gibt gegenwärtig zwei Verfahren zur Styrolherstellung mit technischer Bedeutung, die Dehydrierung von Ethylbenzol und das SM/PO-Verfahren. Im Jahr 2012 betrug die jährliche Weltproduktion von Styrol etwa 20 Millionen Tonnen.[12]
Dehydrierung von Ethylbenzol
Styrol wird im großtechnischen Maßstab aus Ethylbenzol hergestellt. Dieses wird destillativ aus der BTEX-Fraktion von Pyrolysebenzin oder durch eine Friedel-Crafts- oder Zeolithkatalysierte Gas- oder Flüssigphasen-Alkylierung von Benzol mit Ethen gewonnen.[13] Ethylbenzol wird fast ausschließlich zur Herstellung von Styrol verwendet.
Dabei ist die katalytische Dehydrierung von Ethylbenzol der geläufigste Prozess. Ethylbenzol wird dazu mit einem zehn- bis fünfzehnfachen Überschuss von Hochdruckdampf über einen alkalisch gestellten Eisen(II)-oxid-Kontakt dehydriert.[14]
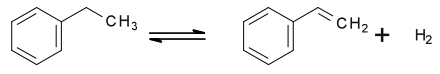
Der Kontakt enthält meist einige Prozent an Natriumoxid oder Natriumcarbonat. Der Wasserdampf dient als Lieferant der benötigten Reaktionswärme und reagiert mit auf dem Katalysator abgeschiedenen Koks zu Kohlenstoffmonoxid und Wasserstoff und weiter in einer Wassergas-Shift-Reaktion zu Kohlenstoffdioxid und Wasserstoff.[15]
Industrielle Anlagen bestehen zumeist aus einer Reihe von Festbettreaktoren, wobei Umsätze von 70 bis 75 % bei Selektivitäten von 93 bis 97 % zum Styrol erhalten werden. Das Rohprodukt wird durch Destillation von den Beiprodukten wie Toluol und höher alkylierten Benzolen sowie dem unumgesetzten Benzol getrennt. Dabei werden zur Vermeidung der Styrolpolymerisation Radikalfänger wie nitrierte Phenole verwendet.
Shell SMPO-Verfahren
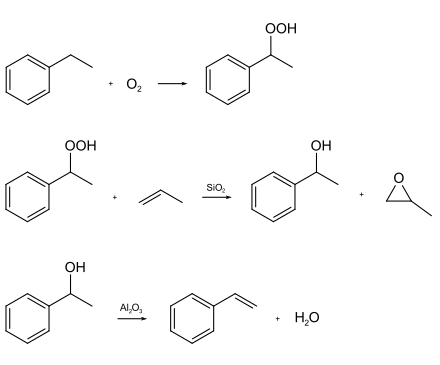
Bei der indirekten Propenoxidation (Shell SMPO-Verfahren = Styrene Monomer & Propylene Oxide) wird Ethylbenzol bei ungefähr 2 bar und 150 °C zu Ethylbenzolhydroperoxid peroxidiert. Das Ethylbenzolhydroperoxid epoxidiert Propen bei hohem Druck und 115 °C an Titan auf Siliciumdioxid zu Propylenoxid.[16] Hierbei entsteht 1-Phenylethanol. Dieses wird bei circa 200 °C über Aluminiumoxid zu Styrol dehydratisiert. In Deutschland werden nur etwa 10 % des hergestellten Styrols über dieses Verfahren hergestellt.
Andere Verfahren
Darüber hinaus gibt es Verfahren, Styrol aus Polystyrol-Produkten zurückzugewinnen, mitunter auch aus Napalm-B.[17] Styrol kann durch Alkylierung von Toluol mit Methanol hergestellt werden. Die eingesetzten Rohmaterialien sind zwar meist preiswerter als die bei der Dehydrierung von Ethylbenzol, dafür ist die Selektivität zum Zielprodukt geringer.[18] Weitere Syntheserouten sind die Dimerisierung von 1,3-Butadien zu 4-Vinylcyclohexen und nachfolgender Dehydrierung und die Tetramerisierung von Ethin als Nebenprodukt der Cyclooctatetraen-Synthese nach Walter Reppe.[19]
Laborsynthesen
Im Labor kann Styrol durch Trockene Destillation von Zimtsäure unter Decarboxylierung dargestellt werden. Es ist die Methode der historischen Erstdarstellung.[20]
Eine andere Methode stellt die Herstellung aus Polystyrol dar. Dazu wird Polystyrol unter Wärmezufuhr zu Styrol depolymerisiert. Anschließend kann das Reaktionsprodukt mittels Destillation aus dem Reaktionsgemisch abgetrennt werden.[21]
Eigenschaften
Physikalische Eigenschaften
Styrol ist in Wasser mit 240 mg/l bei 20 °C[2] nur sehr wenig, in Aceton, Ether, Kohlenstoffdisulfid, Dichlormethan und Alkohol gut löslich. Styrol bricht das Licht mit einem Brechungsindex von 1,5458 noch stärker als Benzol. Die Viskosität beträgt 0,7 mPa·s (20 °C). Die Energie der Konjugation der Doppelbindung der Vinylgruppe mit dem Benzolring beträgt etwa 29 kJ/mol und ist damit höher als die der Konjugation eines Doppelbindungssystems.[22]
Chemische Eigenschaften
Styrol riecht angenehm süßlich, die Geruchsschwelle liegt zwischen 0,43 und 866 mg·m−3 (gemäß Stoffmerkblatt: 0,02–3,4 mg·m−3). Styrol polymerisiert schon bei Raumtemperatur zu einer gelben, klebrigen Flüssigkeit, deshalb wird sie mit bis zu 50 ppm von 4-tert-Butylbrenzcatechin oder Hydrochinon stabilisiert. Die Stabilisatoren wirken nur in Anwesenheit von geringen Mengen Sauerstoff, da sie zunächst als Antioxidationsmittel wirken, die bei der Oxidation der Stabilisatoren entstehenden Produkte wirken als Inhibitoren. Bei Licht-, Sauerstoff- oder Wärmeeinwirkung kommt es zu einer deutlichen Beschleunigung der Polymerisation, daher wird es in dunklen Gläsern und an kühleren Orten gelagert.
| Relative Anordnung der Phenylreste im Polystyrol |
|---|
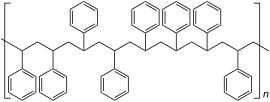 Ataktisches Polystyrol |
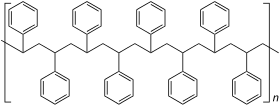 Syndiotaktisches Polystyrol |
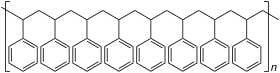 Isotaktisches Polystyrol |
Die Polymerisationseigenschaften des Styrols sind außergewöhnlich: Es geht thermische, radikalische, koordinative, anionische sowie kationische Polymerisationen ein. So kann zum Beispiel für eine kationische Polymerisation dem Styrol Eisenchlorid zugegeben werden. Wenn das Styrol mithilfe eines Bunsenbrenners zum Sieden gebracht wird, kann es aus der Flamme genommen werden und es reagiert von alleine zu Polystyrol weiter. Bei der thermischen Polymerisation wird Styrol einfach der Hitze ausgesetzt. Bei der radikalischen Polymerisation verbindet sich ein Radikal mit dem Styrol, wodurch das Styrol selbst zum Radikal wird. Als Radikalstarter werden häufig organische Peroxide wie das Dibenzoylperoxid verwendet. Diese Styrolradikale können polymerisieren. Am Ende verbinden sich wieder zwei Radikale (Kettenabbruch). Je nach Katalysator kann ataktisches, syndiotaktischer oder isotaktisches Polystyrol gewonnen werden. Die Polymerisationswärme beträgt −70 kJ·mol−1 bzw. −670 kJ·kg−1.[23]
Das Reaktionsverhalten des Styrols ist von der Konkurrenz der Vinylgruppe und dem aromatischen Ring geprägt. Daher reagiert es in vielen Fällen anders als zum Beispiel Benzol. Einige Elektrophile, die zu Additionsreaktionen neigen, und Radikale greifen bevorzugt an der Vinylgruppe an, da dort im Übergangszustand der Reaktion kein aromatischer Zustand aufgehoben werden muss, wie dies beim Angriff am Ring der Fall ist. Typische elektrophile Substitutionsreagenzien, die üblicherweise nicht an Alkene addieren, substituieren das Styrol am Ring. Beispiele hierfür sind die Nitrierung und die Sulfonierung. Mit Halogenen dagegen ist die Addition an die Vinylgruppe deutlich schneller als die Substitutionsreaktion am Aromaten.
Die Vinylgruppe reagiert mit Peroxycarbonsäuren in einer elektrocyclischen Reaktion zu Styroloxid.
Sicherheitstechnische und Umweltkenngrößen
Styrol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von ca. 32 °C. Der Explosionsbereich liegt zwischen 0,97 Vol.‑% (42 g/m3) als untere Explosionsgrenze (UEG) und 7,7 Vol.‑% (334 g/m3) als obere Explosionsgrenze (OEG).[24][2] Der maximale Explosionsdruck beträgt 7,5 bar.[2] Die Zündtemperatur beträgt 490 °C.[24][2] Der Stoff fällt somit in die Temperaturklasse T1.
Styrol ist wassergefährdend (WGK 2), jedoch ist es biologisch über lange Zeit gesehen abbaubar.
Verwendung
_1975%252C_MiNr_503.jpg.webp)
Styrol wird zu vielen Kunststoffen weiterverarbeitet. Ein wichtiges ist das Polystyrol. 1997 wurden 0,66 Millionen Tonnen Polystyrol aus Styrol hergestellt, somit wurden über 60 % des Styrols zu Polystyrol verarbeitet, Polystyrol ist damit einer der wichtigsten Kunststoffe überhaupt. Polystyrol in geschäumter Form findet neben PU-Schäumen als wichtigstes Thermoisoliermaterial in der Baustoffindustrie als auch als Transportschutz von Industrie- und Konsumgütern Anwendung.
Copolymere des Styrols (Polymer aus mehreren Monomeren) sind zum Beispiel das Acrylnitril-Butadien-Styrol (ABS), das Styrol-Acrylnitril (SAN), das Styrol-Butadien (SB) und das Acrylnitril-Styrol-Acrylester (ASA). Styrol ist zudem ein wichtiger Rohstoff bei der Fertigung von ungesättigten Polyesterharzen (UP-Harze). Hierin ist es zu 50–70 % enthalten um bei der Aushärtung gemeinsam mit den Maleinsäure-haltigen Polyestern zu polymerisieren (Copolymerisation).
Toxikologie
Styrol wird über die Atmungsorgane, weniger über die Haut, aufgenommen und lagert sich hauptsächlich in Leber, Niere, Gehirn und im Fettgewebe ab. Es reizt die Atemwege, Haut, Augen und Schleimhäute. Bei Inhalation und Verschlucken kann es zu unspezifischen Symptomen wie Konzentrationsschwäche, Müdigkeit, Übelkeit, Schwindel, Kopfschmerzen und Erregungszuständen kommen. Styrol wird nach etwa einem halben Tag über den Harn ausgeschieden. Eine berufliche Exposition kann bei Männern zu Veränderungen im Spermiogramm führen.[25] Styrol kann den Zeitraum bis zu einer gewollten Schwangerschaft verlängern.[25] Der Arbeitsplatzgrenzwert beträgt 20 ml/m3.[2] Styrol ist vermutlich ototoxisch im Menschen.[26]
Literatur
- Beratergremium für Umweltrelevante Altstoffe (BUA) der Gesellschaft Deutscher Chemiker (Hrsg.): Styrol (Ethenylbenzol). Wiley/VCH, Weinheim 1990, ISBN 3-527-28255-6 (Gesellschaft Deutscher Chemiker. BUA-Stoffbericht 48).
Weblinks
Einzelnachweise
- Eintrag zu STYRENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Mai 2020.
- Eintrag zu Styrol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Styrol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Eintrag zu Styrene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 100-42-5 bzw. Styrol), abgerufen am 2. November 2015.
- New Process for Producing Styrene Cuts Costs, Saves Energy, and Reduces Greenhouse Gas Emissions, bei eere.energy.gov. (PDF; 282 kB) Abgerufen am 18. Oktober 2013.
- Eduard Simon: Ueber den flüssigen Storax (Styrax liquidus) in Ann. Chem. Pharm. 31 (1839) 265–277, doi:10.1002/jlac.18390310306
- John Blyth, August Hofmann: Über das Styrol und einige seiner Zersetzungsproducte. In: Justus Liebigs Annalen der Chemie. 53.3, 1845, S. 289–329, doi:10.1002/jlac.18450530302.
- Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 150 (PDF).
- H. Staudinger, A. Steinhofer: Über hochpolymere Verbindungen. 107. Mitteilung. Beiträge zur Kenntnis der Polystyrole. In: Justus Liebigs Annalen der Chemie. 517, 1935, S. 35–53, doi:10.1002/jlac.19355170104.
- K. J. Schwarz, R. Stübner, F. J. Methner: Formation of styrene dependent on fermentation management during wheat beer production. In: Food Chem. 134(4), 15. Oct 2012, S. 2121–2125. PMID 23442664.
- Fangfang Wang, Yajun Wang: Safety Assessment of Production Process of Styrene. In: Procedia Engineering. 45, 2012, S. 139–143, doi:10.1016/j.proeng.2012.08.134.
- G. Bellussi: Liquid-Phase Alkylation of Benzene with Light Olefins Catalyzed by β-Zeolites. In: Journal of Catalysis. 157, 1995, S. 227–234, doi:10.1006/jcat.1995.1283.
- M. Muhler: The nature of the iron oxide-based catalyst for dehydrogenation of ethylbenzene to styrene 2. Surface chemistry of the active phase. In: Journal of Catalysis. 138, 1992, S. 413–444, doi:10.1016/0021-9517(92)90295-S.
- Ailing Sun, Zhangfeng Qin, Jianguo Wang: Reaction coupling of ethylbenzene dehydrogenation with water-gas shift. In: Applied Catalysis A: General. 234, 2002, S. 179–189, doi:10.1016/S0926-860X(02)00222-3.
- J. K. F. Buijink, J. J. M. van Vlaanderen, M. Crocker, F. G. M. Niele: Propylene epoxidation over titanium-on-silica catalysts – the heart of the SMPO process. In: Catalysis Today. 93–95, 2004, S. 199–204, doi:10.1016/j.cattod.2004.06.041.
- Patent US5406010 – Method of reclaiming styrene and other products from polystyrene based products. Abgerufen am 1. Juni 2013.
- Tatsuaki Yashima, Keiichi Sato, Tomoki Hayasaka, Nobuyoshi Hara: Alkylation on synthetic zeolites: III. Alkylation of toluene with methanol and formaldehyde on alkali cation exchanged zeolites. In: Journal of Catalysis., 26, 1972, S. 303–312, doi:10.1016/0021-9517(72)90088-7.
- G. N. Schrauzer: Koordinations-Chemie und Katalyse Untersuchungen. Über die Cyclooctatetraen-Synthese nach W. Reppe. In: Angewandte Chemie. 76, 1964, S. 28–35, doi:10.1002/ange.19640760105.
- R. Fittig, F. Binder: Ueber die Additionsproducte der Zimmtssaure. In: Rudolph Fittig, Camille Petri: Untersuchungen über die ungesättigten Säuren. I. Weitere Beiträge zur Kenntnifs der Fumarsäure und Maleïnsäure. In: Justus Liebigs Annalen der Chemie. Volume 195, 1879, S. 56–179, doi:10.1002/jlac.18791950103.
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 275.
- L. Pauling: Die Natur der chemischen Bindung. Verlag Chemie, Weinheim 1973, ISBN 3-527-25217-7, S. 276.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme. Ausgabe 05/2015, ISBN 978-3-86825-069-5.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- M. Roller: Arbeitsbedingte Störungen der Reproduktion bei Umgang mit Gefahrstoffen – eine Informationsschrift. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Projekt-Nr. F 1925: Reproduktionsstörungen durch Gefahrstoffe am Arbeitsplatz.
- P. Hoet, D. Lison: Ototoxicity of toluene and styrene: state of current knowledge. In: Crit Rev Toxicol. Band 38, Heft 2, 2008, S. 127–170. doi:10.1080/10408440701845443. PMID 18259983.


