Heptalen
Heptalen ist ein bicyclischer ungesättigter Kohlenwasserstoff, bestehend aus zwei anellierten Cycloheptatrien-Ringen. Wie Pentalen ist es eine homologe Verbindung von Naphthalin. Gemäß der Hückel-Regel ist diese Verbindung mit 12 π-Elektronen nicht zu den Aromaten zu rechnen, vielmehr handelt es sich um ein antiaromatisches System, das sich wie ein nicht mesomeriestabilisiertes Polyen verhält.[2]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
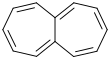 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Heptalen | ||||||||||||
| Andere Namen |
Bicyclo[5.5.0]dodecahexaen | ||||||||||||
| Summenformel | C12H10 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 154,21 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung
Es gibt mehrere Routen zur Darstellung von Heptalen, bei denen formal ein carbocyclisches Gerüst mit 10 C-Atomen durch Addition einer C2-Komponente in das Heptalen überführt wird. Als Ausgangskomponente kann Naphthalin, bzw. 1,4,5,8-Tetrahydronaphthalin oder Azulen verwendet werden.
Beispiel für eine mehrstufige Heptalen-Synthese nach Emanuel Vogel:
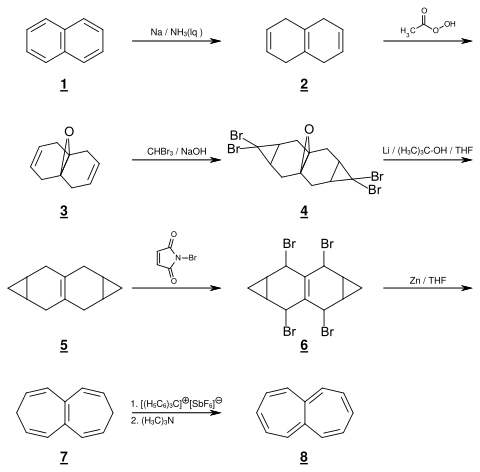
Ausgehend von Naphthalin 1 erhält man mittels einer Birch-Reduktion 1,4,5,8-Tetrahydronaphthalin[3] 2. Die Brückenkopf-Doppelbindung wird im nächsten Schritt durch Umwandlung in eine Epoxid-Funktion reversibel geschützt. Das so gebildete Oxiran-Derivat 3 wird durch eine zweifache Carben-Addition mit einem hohen Bromoform-Überschuss und 50%iger Natronlauge in den Pentacyclus 4 überführt, der dann mit Lithium und tert-Butanol in Tetrahydrofuran zu dem Tetracyclus 5 reduziert wird. Anschließend wird mit N-Bromsuccinimid eine Allyl-Bromierung durchgeführt (Wohl-Ziegler-Reaktion). Zwischenprodukt 6 wird mit Zink in THF unter Öffnung der beiden Dreiringe zu 3,8-Dihydroheptalen 7 dehalogeniert. Die Überführung der Verbindung 7 in die Zielverbindung 8 gelingt mit einer zweistufigen Oxidation mit Triphenylmethylhexafluoroantimonat und Trimethylamin.
Eigenschaften
Das unsubstituierte Heptalen ist eine instabile Verbindung. Durch Behandlung mit Säuren lässt sie sich relativ einfach und reversibel in das entsprechende Heptalenium-Salz überführen. Die Heptalenium-Salze können daher als Heptalen-Konserve benützt werden[4].
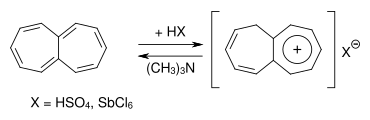
Das Heptalenium-Salz mit dem Cycloheptatrienylium-Strukturelement ist eine aromatische Verbindung.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Hans Beyer: Lehrbuch der Organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1976, ISBN 3-7776-0342-2, S. 575 f.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,4,5,8-Tetrahydronaphthalin: CAS-Nummer: 493-04-9, EG-Nummer: 207-773-5, ECHA-InfoCard: 100.007.067, PubChem: 68121, ChemSpider: 61429, Wikidata: Q83070531.
- Gerhard Becker, Heinz Kolshorn: Heptalene. In: Heinz Kropf (Hrsg.): Houben-Weyl Methods of Organic Chemistry. Vol. V/2c. Georg Thieme Verlag, Stuttgart, New York 1985, ISBN 3-9801412-1-7, S. 418 ff. (eingeschränkte Vorschau in der Google-Buchsuche).