Pyren
Pyren ist ein weißlich gelber Feststoff, der als Pulver oder als Plättchen anfällt. Es gehört zu den polycyclischen aromatischen Kohlenwasserstoffen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
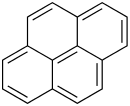 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyren | |||||||||||||||
| Andere Namen |
Benzo[def]phenanthren | |||||||||||||||
| Summenformel | C16H10 | |||||||||||||||
| Kurzbeschreibung |
In reinem Zustand farblose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 202,26 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,21 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: persistent, bioakkumulativ und toxisch (PBT), sehr persistent und sehr bioakkumulativ (vPvB)[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Der französische Chemiker Auguste Laurent (1807–1853) erhielt es im Jahr 1837 aus Steinkohlenteer noch in unreiner Form.[7] In reiner Form konnte es der deutsche Chemiker Carl Graebe 1870 aus Steinkohlenteer destillieren.[8] Die wahre Konstitution konnte 1887 durch Eugen Bamberger und Max Philip ermittelt werden.[9] Die erste Synthese gelang Richard Weitzenböck 1913.[10][11]
Vorkommen
Pyren kommt praktisch in allen Produkten einer unvollständigen Verbrennung, in fossilen Brennstoffen und mit einem Gehalt von etwa 2 % im Steinkohlenteer vor.[1][3]
Gewinnung und Darstellung
Pyren kann durch eine fraktionierte Destillation aus Steinkohlenteer gewonnen werden.[1][3] Eine Synthese gelingt beim Durchleiten eines Gemisches aus Ethin und Wasserstoff durch Porzellanröhrchen bei 650 °C.[12]
Eigenschaften
Das Absorptionsspektrum ist, wie für viele PAK typisch, dreifach Kamm-ähnlich strukturiert (vergleiche Perylen, Diindenoperylen). Die langwelligste Hauptabsorptionsbande liegt bei 335 nm. Die Hauptfluoreszenzbande besitzt es bei ca. 388 nm.
Pyren bildet in konzentrierter Lösung (Hexan, Cyclohexan, Decalin oder ähnlichen Kohlenwasserstoffen) mit sich selbst bei Anregung mit UV-Licht sogenannte Excimere (excited dimers). Diese Excimere haben in Lösungen, anders als verdünnte Lösungen von Pyren, eine Fluoreszenzbande bei ca. 466 nm. Die Excimerenbildung hängt maßgeblich von der Viskosität des verwendeten Lösungsmittels ab, welches wiederum von der Temperatur abhängt. In Anwesenheit von Quenchern (Fluoreszenzlöscher), wie beispielsweise Sauerstoff, sinkt die Fluoreszenzquantenausbeute des Excimers deutlich. Dies hängt damit zusammen, dass ein Excimer aus einem angeregten und einem nicht angeregten Pyren entsteht und das angeregte Pyren durch die Anwesenheit von Sauerstoff als Quencher wieder in den Grundzustand wechselt. Pyren geht, anders als beispielsweise Anthracen, bei UV-Anregung keine [4+4]-Cycloaddition mit sich selbst ein, sodass die Excimere nur die Möglichkeit haben, entweder wieder zu dissoziieren oder strahlend bzw. nicht strahlend in den Grundzustand zu wechseln.
Verwendung
Es wird als Sondenmolekül in der Fluoreszenzspektroskopie verwendet.
Sicherheitshinweise
Es ist als reizend eingestuft, es rötet Haut und Augen, ein MAK-Wert ist dennoch nicht festgelegt.
Einzelnachweise
- Eintrag zu Pyren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. November 2021.
- Eintrag zu Pyren in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- R. Schmidt, K. Griesbaum, A. Behr, D. Biedenkapp, H.-W. Voges, D. Garbe, C. Paetz, G. Collin, D. Mayer, H. Höke: Hydrocarbons, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2015; doi:10.1002/14356007.a13_227.pub3.
- Tsypkina, O.Y.: Study of Vacuum Pressure Influence on Efficiency of Separation of Some Polynuclear Compounds of Coal Tar Rectifications in Zh. Prikl. Khim. (Moscow) 28 (1955) 185–192.
- LAWA Expertenkreis Stoffe: Stoffdatenblatt: Pyren, Stand 17. März 2010, abgerufen am 12. September 2016.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 21. Januar 2019.
- Laurent, A.: in Ann. de chimie et physique 66 (1837) 136.
- Graebe, C.; Liebermann, C.: Ueber die hochsiedenden Destillationsproducte des Steinkohlenteers. II Ueber Pyren in Chem. Ber. 3 (1870) 742–746, doi:10.1002/cber.18700030222.
- Bamberger, E.; Philip, M.: in Ann. Chem. Pharm 240 (1887) 147.
- Weitzenböck, R.: Eine Synthese des Pyrens in Monatshefte Chem. 34 (1913) 193–223, doi:10.1007/BF01517748.
- Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 144 pdf.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1145.
