Mesitylen
Mesitylen (1,3,5-Trimethylbenzol) ist ein mit drei Methylgruppen substituiertes Benzol und damit ein Alkylbenzol und ein aromatischer Kohlenwasserstoff. Es gehört mit seinen Isomeren Hemellitol (1,2,3-Trimethylbenzol) und Pseudocumol (1,2,4-Trimethylbenzol) zur Stoffgruppe der Trimethylbenzole und auch zur Gruppe der C3-Benzole.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
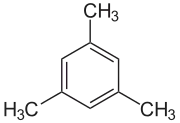 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mesitylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H12 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit ölig aromatischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,87 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
165 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,49937 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
20 ml·m−3 bzw. 100 mg·m−3[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte
Mesitylen wurde erstmals im Jahre 1837 von dem irischen Chemiker Robert Kane hergestellt, indem er Aceton mit konzentrierter Schwefelsäure erhitzte.[5] Er nannte die neue Substanz „Mesitylen“, weil der deutsche Chemiker Carl Reichenbach Aceton „Mesit“ (nach griechisch μεσίτης ‚der Mediator‘) genannt hatte;[6] und Kane war der Ansicht, dass seine Reaktion Mesit entwässert hatte, mit einer Umwandlung in ein Alken, dem „Mesitylen“.[7] Doch Kanes Bestimmung der chemischen Zusammensetzung des Mesitylens war nicht zutreffend. Die korrekte empirische Formel wurde von August Wilhelm von Hofmann im Jahre 1849 gefunden.[8] Im Jahre 1866 zeigte Adolf von Baeyer, dass die Struktur des Mesitylens mit der von 1,3,5-Trimethylbenzol übereinstimmt.[9] Der schlüssige Beweis, dass Mesitylen identisch mit 1,3,5-Trimethylbenzol war, wurde von Albert Ladenburg im Jahre 1874 erbracht.[10]
Von Mesitylen leiten sich namentlich und strukturell unter anderem die Verbindungen Mesitol (2,4,6-Trimethylphenol) und Mesidin (2,4,6-Trimethylanilin) ab.
Vorkommen und Darstellung
Mesitylen kommt in Petroleum und Steinkohlenteer vor. Es wird aus Aceton über Destillation mit Schwefelsäure gewonnen.[11]
Eigenschaften
Physikalische Eigenschaften
Mesitylen ist eine farblose Flüssigkeit mit einem Schmelzpunkt von −45 °C und bei Normaldruck einem Siedepunkt von 165 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,19927, B = 1569,622 und C = −63,572 im Temperaturbereich von 354,64 bis 438,87 K.[12] Es hat einen ölig aromatischen Geruch. In Wasser ist es unlöslich; in Benzol, Ether und Ethanol ist es gut löslich.
Sicherheitstechnische Kenngrößen
Mesitylen bildet oberhalb der Flammpunktstemperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 44 °C.[1][13] Der Explosionsbereich liegt zwischen 0,96 Vol.‑% (48 g/m3) als untere Explosionsgrenze (UEG) und 7,3 Vol.‑% (365 g/m3) als obere Explosionsgrenze (OEG).[1][13] Entsprechend der Dampfdruckfunktion ergibt sich ein unterer Explosionspunkt von 39 °C.[1] Die Grenzspaltweite wurde mit 0,98 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[13] Die Zündtemperatur beträgt 550 °C.[1][13] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
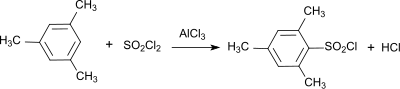
Mesitylen wird als Lösungsmittel für Harze und Gummi sowie zur organischen Synthese (zum Beispiel von Antioxidantien) verwendet. Durch Reaktion mit Sulfurylchlorid und Aluminiumchlorid kann Mesitylensulfochlorid gewonnen werden.[14]
Gesundheitsgefahren
Inhalation und Verschlucken führen zu Schläfrigkeit, Kopfschmerzen, Husten, Mattigkeit und Halsschmerzen. Der Stoff reizt die Haut (sie wird durch den Stoff entfettet), Augen und Atmungsorgane. Die Dämpfe wirken dazu in höherer Konzentration narkotisierend.
Literatur
- H. W. Earhart, Andrew P. Komin: Polymethylbenzenes. In: Kirk-Othmer Encyclopedia of Chemical Technology, 2000, doi:10.1002/0471238961.1615122505011808.a01
Weblinks
- Eintrag zu Mesitylen. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 30. Dezember 2012.
Einzelnachweise
- Eintrag zu 1,3,5-Trimethylbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Mesitylen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-504.
- Eintrag zu Mesitylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Robert Kane: On a Series of Combinations derived from Pyroacetic Spirit. In: Transactions of the Royal Irish Academy, 1839, 18, S. 99–125 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. Reichenbach: Ueber Mesit (Essiggeist) und Holzgeist. In: Annalen der Pharmacie, 1834, 10 (3), S. 298–314 (eingeschränkte Vorschau in der Google-Buchsuche).
- Henry E. Roscoe: A Treatise on Chemistry. D. Appleton and Co., New York NY 1889, Vol. III, S. 102, Fußnote 2.
- A. W. Hofmann: On the Composition of Mesitilole, and some of its derivatives. In: The Quarterly Journal of the Chemical Society of London, 1849, 2, S. 104–115 (eingeschränkte Vorschau in der Google-Buchsuche). (Anm.: Die empirische Formel von Mesitylen – wie in Hofmanns Papier mit C18H12 angegeben – ist falsch, da Hofmann die 6 als Atomgewicht des Kohlenstoffs verwendete, anstelle des richtigen Atomgewichts von 12. Sobald das richtige Atomgewicht in Hofmann Berechnungen verwendet wird, geben seine Ergebnisse die korrekte Summenformel von C9H12.)
- Adolf von Baeyer: Ueber die Condensationsproducte des Acetons. In: Annalen der Chemie und Pharmacie, 1866, 140, S. 297–306 (eingeschränkte Vorschau in der Google-Buchsuche).
- Albert Ladenburg: Ueber das Mesitylen. In: Berichte der deutschen chemischen Gesellschaft, 1874, 7, S. 1133–1137 (Digitalisat auf Gallica).
- R. Adams, R. W. Hufferd: Mesitylene In: Organic Syntheses. 2, 1922, S. 41, doi:10.15227/orgsyn.002.0041; Coll. Vol. 1, 1941, S. 341 (PDF).
- Forziati, A.F.; Norris, W.R.; Rossini, F.D.: Vapor Pressures and Boiling Points of Sixty API-NBS Hydrocarbons in J. Res. Natl. Bur. Stand. (U.S.) 43 (1949) S. 555–563 (doi:10.6028/jres.043.050).
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- A. Töhl, O. Eberhard: Ueber die Einwirkung des Sulfurylchlorids auf aromatische Kohlenwasserstoffe. In: Ber. Dtsch. Chem. Ges. Band 26, 1893, S. 2940–2945, doi:10.1002/cber.189302603118.



